II. ÉVOLUTION DE LA STRATÉGIE VACCINALE ET DE LA PHARMACOVIGILANCE DEPUIS JUIN 2022
A. DE NOUVEAUX VACCINS ADAPTÉS AUX VARIANTS CIRCULANT ET DE NOUVELLES PLATEFORMES VACCINALES
Comme cela était indiqué dans le rapport d'étape de l'Office de juin 2022, les premiers vaccins contre la covid-19 ont bénéficié d'autorisations de mise sur le marché (AMM) conditionnelles, procédure permettant leur commercialisation sur la base de données cliniques incomplètes en raison du bénéfice apporté par leur disponibilité immédiate, dépassant le risque représenté par les données manquantes.
Grâce aux données fournies par les industriels, démontrant l'efficacité et la sécurité des différents vaccins, ces autorisations conditionnelles ont été transformées en AMM standards : le 3 octobre 2022 et le 10 octobre 2022 pour les vaccins à ARNm Spikevax de Moderna et Comirnaty de Pfizer-BioNTech, le 31 octobre 2022 et le 10 janvier 2023 pour les vaccins à vecteur adénoviral Vaxzevria d'AstraZeneca et Jcovden de Janssen et le 4 juillet 2023 pour le vaccin à protéine recombinante Nuvaxovid de Novavax.
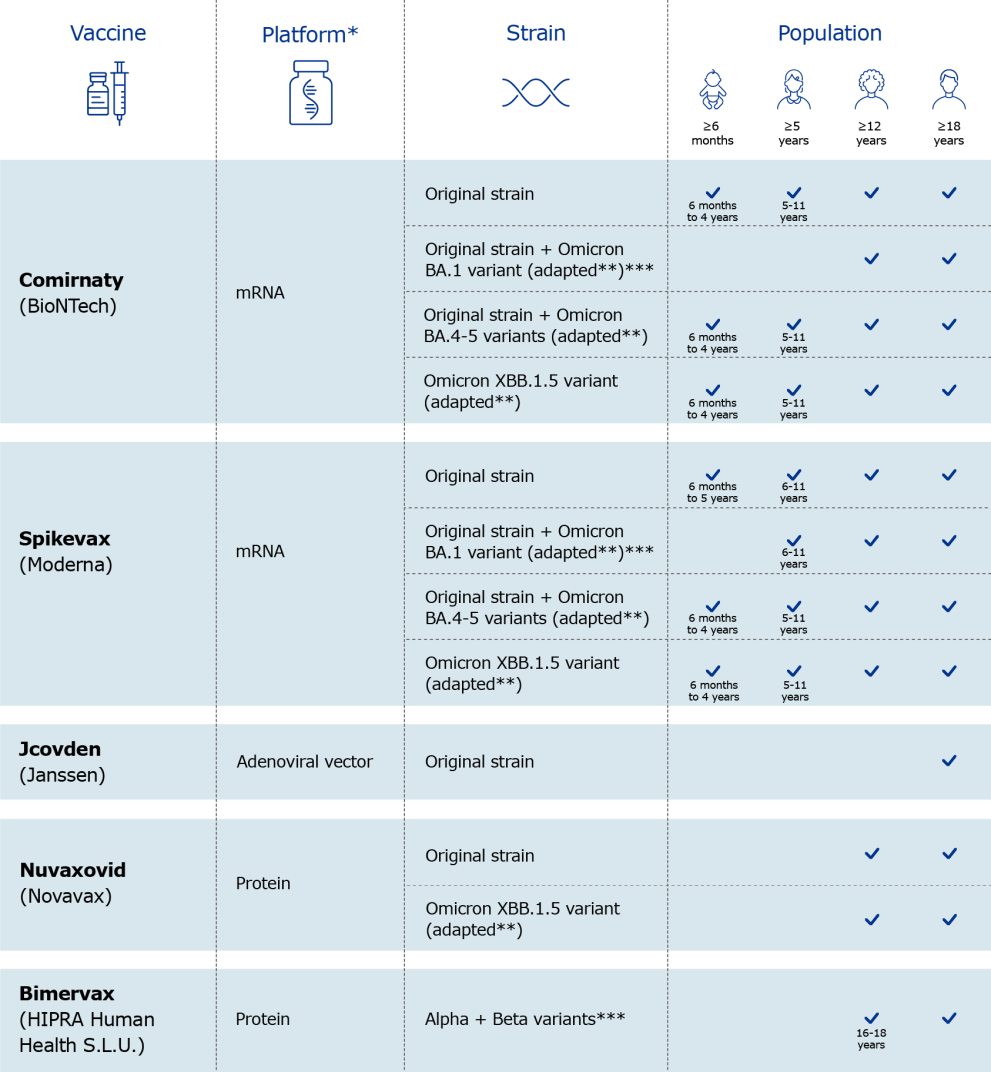
Pour faire face à l'évolution du virus, des vaccins adaptés aux nouvelles souches circulantes du SARS-CoV-2 ont été autorisés par l'Agence européenne des médicaments (EMA). Ces autorisations ont été accordées selon une approche réglementaire similaire à celle utilisée pour les mises à jour saisonnières des vaccins contre la grippe, appelée procédure de variation, qui permet une adaptation rapide de vaccins déjà autorisés. Des vaccins bivalents ciblant, en plus de la souche originale, les variants Omicron BA.1 puis Omicron BA.4-5 ont ainsi été autorisés : le 1er septembre 2022 pour Comirnaty et Spikevax ciblant BA.1, le 12 septembre 2022 pour Comirnaty et le 20 octobre 2022 pour Spikevax ciblant BA.4-5. Plus récemment, des vaccins monovalents adaptés au variant Omicron XBB.1.5 ont également été autorisés selon cette même procédure : le 31 août 2023 pour Comirnaty, le 15 septembre 2023 pour Spikevax et le 31 octobre 2023 pour Nuvaxovid. Des versions adaptées aux enfants, contenant une plus faible dose de substance active, ont également été autorisées postérieurement (voir figure ci-après).
De nouveaux vaccins se sont également vu octroyer des autorisations de mise sur le marché par l'EMA : le vaccin à virus entier inactivé VLA2001 de Valneva en primovaccination, le 24 juin 2022, et les vaccins à protéine recombinante VidPrevtyn Beta de Sanofi-GSK, le 10 novembre 2022, et Bimervax de Hipra, le 30 mars 2023, en tant que dose de rappel (ces deux derniers vaccins ciblant respectivement le variant Beta et les variants Alpha et Beta).
Vue d'ensemble des vaccins contre la covid-19 autorisés par l'Agence européenne des médicaments
Source : Reproduction à partir du site de l'EMA10(*)
En France, la Haute Autorité de santé (HAS) a estimé fin décembre 2022 que, compte tenu des données d'efficacité disponibles, du contexte épidémique et de la disponibilité d'alternatives vaccinales, l'intégration du vaccin VLA2001 dans la stratégie de primovaccination n'était pas justifiée11(*).
De même, en raison d'un potentiel risque de péricardite détecté au cours des essais cliniques et de la disponibilité d'alternatives vaccinales, la HAS a décidé en juin 2023 de ne pas recommander l'utilisation du vaccin Bimervax en tant que dose de rappel12(*). Enfin, préférant privilégier les vaccins adaptés aux souches circulantes majoritaires, la HAS ne recommande plus le vaccin Vidprevtyn Beta depuis la mise à disposition du vaccin Nuvaxovid adapté à la souche XBB.1.5 du variant Omicron, celui-ci pouvant servir d'alternative pour les personnes qui ne souhaitent pas ou ne peuvent pas recevoir un vaccin à ARNm13(*).
Aussi, la stratégie vaccinale de rappel actuelle recommande l'utilisation préférentielle d'un vaccin à ARNm (uniquement Comirnaty pour les personnes de moins de 30 ans éligibles, en raison du risque de myocardite et de péricardite lié au vaccin Spikevax) et, en seconde intention, le vaccin Nuvaxovid pour les personnes qui ne souhaitent pas ou ne peuvent pas en bénéficier en raison d'une contre-indication.
* 10 EMA, COVID-19 vaccines: strains, use and age ranges ( https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/covid-19-medicines).
* 11 HAS, Stratégie de vaccination contre la covid-19 : Place du vaccin VLA2001, 2022 ( https://www.has-sante.fr/jcms/p_3394248/fr/strategie-de-vaccination-contre-la-covid-19-place-du-vaccin-vla2001).
* 12 HAS, Stratégie de vaccination contre la covid-19 : Place du vaccin Bimervax (PHH-1V), 2023 ( https://www.has-sante.fr/jcms/p_3444521/fr/strategie-de-vaccination-contre-la-covid-19-place-du-vaccin-bimervax-phh-1v).
* 13 Direction générale de la Santé, Covid-19 : mise à disposition du vaccin adapté Nuvaxovid® XBB.1.5 du laboratoire Novavax, DGS-URGENT N°2023-24, 2023 ( https://sante.gouv.fr/IMG/pdf/dgs-urgent_2023_24_covid-19_novavax.pdf). Les vaccins Jcovden et Vaxzevria avaient été préalablement écartés de la stratégie vaccinale. Voir : HAS, Stratégie vaccinale de rappel contre la covid-19, 2022 ( https://www.has-sante.fr/jcms/p_3367885/fr/strategie-vaccinale-de-rappel-contre-la-covid-19).