J. RECOMMANDATIONS
Cette réflexion sur les IN dans les établissements de santé français se situe dans un contexte d'amélioration continue des procédures et des résultats dans le domaine des IN. De nombreuses recherches sur les IN sont réalisées, de nombreuses recommandations sont produites et appliquées, des tableaux de bord par établissement sont publiés, des plans nationaux d'envergure sont engagés, les résultats sont dans une tendance d'amélioration et la France est plutôt bien située par rapport à ses voisins européens.
Dès lors, que proposer pour améliorer encore les choses dans ce domaine ?
Nous proposons 10 axes de recommandations ; ceux-ci ne constituent pas des nouveautés en la matière, mais plutôt des priorités, des accents particuliers mis sur ces actions qui apparaissent indispensables.
De fait, tous les éléments contenus dans les plans nationaux sont importants, certains sont déjà bien avancés dans leur réalisation, mais il n'est sans doute pas inutile d'insister sur quelques points particulièrement importants.
Il en est un sur lequel nous ne faisons pas de recommandation ici, car ce thème sort de notre champ d'étude, mais il est incontestable que les modifications du comportement des personnels de santé passent par l'éducation de ces personnes au cours de leurs études ; le volet `formation initiale' du programme national est fondamental.
Renforcer les politiques de bon usage des antibiotiques
Les politiques sur le bon usage des antibiotiques sont essentielles, certes pour contrecarrer l'évolution néfaste des IN à bactéries multirésistantes mais aussi et avant tout pour préserver l'efficacité des antibiotiques dans la durée.
Lors des entretiens menés dans le cadre de cette étude, le thème de la résistance aux antibiotiques a constitué le premier point d'amélioration souhaité.
Devant l'ampleur du taux de résistance des bactéries aux antibiotiques, la communauté européenne a rédigé des recommandations sur la base des rapports des états membres concernant l'application de la recommandation (2002/77/CE) du conseil relative à l'utilisation prudente des agents antimicrobiens en médecine humaine (publication décembre 2005). Cette dernière publication souligne entre autres les effets néfastes de l'auto-médication (certains antibiotiques dans certains pays sont en vente sans ordonnance) ou des prescriptions abusives d'antibiotiques, et recommande des contrôles appropriés ou du moins la mise en oeuvre de meilleures pratiques (avec campagne auprès du grand public...).
Outre ces grandes lignes couplant recommandations auprès du grand public et auprès des personnels de santé, des recherches sont réalisées sur la manière dont les antibiotiques sont utilisés dans les établissements de santé. Deux points peuvent être mentionnés :
o les antibiotiques ne devraient pas être donnés systématiquement dans les établissements dès qu'une fièvre est notée, mais seulement après avoir acquis la conviction forte de la présence d'une infection bactérienne justifiant un traitement ;
o une approche qui semble prometteuse est celle qui consiste à utiliser des antibiotiques en rotation, ou encore mieux en rotation très rapide, au jour le jour pour éviter la monotonie antibiotique (mixing).
De nombreuses mesures ont déjà été mises en application en France, notamment les campagnes de communication auprès du grand public de l'assurance-maladie ( « Les antibiotiques, c'est pas automatique » , avec un fort score de mémorisation) et l'inscription dans la convention entre l'assurance-maladie et les médecins de ville d'objectifs en matière de baisse de prescription d'antibiotiques.
Ces actions ont porté leurs fruits puisque le nombre de prescription des antibiotiques en ville a chuté de 13% en 3 ans entre l'hiver 2001-2002 et l'hiver 2003-2004 (en baisse cumulée, à épidémies constantes, données CNAMTS/INSERM/Institut Pasteur), avec même -26% chez les 6-15 ans, et à l'hôpital, le taux de SARM a baissé (28% en 2004 contre 33% en 2002, EARSS). Mais ces résultats doivent être consolidés. L'objectif de baisse en médecine de ville est de -25% en 2007 pour se rapprocher de la moyenne européenne.
Le bilan effectué par la CNAMTS avec l'IPSOS en octobre 2005 indique une évolution lente mais réelle des mentalités : seulement 39% des Français pensent que les antibiotiques permettent de guérir plus vite contre 64% en 2002. Ils ne sont plus que 25% à croire que les antibiotiques font baisser la fièvre contre 39% en 2002. 41% indiquent que les antibiotiques ne sont pas efficaces contre la grippe contre 26% en 2002. Mais des progrès restent à faire : quand on demande si les antibiotiques sont actifs sur les bactéries ou les virus, 36% seulement indiquent qu'ils ne sont actifs que contre les bactéries (contre 30% en 2002), 9% pensent qu'ils ne sont actifs que contre les virus (contre 14% en 2002), 14% pensent qu'ils sont actifs contre les deux (contre 23% en 2002), et 41% ne se prononcent pas !
Une enquête sur le même mode réalisée en janvier 2006 indiquait que 93% des patients comprenaient la décision médicale lorsque la première consultation ne se concluait pas par la prescription d'antibiotiques.
Dans le domaine hospitalier, un accord-cadre relatif au bon usage des antibiotiques dans les établissements de santé a été signé en janvier 2006 entre le Ministère de la Santé, l'assurance-maladie et les fédérations représentatives du monde hospitalier. Le postulat est qu'une amélioration des pratiques en matière de prescription d'antibiotiques devrait se traduire par une réduction de l'utilisation inappropriée des antibiotiques, et donc une réduction de leur utilisation. A ce titre, ce contrat-cadre prévoit une baisse de 10% des consommations sur 3 ans. Les actions envisagées passent par des actions de formation et d'information, la diffusion des référentiels, la mise en place des protocoles de bon usage des antibiotiques, le suivi des consommations. Cet accord prévoit un dispositif d'intéressement des établissements à la réalisation de l'objectif : reversement à l'établissement de 50% des dépenses évitées mesurables. Cet accord-cadre national doit être décliné au plan local.
Peut-on aller plus loin et contraindre davantage les personnels de santé afin de non seulement conserver les améliorations effectuées mais les renforcer ? Les mesures possibles seraient :
o En médecine de ville : la formation au bon usage des antibiotiques doit devenir une priorité (parmi d'autres) dans le cadre de la formation médicale continue (rappelons que les médecins en ville prescrivent des antibiotiques, notamment dans les infections respiratoires, sans diagnostic bactériologique comme les céphalosporines orales de 1ère génération en générique, ce qui devient un vrai problème médical car elles sont devenues inefficaces) ; la formation initiale devrait d'ailleurs aussi être renforcée dans ce domaine ;
o A l'hôpital : la politique à poursuivre en matière de bon usage des antibiotiques reviendrait à créer une organisation dans les établissements de santé similaire à celle qui existe pour l'hygiène ; donc il faudrait donner un support réglementaire à la commission antibiotique qui se met en place dans chaque établissement, et créer une équipe opérationnelle (médecin référent, un bactériologiste, un pharmacien, chacun disposant du temps pour cela). Cette équipe permettrait de remettre la politique des antibiotiques à plat (contrôle de la prescription, listes à prescription restreinte, évaluation du bon usage, protocoles périodiquement révisés...). Notons que pour le traitement curatif par antibiotique, il n'existe pas de protocole institutionnel dans la majorité des établissements en France ; la même remarque que pour les médecins de ville est à faire pour la formation continue ;
o Le suivi de l'usage des antibiotiques (Assurance-Maladie/Institut Pasteur) doit se poursuivre, ce qui devrait être le cas dans le cadre de l'accord-cadre cité ci-dessus.
Renforcer l'application des recommandations en matière d'hygiène dans les établissements de santé et les mesures de prévention
En premier, vient à l'esprit le respect absolu des règles d'hygiène , au bloc opératoire, en USI comme dans les autres services cliniques : se désinfecter les mains, éviter de porter des bagues, etc. En matière d'hygiène des mains, notamment importante pour lutter contre les bactéries multi-résistantes, l'indicateur mis en place sur la consommation des produits hydro-alcooliques va permettre de clarifier la situation et d'identifier les marges de progression.
Par ailleurs, tout moyen évitant de passer par l'observance humaine serait le bienvenu : par exemple sonde urinaire en système clos et scellé, limitation de la durée de sondage, etc. D'une manière générale, les bonnes pratiques d'utilisation des dispositifs invasifs à demeure (sondes, cathéters) doivent être établies et diffusées.
Les deux lieux privilégiés de déclenchement des IN ont fait l'objet de nombreux travaux dans le domaine de la prévention :
o Les unités de soins intensifs
Face aux facteurs de risque comme la présence de dispositifs invasifs tels que cathéters, intubation endotrachéale, la ventilation artificielle (sa durée), les micro-aspirations des sécrétions oropharyngées, différentes recommandations ont été émises, comme :
mise en position demi-assise chaque fois que possible
décontamination sélective locale dans l'oropharynx et par un tube dans l'estomac (cette décontamination n'est pas effectuée en routine à cause de son coût et du risque d'augmenter les résistances aux antibiotiques) ;
quand cela est possible, éviter la pose d'un cathéter urinaire, ou, au moins, diminuer la durée de cette pose ; la pose de cathéter traité par antibiotique n'a pas encore été étudiée chez l'homme quant à son effet sur la diminution de l'incidence des IN urinaires ;
pour la pose des cathéters centraux veineux, la bonne pratique et la formation sont connues pour diminuer le taux d'IN : il faut souligner l'importance de l'application des règles d'hygiène, la surveillance régulière du site du cathéter, leur maintenance. Des cathéters imprégnés d'antiseptiques sont également utilisés mais ces cathéters exposent au risque de développement des résistances aux anti-infectieux.
o Lors des interventions chirurgicales
Selon le rapport HELICS, la surveillance des ISO sera d'autant plus pertinente qu'elle utilisera des protocoles communs entre pays ; dans ces protocoles de surveillance des ISO, seront inclus, entre autres, l'information de sortie des patients, la détermination des niveaux de risque des patients, et l'information sur les micro-organismes impliqués.
La conférence sur la prévention des risques infectieux a proposé certaines recommandations (conférence 5 mars 2004). Par exemple, il n'est pas recommandé de faire un dépistage systématique à la recherche du portage de Staphylococcus aureus sensible à la méticilline, quel que soit le type de chirurgie ; par contre le dépistage nasal du SARM est recommandé chez les patients devant bénéficier d'une chirurgie cardiaque ou orthopédique programmée, et venant de réanimation, de structure de long et moyen séjour ou en cas de lésions cutanées chroniques.
La prophylaxie antibiotique en pré-opératoire fait par ailleurs l'objet de nombreuses publications (SFAR,...), qui précisent les règles strictes en termes de fenêtre d'administration, de produits et de dosages recommandés, et dont le respect est associé à une réduction très sensible du risque infectieux.
Toutes ces recommandations de bonnes pratiques sont connues, diffusées ; elles doivent être appliquées. Il faut à cet égard mettre en oeuvre le tryptique de tout programme de ce type :
o Mesures de prévention, application des recommandations, formation, mise en place des structures de lutte contre les IN
o Audits de pratiques (hygiène des mains, consommations d'antibiotiques, antibioprophylaxie en chirurgie...), revues de morbi-mortalité
o Surveillance des taux
Le deuxième aspect devrait être davantage développé dans les établissements français pour compléter les dispositifs en place. C'est à travers ces audits, ces revues de morbi-mortalité que les pratiques peuvent évoluer. La démarche entreprise par exemple au CHU de Besançon sur les cas de mortalité attribuable aux IN ou au CTO de Strasbourg sur les comportements au bloc opératoire illustrent cela (voir chapitres 3.5 et 9). Ces démarches doivent être encouragées, à travers par exemple l'EPP (évaluation des pratiques professionnelles) , en cours de diffusion en milieu hospitalier.
Vers un statut d'infirmière hygiéniste ?
L'équipe d'hygiène par établissement de santé doit être encore mieux structurée et doit être reconnue.
Une mesure serait de faire reconnaître le statut d'infirmière hygiéniste . Actuellement, l'infirmière hygiéniste n'a pas de statut particulier, et donc pas de grille salariale particulière alors qu'elle a bénéficié de formations complémentaires (sur le modèle des IBODE ou des puéricultrices).
Cette proposition se heurte à des obstacles statutaires divers, à la définition de la formation adaptée, etc. mais pourrait permettre de donner une meilleure visibilité dans les établissements à cette activité et une meilleure reconnaissance aux professionnels qui y travaillent.
Vers la reconnaissance plus officielle du rôle et des responsabilités des médecins hygiénistes dans les hôpitaux.
Les médecins hygiénistes sont souvent trop « seuls » dans les hôpitaux, et les organisations, en particulier structurelles et hiérarchiques, trop mal précisées, ainsi que les missions diverses qui leur sont souvent attribuées. De même, la formation des médecins hygiénistes doit être harmonisée.
Par ailleurs, la répartition sur le territoire des professionnels de l'hygiène n'est pas encore parfaite. Le programme national prévoit la mise en place d'une EOH dans 100% des établissements, mais l'objectif n'est pas encore atteint. Des problèmes de recrutement se posent. La filière « hygiène » doit pouvoir être rendue plus attractive, par exemple en constituant un véritable pôle « sécurité des patients » au sein des établissements (cf. proposition 10), et en mutualisant les moyens sur plusieurs établissements pour les établissements de taille modeste.
Mettre en place des unités de référence pour la prise en charge des infections ostéo-articulaires
Il s'agit d'une mesure du programme national de lutte contre les IN 2005 - 2008. Cette proposition, soutenue au départ par les associations d'usagers et en particulier le LIEN, cherche à offrir la possibilité d'une prise en charge adaptée et spécialisée des patients atteints d'infection ostéo-articulaire, en particulier sur matériel prothétique (mais aussi sur matériel d'ostéosynthèse ou après traumatisme : fractures ouvertes). Elle a pour but d'éviter les complications tardives graves liées à une prise en charge inadaptée de ces infections nécessitant une expertise très spécialisée infectiologique et chirurgicale, et permettre incidemment d'apaiser la relation avec l'équipe médicale initiale.
Ces centres de référence seront constitués d'équipes multidisciplinaires : une équipe chirurgicale orthopédique expérimentée, avec possibilité de bénéficier de compétences en chirurgie plastique, une équipe de microbiologistes, une équipe infectiologique, une équipe d'anesthésistes, un service d'imagerie, un service d'hygiène, un service de rhumatologie, un service de rééducation, une organisation permettant une prise en charge psychologique et sociale. La qualité de la prise en charge qui en résultera comprendra un accès rapide au diagnostic et aux soins les plus appropriés, un diagnostic bactériologique, une stratégie de traitement définie sur la base d'un avis pluri-disciplinaire (réunions de concertations pluridisciplinaires, sur le modèle de la cancérologie) et des référentiels validés et régulièrement actualisés, une prise en charge globale et continue jusqu'au domicile (par exemple hospitalisation à domicile pour poursuivre l'antibiothérapie...). Si un centre ne dispose pas de l'ensemble des compétences, une organisation et un fonctionnement en réseau peuvent être mis en place.
Ce type de proposition est à mettre en oeuvre sans tarder. Les sociétés savantes ont rédigé de façon consensuelle le cahier des charges précisant les missions et modalités de fonctionnement de telles structures. Il revient aux instances de planification de procéder à une sorte d'appel à projets pour recueillir les candidatures des établissements souhaitant constituer un tel pôle de référence.
Le financement de tels centres de référence trouverait sa place naturelle dans l'enveloppe MIGAC (Missions d'intérêt général et d'aide à la contractualisation), les surcoûts du service de la Croix Saint-Simon étant par exemple déjà financés ainsi.
Combien de tels pôles seraient nécessaires en France ?
Heureusement, les infections du site opératoire en orthopédie sont rares, et il n'est pas utile de multiplier ces structures qui auraient par construction un recrutement régional. Si on prend le chiffre de 188 000 interventions orthopédiques avec pose de prothèse ou particulièrement lourdes par an 23 ( * ) (ce qui ne résume pas le risque d'infection en orthopédie, mais le rend particulièrement grave) et que l'on admet que 0,5% de ces interventions donnent lieu à infection profonde ou intermédiaire, on aurait 940 séjours sur le territoire à prendre en charge, soit, pour des durées moyennes de séjour de l'ordre de 30 jours au vu de la lourdeur de ces cas, une occupation de 91 lits. Sur la base d'unités de 15 lits, il faudrait mettre en place de l'ordre de 6 unités au minimum. Comme la pose de prothèses n'est pas la seule source d'infection du site opératoire, et qu'il faut aussi prendre en charge les infections ostéo-articulaires non nosocomiales (ostéomyélites...), mais qu'à l'inverse certains patients ne seront pas orientés vers ces structures pour des raisons diverses, le chiffre de 7 à 8 unités paraît réaliste. Des évaluations plus précises devraient bien sûr être menées mais tel est l'ordre de grandeur.
Constituer un registre des patients porteurs de prothèses orthopédiques
Ce projet de registre concernant les prothèses orthopédiques est ancien, et ne se justifie d'ailleurs pas seulement par le suivi souhaitable des patients susceptibles (pour une faible proportion d'entre eux) de développer une infection acquise lors de l'intervention. Mais ce registre, qui consisterait à avoir un suivi précis des patients porteurs de prothèses, permettrait d'évaluer dans le temps l'ensemble des complications liées à la prothèse. La SOFCOT avait proposé de promouvoir un tel projet afin d'optimiser la traçabilité des implants. Ce projet pourrait faire l'objet d'une expérimentation dans 2 ou 3 régions pour démarrer, à titre de test de faisabilité.
Seul un tel observatoire permettrait de mieux connaître quantitativement et qualitativement les conséquences des IN en termes de handicap.
Ce projet devrait aussi s'étendre aux autres types de prothèses : valves cardiaques, pacemakers, etc.
Promouvoir la recherche en matière d'infections nosocomiales
Plusieurs thèmes nécessitent des recherches plus importantes :
a) La physiopathologie des infections du site opératoire, et leur prévention.
Paradoxalement, l'état des connaissances est encore insuffisant, et ce paradoxe en fait un thème urgent, puisque le grand public pense qu'il s'agit d'un sujet bien connu.
En particulier :
o par où les bactéries parviennent-elles dans la plaie opératoire ? (en per opératoire : par l'air, les mains, les instruments, ou en post opératoire : par voie sanguine, par voie lymphatique, ou via des lymphatiques colonisés sectionnés en per opératoire...) ; et quand sont-elles mises en suspension si l'air est le mécanisme essentiel ? Les facteurs organisationnels sont importants (anesthésie, allées et venues intempestives dans le bloc...), mais on ne connaît pas la fréquence respective des différentes causes ;
o quelle est la relation entre le portage de bactéries en pré opératoire (y compris dans le nez, ou sur la peau chez des sujets parfaitement sains) et l'infection post opératoire ? Les méthodes préventives éventuelles pourraient être une décolonisation du nez avec des pommades antibiotiques ou antiseptiques (à l'étude), ou une antibioprophylaxie intraveineuse, mais différente des patients non porteurs.
b) L'évitabilité des infections nosocomiales.
On sait que des programmes de grande ampleur peuvent réduire les taux (le taux habituellement évoqué de 30% d'évitabilité date de 25 ans !!), mais on ne sait pas déterminer au cas par cas quelle infection était évitable. Il est toujours possible d'identifier des faiblesses dans les protocoles, mais cela ne démontre en rien que cette faiblesse constatée était bien responsable de l'infection chez un patient donné.
Les travaux sur les estimations de morbidité et mortalité attribuables doivent se poursuivre pour déterminer sur quels facteurs il convient d'agir en priorité et quelles mesures de prévention seraient à renforcer : procédures d'isolement, dépistage des BMR, programmes d'amélioration de l'hygiène des mains, port de masques, nouvelles stratégies prophylactiques, préparation de l'opéré... Il s'agit d'augmenter le niveau de preuve de l'efficacité de ces mesures.
c) Comment modifier les comportements des soignants ?
Le soignant est-il différent du citoyen ? Pourquoi le serait-il ? Faut-il en fait commencer à l'école, et augmenter le niveau moyen de connaissances et de motivation de la population en matière d'hygiène et de santé publique, comme dans certains pays ? Ce thème nécessite de travailler avec des sociologues et ethnologues.
d) L'étude de la fréquence, les conditions de survenue, les conséquences des IN, les stratégies de prévention spécifiques dans les secteurs d'hébergement des personnes âgées .
Un regard particulier doit en effet être porté sur les structures de SSR et SLD qui, en étant éloignées parfois des structures de court séjour, sont aussi souvent éloignées des bonnes pratiques en matière d'hygiène. La grippe y pose un problème particulier.
e) Les séquelles des IN
f) Les risques liés à certains actes, qui ont fait à ce jour d'un nombre limité d'études et devraient faire l'objet de recommandations : extractions dentaires, endoscopies, coloscopies, échographies trans-oesophagiennes, etc.
Propositions d'évolution du dispositif juridique
Différentes options ont été évoquées dans le chapitre juridique, au regard des différents problèmes posés par le régime en vigueur et les inégalités de traitement selon les situations. Rappelons-en les conclusions.
Le dispositif actuel est complexe et source d'inégalités, mais il est certainement prématuré, peu de temps après la mise en oeuvre des dispositions liées à la loi du 4 mars 2002, de prétendre déjà à une modification de textes.
Mais des travaux doivent se poursuivre dans les domaines suivants :
o Information des patients et de leurs familles
o Approfondissement des connaissances sur les risques nosocomiaux dans l'activité de ville
o Clarification de la rétroactivité ou de l'absence de rétroactivité de la loi du 30 décembre 2002
o Incitation pour les organismes assurantiels à accentuer et renforcer la liaison primes-politique de prévention des risques d'infections nosocomiales
La diffusion publique des tableaux de bord par établissement
Cette diffusion, rassemblant quelques indicateurs relatifs aux IN, est une procédure engagée, nous l'avons vu.
Elle présente des avantages, si par ce biais, les établissements se voient incités à s'améliorer et à résorber leurs dysfonctionnements internes ; elle peut receler des inconvénients si les établissements, face à ce risque porté à leur réputation, manipulent les données transmises utilisées pour établir ces tableaux de bord.
De fait, cette diffusion publique de données de résultats de soins, et de taux d'IN en particulier, doit être engagée avec les plus extrêmes précautions. L'objectif d'information du public n'est pas toujours valablement poursuivi par ces procédures, mais à l'inverse, la qualité des données et le cercle vertueux recherché en faveur de l'amélioration de la qualité des soins risquent de se dégrader.
Au demeurant, la demande du public ne réside pas tant dans la publication de tels tableaux de bord, assez complexes à déchiffrer, que dans l'information délivrée au cours de l'hospitalisation dans le cas où une IN survient, comme nous venons de le souligner. L'enquête IPSOS a montré que le public était déjà mieux informé que ne le pensent les professionnels.
Par contre, il existe un intérêt évident à établir de tels tableaux de bord comparatifs et les diffuser aux établissements pour les inciter à s'améliorer ; ces tableaux de bord opérationnels seraient éventuellement plus précis et plus complets que les données destinées au grand public. Une diffusion large s'accommode mal de la complexité du sujet.
Il pourrait être ainsi conçu deux modèles de tableau de bord : un pour le grand public, donnant une information robuste et claire, un pour les établissements, plus détaillé, plus complet, plus opérationnel.
Ainsi, plus que des tableaux de bord nationaux, dont nous avons vu les limites, il s'agit de promouvoir (ce qui est prévu dans le programme) les tableaux de bord de suivi des IN au sein des établissements , indépendamment (et peut-être même à la place s'il y a conflit) des outils de comparaison nationaux. Il est en outre plus instructif, sur certains indicateurs où les comparaisons inter-établissements sont difficiles, d'étudier l'évolution dans le temps des taux au sein d'un établissement.
A noter que la HAS elle-même lance une réflexion sur cette question de la publication d'indicateurs de qualité. Etienne Caniard, prenant acte du bilan mitigé des expériences étrangères, indique : « Il nous paraît essentiel de ne pas se tromper, de ne pas nous lancer dans une série de publications qui répondraient davantage à la disponibilité actuelle de tel ou tel type d'indicateurs plutôt qu'à une stratégie d'amélioration de la qualité » .
Compte tenu des expériences américaines et dans cet esprit de délivrer des indicateurs utiles pour les établissements, pourraient être ajoutés au tableau de bord actuel :
o Indicateurs de procédures :
Antibioprophylaxie avant chirurgie
Vaccination antigrippale du personnel (notamment dans les structures de SSR et les EHPAD)
o Indicateurs de résultats :
Bactériémie primaire confirmée biologiquement associée à une voie centrale (stratification par type d'unité)
Par contre, deux indicateurs prévus dans l'actuel tableau de bord ne paraissent pas adaptés en l'état à une diffusion grand public, dans une optique de comparaison inter-établissements : le taux d'infection du site opératoire par acte, en raison des faibles nombres de cas et de l'absence de redressement selon la sévérité ; et la consommation d'antibiotiques, en raison de sa moindre pertinence comme indicateur de qualité ; cet indicateur devrait évoluer vers un indicateur composite de bon usage.
Proposition de mise en place d'une structure hospitalière transversale dédiée à la sécurité des patients et la gestion de tous les risques
L'infection nosocomiale a été mise sous les feux de l'actualité depuis une dizaine d'années. La France dispose actuellement d'un système de prévention et de surveillance de l'IN très performant. On sait, depuis certaines études récentes (enquête de prévalence sur les événements indésirables (ENEIS de la DREES) que les infections nosocomiales ne représentent que 20% environ de ces événements indésirables ; une assez grosse partie de ces derniers recouvre des accidents liés aux médicaments ou aux actes diagnostiques et thérapeutiques. Les accidents dus aux anticoagulants sont en particulier très fréquents, et souvent sévères.
Les structures hospitalières actuelles sont mal organisées pour prendre en charge ces événements indésirables non infectieux et les programmes qualité donnent rarement une vision réellement transversale de la problématique.
La déclaration des événements indésirables, mise en place dans certains hôpitaux, sous-estime considérablement les accidents médicaux. Ceci est en partie lié à une réticence des médecins à déclarer les accidents médicaux, et à un « saucissonnage » des structures de vigilance avec un émiettement des horaires des professionnels impliqués (vigilants, gestionnaires de risque, qualiticiens...).
De plus, la lisibilité de certaines structures, telle les unités de gestion des risques, est faible, car les usagers, voire les professionnels, comprennent mal ce terme, et parce que les ressources accordées à ces spécialistes sont insuffisantes.
Par ailleurs, les stratégies de lutte contre l'infection nosocomiale nécessitent impérativement des connaissances cliniques et microbiologiques, et imposent un fort ancrage sur le terrain.
Il existe donc un vrai challenge pour mettre en place les structures permettant d'atteindre ces différents objectifs, en partie contradictoires.
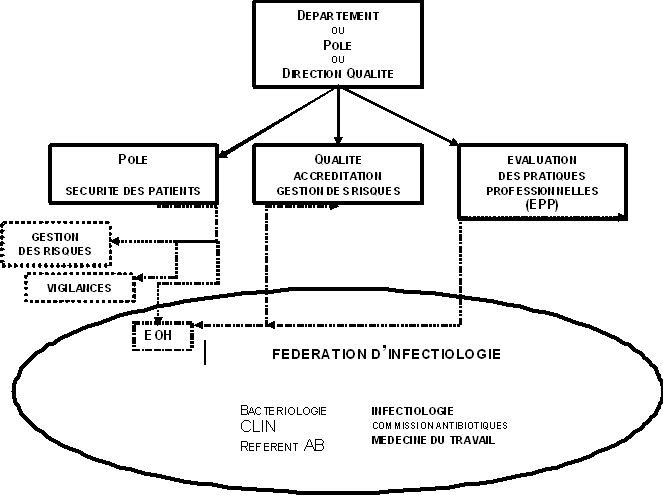
Il pourrait être proposé de créer dans les hôpitaux une structure responsable de la sécurité des patients. Cette structure ferait partie des « pôles », « départements », ou « directions » « qualité » en place (l'organisation est variable suivant les hôpitaux), et regrouperait les unités opérationnelles d'hygiène et les différentes vigilances, et bien entendu les responsables de la gestion des risques.
Les informations sur les événements indésirables devront être centralisées par cette unité, en particulier à partir de systèmes de déclarations volontaires, à développer, mais aussi à partir d'autres sources d'informations (EOH, revues de mortalité/morbidité, plaintes et lettres de patients...).
Un bilan annuel des événements indésirables serait réalisé, avec définition précise des cas à prendre en compte, en fonction de leur criticité (des recommandations nationales seraient souhaitables). Cette unité serait également responsable du signalement de certains événements aux organismes extérieurs (InVS, DDASS...), sur le mode des déclarations d'infections nosocomiales.
Ce bilan serait présenté aux structures hospitalières (conseil d'administration, CME, CHSCT...).
Il serait utile que ces structures puissent disposer d'un interne de santé publique dans les hôpitaux de taille suffisante.
L'unité opérationnelle d'hygiène doit faire partie par ailleurs, au plan fonctionnel, d'un ensemble regroupant les professionnels impliqués dans la prévention du risque infectieux (bactériologie, service d'infectiologie s'il existe, référent antibiotique, CLIN, Commission des antibiotiques, Médecine du Travail...).
Cette activité peut prendre différentes formes, dont celle d'une fédération dans les grands centres hospitaliers. Cette coopération et cet ancrage clinique sont indispensables au bon fonctionnement des EOH, et à la formation continue de ses membres.
|
Synthèse des recommandations o Renforcer les politiques de bon usage des antibiotiques : inscrire le bon usage des antibiotiques dans les programmes de formation médicale continue des médecins de ville et médecins hospitaliers, et en formation initiale donner un support réglementaire à la commission antibiotique et mettre en place des équipes opérationnelles sur l'antibiothérapie dans les établissements, sur le même mode que les EOH o o Renforcer l'application des recommandations en matière d'hygiène dans les établissements de santé et les mesures de prévention : développer les audits de pratiques, les revues de morbi-mortalité dans les établissements (en lien avec l'EPP) o o Mettre en place un statut d'infirmière hygiéniste o o Revaloriser la fonction et le rôle des médecins hygiénistes o o Mettre en place des unités de référence pour la prise en charge des infections ostéo-articulaires o o Constituer un registre des patients porteurs de prothèses orthopédiques o o Promouvoir la recherche en matière d'infections nosocomiales : physiopathologie des ISO et leur prévention, évitabilité des IN comportement des professionnels de santé IN dans les établissements d'hébergement des personnes âgées (EHPAD) séquelles des IN o o Faire évoluer le dispositif juridique : rendre rétroactive la loi de décembre 2002 inciter les organismes assurantiels à accentuer et renforcer la liaison primes-politique de prévention des risques d'infections nosocomiales o o Faire évoluer la politique de publication d'indicateurs de qualité : distinguer des tableaux de bord « grand public » et des tableaux de bord opérationnels pour les établissements dans le cadre de leur politique interne d'amélioration continue de la qualité travailler sur d'autres indicateurs, comme la vaccination anti-grippale du personnel (notamment dans les EHPAD) o o Mettre en place dans les établissements une structure hospitalière transversale dédiée à la sécurité des patients et la gestion de l'ensemble des risques |
Quelques repères bibliographiques
Adrie C, Chaix Couturier C, de Lassence A, Meshaka P, Thuong M, Garrouste-Orgeas M, Timsit JF. Epidemiology and economic evaluation of severe sepsis in France: age, severity, infection site, and place of acquisition (community, hospital, or intensive care unit) as determinants of workload and cost. Journal of critical care 2005, 20(1): 46-58
Aho LS, et al. Epidemiology of viral nosocomial infections in pediatrics, Pathol Biol. (Paris) 2000, 48(10) : 885-92
Bailly P, Haore, HG, Crenn D, Talon D, Mortalité hospitalière imputable aux infections nosocomiales : mise en place d'un observatoire dans un centre hospitalier universitaire, Méd Mal Inf, 2004
Bootsma MCJ. et al. Controlling methicillin-resistant Staphylococcus aureus : quantifying the effects of interventions and rapid diagnostic testing. Proceed. Nat. Acad. Sciences, 2006, édition avancée en ligne
Branger B, Durand C, Jarno P, Chaperon J, Delattre-Maillot I, Mortalité hospitalière imputable aux infections nosocomiales, Méd Mal Inf. 2002, 32 :98-106
Brücker Gilles, éditorial du Bulletin épidémiologique hebdomadaire, 2006, n°1, 1
Brun-Buisson C, Roudot-Thoraval F, Girou E, Grenier-Sennelier C, Durand-Zaleski I. The costs of septic syndromes in the intensive care unit and influence of hospital acquired sepsis. Intensive care med. 2003, 29(9), 1464-1471
Brun-Buisson et le groupe de travail SRLF/SFAR. Risques et maîtrise des infections nosocomiales en réanimation : texte d'orientation SRLF/SFAR. Hygiènes, 2006, vol XIV, n°2, pp. 91-99
CCECQA, ANAES. Les coûts de la qualité et de la non-qualité des soins dans les établissements de santé : états des lieux et propositions. ANAES, Juillet 2004
Céline, Semmelweis, thèse de médecine, suivi de « Les derniers jours de Semmelweis », 1924, L'imaginaire/Gallimard
Chaix C, Durand-Zaleski I, Alberti C, Brun Buisson C. Cost of Endemic Methicillin-Resistant Staphylococcus Aureus : A Cost Benefit Analysis in an Intensive Care Unit. JAMA 1999, 282(18), 1745-1751
Classen et al., N Eng J Med 1992, vol 326, 281-286
Coello R, Charlett A, Wilson J, Ward V, Pearson A, Borriello P. Adverse impact of surgical site infections in english hospitals, Journal of Hospital Infection, 2005, 60, 93-103
Dietrich ES, Demmler M, Schulgen G, Fekec K, Mast O, Pelz K, Daschner FD. Nosocomial pneumonia: a cost of illness analysis. Infection 2002, 30(2), 61-67
DiGiovine B, Chenoweth C, Watts C, Higgins M. The attributable mortality and costs of primary nosocomial bloodstream infections in the intensive care unit. American Journal Respir Crit Care Med 1999, 160, 976-981
Dominguez TE, Chalom R, Costarino Jr AT. The impact of adverse patient occurrences on hospital costs in the pediatric intensive care unit. Critical Care Medicine 2001, 29(1), 169-174
Elward AM, Hollenbeak CS, Warren DK, Fraser VJ. Attributable cost of nosocomial primary bloodstream infection in pediatric intensive care unit patients. Pediatrics 2005, 115(4), 868-872
Fabbro-Peray P et al. Estimation de la mortalité attribuable aux IN, enquête exposé-non-exposé au sein de la cohorte des patients hospitalisés au CHU de Nîmes, octobre 2004
Fermon B, Levy P. La diffusion publique de données relatives à l'activité, la performance, les résultats des établissements de santé, Etude bibliographique réalisée pour la HAS, novembre 2005
Hollenbeack CS, Murphy D, Dunnagan WC, Fraser VJ. Nonrandom selection and the attributable cost of surgical-site infections. Infection control and hospital epidemiology 2002, 23(4), 177-182
Kaoutar B et al. Nosocomial infections and hospital mortality : a multicentre epidemiology study. J Hosp Infect, 2004 ; 58 (4), 268-75
Lauria FN, Angeletti C. The impact of nosocomial infections on hospital care costs. Infection 2003; 31(Suppl2):35-43
Ledoux M. Hygiène au bloc opératoire : Evaluation d'un protocole de comportement en chirurgie orthopédique et traumatologique, Mémoire de DES de pharmacie hospitalière, Strasbourg, 1999
Lopman BA, Reacher MH, Vipond IB, Hill D, Perry C, Halladay T, Brown DW, Edmunds WJ, Sarangi J. Epidemiology and cost of nosocomial gastroenteritis Avon, England, 2002-2003. Emerging Infectious Diseases 2004, 10(10), 1827-1834
Maugein J. et al, Observatoires régionaux du pneumocoque : surveillance des sérotypes et de la résistance aux antibiotiques des souches de S. pneumoniae en France, 2003. Bulletin épidémiologique hebdomadaire n°1, 2006, 6-8
McGarry SA, Engemann JJ, Schmader K, Sexton SJ, Kaye KS. Surgical-site infection due to staphylococcus aureus among elderly patients : mortality, duration of hospitalization, and cost. Infection control and hospital epidemiology, 2004, 25 (6), 461-467
Orsi GB, Di Stefano L, Noah N. Hospital-acquired, laboratory-confirmed bloodstream infection: increased hospital stay and direct costs. Infection control and hospital epidemiology 2002, 23(4), 190-197
Payne NR, Carpenter JH, badger GJ, Horbar JD, Rogowski J. Marginal increase in cost and excess length of stay associated with nosocomial bloodstream infections in surviving very low birth weight infants. Pediatrics 2004, 114(2), 348-355
Piednoir E, Bessaci K, Bureau-Chalot F, Sabouraud P, Brodard V, Andréoletti L, Bajolet O. economic impact of healthcare associated rotavirus infection in a pediatric hospital. The journal of hospital infection 2003, 55(3), 190-195
Pirson M, Dramaix M, Struelens M, Riley TV, Leclercq P. Costs associated with hospital-acquired bacteraemia in a Belgian hospital. The Journal of Hospital Infection 2005, 59(1): 33-40
Plowman R, Graves N, Griffin MAS, Roberts JA, Swan AV, Cookson B, Taylor L. The rate and cost of hospital-acquired infections occurring in patients admitted to selected specialties of a district general hospital in England and the national burden imposed. The Journal of Hospital infection 2001, 47(3), 198-209
Raymond DP et al. Impact of rotating empiric antibiotic schedule on infectious mortality in a intensive care unit. Crit Care Med, 2001, vol 29, 1101-1108
Roberts RR, Scott RD, Cordell R, Solomon SL, Steele L, Kampe LM, Trick WE, Weinstein RA. The use of economic modelling to determine the hospital costs associated with nosocomial infections. Clin Infect Dis 2003, 36, 1424-1432
Saint S, Veenstra DL, Lipsky BA. The clinical and economics consequences of nosocomial central venous catheter-related infection: are antimicrobial catheters useful ? Infection control and hospital epidemiology 2000, 21(6), 375-380
Slonim AD, Kurtines HC, Sprague BM, Singh N. The costs associated with nosocomial bloodstream infections in the pediatric intensive care unit. Pediatric Crit Care Med. 2001; 2: 170-174
Tambyah PA, Knasinski V, Maki DG. The direct costs of nosocomial catheter-associated urinary tract infection in the era of managed care. Infection control and hospital epidemiology 2002, 23(1), 27-31
Tirésias, volume III, Prévention des infections en chirurgie orthopédique
Trystram D et al. Réseau européen de surveillance de la résistance bactérienne aux antibiotiques (EARSS) : résultats 2002, place de la France, BEH, n°32-33/2004, 141-164
Vincent JL et al., JAMA, 1995, vol 274, 639-644
Vincent JL, Nosocomial infections in adult intensive-care units, Lancet, 2003, 361, 2068-2077
Whitehouse JD, Friedman ND, Kirkland KB, Richardson WJ, Sexton DJ. The impact of surgical-site infections following orthopedic surgery at a community hospital and a university hospital : adverse quality of life, excess length of stay, and extra cost. Infection control and hospital epidemiology, 2002, 23 (4), 183-189
Wilcox MH, Health-care-associated infection : morbidity, mortality and costs, Hospital Medecine, 2004, vol 65, 88-91
Rapports consultés (publications sur les sites internet correspondants)
o Programme national de lutte contre les infections nosocomiales 2005-2008, Ministère de la Santé
o Réseau BMR-Raisin, surveillance des bactéries multirésistantes dans les établissements de santé en France, résultats 2002 ; Vincent Jarlier (coordonnateur national BMR-Raisin), 31 p.
o EARSS, European Microbial Resistance Surveillance System, rapports 2001, 2002, 2003, 2004.
o Rapport de la communauté européenne : on the basis of member states' reports on the implementation of the council recommendation (2002/77/EC) on the prudent use of antimicrobial agents in human medecine, le 22/12/05.
o Surveillances des IN en réanimation (RAISIN), 2004
o Surveillances des ISO (RAISIN), 2004
o Rapport statistique ICU Helics (hospital in Europe Link for Infection Control through Surveillance) 2005
o Rapport statistique SSI Helics, 2005
o Conférence de consensus. Organisée par la Société Française d'Hygiène Hospitalière. Gestion pré-opératoire du risque infectieux. Conférence 5 mars 2004
o Plan National d'action pour préserver l'efficacité des antibiotiques 2001 - 2005, Ministère de la Santé
o Accord - cadre national relatif au bon usage des antibiotiques dans les établissements de santé
Abréviations
ANAES : Agence nationale d'accréditation et d'évaluation en santé
ARH : Agence régionale d'hospitalisation
BMR : Bactérie multi-résistante
BPCO : Broncho-pneumopathie chronique obstructive
CCLIN : Centre de coordination de la lutte contre les infections nosocomiales
CDC : Center for Disease Control and Prevention
CH : Centre hospitalier
CHSCT : Comité d'hygiène, de sécurité et des conditions de travail
CHU : Centre hospitalier universitaire
CLIN : Comité de lutte contre les infections nosocomiales
CME : Commission médicale d'établissement
CNAM : Commission nationale des accidents médicaux
CNAMTS : Caisse Nationale d'assurance-maladie des travailleurs salariés
COMPAQH (projet) : Coordination pour la mesure de la performance et l'amélioration de la qualité hospitalière
CRCI : Commissions régionales de conciliation et d'indemnisation des accidents médicaux, des affections iatrogènes et des infections nosocomiales
CRU : Commission de relation avec l'usager
CSHPF : Conseil supérieur d'hygiène publique de France
CTIN : Comité technique national des infections nosocomiales
CTINILS : Comité technique national des infections nosocomiales et des infections liées aux soins
CVC : Cathéter veineux central
DDASS : Direction départementale des affaires sanitaires et sociales
DRASS : Direction régionale des affaires sanitaires et sociales
DGS : Direction générale de la santé
DHOS : Direction de l'hospitalisation et de l'organisation des soins
DREES : Direction de la recherche, des études, de l'évaluation et des statistiques
EARSS : Réseau européen de surveillance de la résistance bactérienne aux antibiotiques
EBLSE : Entérobactéries productrices de ?-lactamases à spectre étendu
ECBU : Examen cytobactériologique des urines
EHPAD : Etablissement d'hébergement des personnes âgées dépendantes
EIG : Evénements indésirables graves liés aux soins
ENEIS : Etude nationale sur les événements indésirables liés aux soins
ENP : Enquête nationale de prévalence
EOH : Equipe opérationnelle d'hygiène
EOHH : Equipe opérationnelle d'hygiène hospitalière
EPP : Evaluation des pratiques professionnelles
ETP : Equivalent temps plein
HAD : Hospitalisation à domicile
HAS : Haute autorité de santé
HELICS : Hospital In Europe Link for Infection Control through Surveillance
IAS : Infection associée aux soins
ICALIN : Indice composite d'évaluation des activités de lutte contre les infections nosocomiales
IBODE : Infirmière de bloc opératoire diplômée d'état
IDE : Infirmière diplômée d'état
IDMIN : Mission nationale d'information et de développement de la médiation sur les infections nosocomiales
IGAS : Inspection générale des affaires sociales
ILS : Infection liée aux soins
IN : Infection nosocomiale
INSERM : Institut national de la santé et de la recherche médicale
INVS : Institut national de veille sanitaire
IPP : Incapacité permanente partielle
IPSE : Improving Patient Safety in Europe
ITT : Incapacité temporaire totale
ISO : Infection du site opératoire
IU : Infection urinaire
LIEN : Association de patients créée par Béatrice et Alain-Michel Ceretti suite à l'affaire de la clinique du Sport
MCO : Disciplines de court séjour Médecine-Chirurgie-Obstétrique
NNIS : National nosocomial infection survey
ONIAM : Office national d'indemnisation des accidents médicaux, des affections iatrogènes et des infections nosocomiales
PSPH : Participant au service public hospitalier
RAISIN : Réseau d'alerte, d'investigations et de surveillance des infections nosocomiales
SARM : Staphylococcus aureus résistant à la méticilline
SFAR : Société française d'anesthésie et de réanimation
SHA : Solution hydro-alcoolique
SLD : Soins de longue durée
SOFCOT : Société française de chirurgie orthopédique
SSR : Soins de suite et de réadaptation
TIRESIAS : Groupe d'experts issus de 4 sociétés savantes (SFAR, SOFCOT, Société de pathologie infectieuse de langue française, Société française de microbiologie)
UHLIN : Unité hospitalière de lutte contre les infections nosocomiales
USI : Unité de soins intensifs
USLD : Unité de soins de longue durée
VIH : Virus de l'immunodéficience humaine
VRS : Virus respiratoire syncitial
|
|
CNEH 3 RUE DANTON 92240 MALAKOFF DÉPARTEMENT 01 41 17 15 36 |
SENAT
OFFICE PARLEMENTAIRE D'EVALUATION
DES POLITIQUES DE SANTE
|
LA POLITIQUE DE LUTTE CONTRE LES INFECTIONS NOSOCOMIALES |
* 23 Source PMSI, bases publiques et privées 2004, sur les 3 GHM suivants : 08C02Z, 08C03V, 08C03W








