Rapport de l'OPEPS n° 421 (2005-2006) de M. Alain VASSELLE , fait au nom de l'Office parlementaire d'évaluation des politiques de santé, déposé le 22 juin 2006
Disponible au format Acrobat (7,4 Moctets)
-
I. TRAVAUX DE L'OFFICE PARLEMENTAIRE
D'ÉVALUATION DES POLITIQUES DE SANTÉ (OPEPS)
-
AVANT-PROPOS
-
A. LES INFECTIONS NOSOCOMIALES : LES
CONSÉQUENCES DRAMATIQUES D'UNE INSUFFISANTE QUALITÉ DES
SOINS
-
B. LA POLITIQUE DE LUTTE CONTRE LES INFECTIONS
NOSOCOMIALES : UN EFFORT À POURSUIVRE
-
C- RÉUNIONS DE L'OFFICE
-
AVANT-PROPOS
-
II. ETUDE
-
A. INTRODUCTION
-
B. METHODOLOGIE
-
o o C. EPIDEMIOLOGIE DES INFECTIONS
NOSOCOMIALES
-
D. LES COÛTS INDUITS PAR LES INFECTIONS
NOSOCOMIALES
-
E. L'ORGANISATION DE LA LUTTE CONTRE LES INFECTIONS
NOSOCOMIALES
-
F. QUELLES DONNÉES, QUELS TAUX FAUT-IL
RENDRE PUBLICS ?
-
G. ETUDE JURIDIQUE
-
H. ENQUETE IPSOS : SYNTHÈSE DES
RÉSULTATS
-
I. SYNTHÈSE DE LA PROBLEMATIQUE
-
J. RECOMMANDATIONS
-
A. INTRODUCTION
-
III. ANNEXES AU RAPPORT
|
N° 3188 ASSEMBLÉE NATIONALE CONSTITUTION DU 4 OCTOBRE 1958 DOUZIÈME LÉGISLATURE |
N° 421 SÉNAT SESSION ORDINAIRE DE 2005-2006 |
|
|
Enregistré à la Présidence de l'Assemblée nationale |
Annexe au procès-verbal de la séance du |
|
|
le 22 juin 2006 |
22 juin 2006 |
OFFICE PARLEMENTAIRE D'ÉVALUATION
DES POLITIQUES DE SANTÉ
RAPPORT
sur
la politique de lutte contre les infections nosocomiales,
par
M. Alain VASSELLE, Sénateur
|
Déposé sur le Bureau de l'Assemblée nationale par M. Jean-Michel DUBERNARD Premier Vice-Président de l'Office |
Déposé sur le Bureau du Sénat par M. Nicolas ABOUT Président de l'Office |
||||
Cet office est composé de : MM. Nicolas About, président, Gilbert Barbier, Paul Blanc, Bernard Cazeau, Gérard Dériot, Jean-Claude Etienne, Guy Fischer, Jean-Pierre Godefroy, Dominique Leclerc, Alain Milon, Jean-François Picheral, Alain Vasselle, sénateurs.
MM. Jean-Michel Dubernard, premier vice-président, Gérard Bapt, Jean Bardet, Marc Bernier, Mme Maryvonne Briot, MM. Paul-Henri Cugnenc, Claude Evin, Mmes Jacqueline Fraysse, Cécile Gallez, MM. Jean-Marie Le Guen, Jean-Luc Préel, Jean-Marie Rolland, députés.
|
Santé publique. |
I. TRAVAUX DE L'OFFICE PARLEMENTAIRE D'ÉVALUATION DES POLITIQUES DE SANTÉ (OPEPS)
AVANT-PROPOS
Mesdames, Messieurs,
L'Office parlementaire d'évaluation des politiques de santé (Opeps) a été créé par la loi de financement de la sécurité sociale pour 2003. Cette instance de réflexion commune aux deux assemblées a pour mission d'éclairer les décisions du Parlement en matière de santé publique et de contribuer au suivi des lois de financement de la sécurité sociale. Dans ce double objectif, il établit chaque année deux rapports thématiques, confiés respectivement à l'Assemblée nationale et au Sénat.
Pour l'année 2005-2006, l'office a choisi de consacrer ses travaux au bon usage des psychotropes, étude confiée à Maryvonne Briot, députée, 1 ( * ) pour l'Assemblée nationale, et la politique de lutte contre les infections nosocomiales. C'est à Alain Vasselle, sénateur, qu'est revenue la conduite de cette seconde étude au nom du Sénat, dans la continuité du rapport précédemment établi sur l'hôpital 2 ( * ) .
Au cours de sa réunion du 2 novembre 2005, l'Opeps a confié le travail préparatoire d'investigation préalable à l'adoption du présent rapport au centre national d'expertise hospitalière (CNEH) avec la consigne de dresser un panorama de la qualité des soins dans les hôpitaux français à partir des données disponibles sur les infections nosocomiales, des outils de lutte mis en place et par comparaison avec les exemples étrangers, notamment européens. Ce travail de synthèse a été complété par une étude des conséquences sanitaires, économiques et judiciaires des infections nosocomiales et par une analyse, déléguée à l'Ipsos, de la perception de la qualité des soins à l'hôpital par la population et par les professionnels de santé.
L'équipe pluridisciplinaire rassemblée par le CNEH pour mener cette étude a parfaitement répondu aux préoccupations de l'office. Le rapport remis et présenté le 15 juin 2006 est pertinent et riche d'enseignements. Il ouvre de nombreuses pistes de réflexion pour améliorer l'efficacité de la politique de lutte contre les infections nosocomiales.
Il conviendra d'en tenir compte à l'occasion des prochains rendez-vous législatifs, pour proposer des mesures permettant de diminuer le taux de prévalence de ces infections, de mieux en connaître les causes et d'améliorer la prise en charge des patients concernés.
A. LES INFECTIONS NOSOCOMIALES : LES CONSÉQUENCES DRAMATIQUES D'UNE INSUFFISANTE QUALITÉ DES SOINS
Les origines des infections nosocomiales sont aussi variées que le sont leurs manifestations sanitaires. Les conséquences sont à la fois dommageables, et parfois dramatiques, du point de vue de l'état sanitaire du patient, et financièrement sensibles du point de vue du coût pour la société.
1. Un phénomène polymorphe aux causes multiples
a) La réalité des infections nosocomiales en France
On admet communément que, en France, 6 % à 7 % des hospitalisations sont compliquées par une infection nosocomiale plus ou moins grave, soit environ 750.000 cas sur les 15 millions d'hospitalisations annuelles.
Les études épidémiologiques comparatives placent la France dans la moyenne européenne , estimée entre 6 et 9 %, pour les infections nosocomiales acquises en unité de soins intensifs et après intervention chirurgicale.
Ces infections peuvent avoir différentes origines :
- une bactérie endogène du patient : celui-ci s'infecte alors par ses propres micro-organismes à la faveur d'un acte invasif et/ou en raison d'une fragilité particulière. Ce sont, de loin, les infections les plus fréquentes. Elles sont imprévisibles et souvent graves lorsqu'elles surviennent sur le site opératoire ;
- une bactérie exogène présente dans l'établissement de santé, chez le personnel soignant ou un autre patient : on parle alors d'infections croisées ;
- un virus : les infections sont, dans ce cas, le plus souvent bénignes et surviennent hors de tout acte médical. Elles sont notamment observées dans les services de pédiatrie, où elles représentent près du quart des infections nosocomiales constatées.
La plus grande partie des infections nosocomiales se traduisent par des infections urinaires (40 % des cas), puis des infections de la peau et des tissus mous (11 %, notamment dans les services de long séjour et en psychiatrie), des pneumopathies (10 %, le plus souvent en réanimation) et des infections respiratoires hautes (9 %). Par ailleurs, les infections du site opératoire représentent 10 % des infections nosocomiales et sont observées à la suite d'une opération dans 1,5 % des cas ; elles peuvent porter sur la cicatrice ou sur l'organe opéré. Enfin, les bactériémies (présence d'une bactérie dans le sang) surviennent dans 4 % des cas.
Ces éléments chiffrés ne doivent toutefois pas conduire à surestimer la place des infections nosocomiales dans l'ensemble des accidents médicaux : elles ne constituent que de 22 % des événements graves liés aux soins, contre 37,5 % pour les autres suites d'une intervention chirurgicale et 27,5 % pour les accidents médicamenteux.
b) Pourquoi les infections nosocomiales ?
Des causes identifiées
La survenance d'une infection nosocomiale est souvent liée à la pratique de soins invasifs . Ainsi, les infections urinaires sont treize fois plus fréquentes chez les patients sondés et deux fois plus fréquentes chez ceux qui ont un cathéter. Une intubation/trachéotomie renforce également sensiblement le risque de pneumopathie.
Par ailleurs, les gestes chirurgicaux les plus invasifs sont les plus fréquemment à l'origine d'une infection ; c'est notamment le cas des actes de chirurgie orthopédique qui conduisent à la pose d'une prothèse.
Enfin, le risque d'infection peut être lié au traitement lui-même lorsqu'il nécessite une transfusion, une nutrition parentérale, une ventilation artificielle ou la prise de certains médicaments, notamment d'immunosuppresseurs.
En outre, la présence d'une immunodépression, un mauvais état général du patient (malnutrition, alcoolisme, tabagisme, maladie chronique pulmonaire), un âge avancé (l'âge moyen des patients infectés est de soixante-deux ans 3 ( * ) ) ou une pathologie menaçant le pronostic vital constituent des facteurs de risques majeurs.
Des facteurs aggravants
La gravité des infections peut , par ailleurs, être exacerbée par l'utilisation d'antibiotiques qui sélectionnent des bactéries résistantes aux traitements. Or, la France détient, en Europe, le record du taux de résistance aux antibiotiques, soit 50 % pour la pénicilline et 28 % pour la méticilline utilisées respectivement contre le pneumocoque et le staphylocoque doré, qui constituent les principales bactéries à l'origine des infections nosocomiales.
L'enquête Raisin précitée indique que 48 % des patients victimes d'une infection étaient soumis à un traitement antibiotique, 10 % étaient des patients traumatologiques, en particulier des grands brûlés, et 13 % immunodéprimés. Près de 80 % d'entre eux étaient, en outre, porteurs d'une sonde à demeure et plus de la moitié avait subi une intubation/trachéotomie.
Au total, compte tenu des origines multiples des infections nosocomiales, on estime à 70 % la proportion de celles qui ne pourraient pas être évitées par une meilleure prévention (mesures d'hygiène, locaux adaptés, etc.), notamment en raison de leur origine endogène.
2. Des conséquences lourdes pour le patient comme pour la société
a) Des conséquences sanitaires parfois tragiques
Si la mesure précise du nombre de décès directement dus à une infection nosocomiale reste un exercice délicat - les patients entrent en effet souvent à l'hôpital avec une pathologie grave et dans un état de fragilité générale - plusieurs études récentes estiment que 6,6 % des décès qui interviennent chaque année à l'hôpital ou à la suite d'une hospitalisation surviendraient en présence d'une infection de ce type. 4 ( * )
Au total, les infections nosocomiales seraient donc en cause pour 9.000 décès par an, dont 4.200 concernent des patients pour lesquels le pronostic vital n'était pas engagé à court terme à leur entrée à l'hôpital. Pour la moitié de ces 4.200 décès, aucune autre cause de décès n'est détectée. L'apparition d'une infection multiplie ainsi le risque de décès par trois.
Les infections nosocomiales les plus fréquemment responsables d'une issue fatale sont les pneumopathies, les bactériémies (mortelles dans 20 % à 30 % des cas), les chocs septiques, les infections digestives et les infections du site opératoire. Ainsi, les maladies infectieuses, dont les deux tiers sont le fait d'une infection nosocomiale, représentent la troisième pathologie responsable de décès après les maladies cardiovasculaires et le cancer.
Outre les décès, les infections nosocomiales sont la cause de séquelles souvent considérables à moyen et long termes, notamment au niveau fonctionnel.
Les séquelles observées dépendent largement de la zone anatomique touchée par l'infection . Les infections abdominales, ostéo-articulaires, en particulier sur les prothèses, ou encore les infections suivant un acte de neurochirurgie sont susceptibles d'entraîner les conséquences sanitaires les plus graves (changement de prothèse, amputation, etc.). De fait, une infection en chirurgie orthopédique double les risques, pour le patient, d'être hospitalisé une seconde fois.
Il est toutefois regrettable que, à la différence des décès dus aux infections nosocomiales, aucune étude n'ait encore été menée à grande échelle sur les séquelles qu'elles entraînent et sur les conséquences de ces séquelles en termes sanitaires et économique (prise en charge du handicap, arrêt de travail, indemnisation par la collectivité, etc.).
b) Un coût économique certain
Les infections nosocomiales entraînent un surcoût financier important, essentiellement dû à un allongement de la durée d'hospitalisation (quatre jours en moyenne), au traitement anti-infectieux et aux examens de laboratoire nécessaires au diagnostic et à la surveillance de l'infection. On estime ainsi que la survenance d'une infection allonge le séjour en chirurgie orthopédique de près de deux semaines et augmente les coûts de prise en charge du patient de 300 %.
Les différentes études disponibles font état d'une échelle de coûts très large , allant de 340 euros en moyenne pour une infection urinaire à 40.000 euros pour une bactériémie sévère en réanimation. Les estimations varient donc sensiblement en fonction du site anatomique de l'infection, de la nature du germe, de la pathologie prise en charge mais aussi du service d'hospitalisation.
En appliquant une fourchette de surcoût moyen de 3.500 à 8.000 euros par infection aux 750.000 infections nosocomiales annuelles, on atteint un montant de dépenses de 2,4 à 6 milliards d'euros . Ainsi, une diminution de 10 % du nombre d'infections conduirait à une économie de 240 à 600 millions d'euros, soit jusqu'à six fois plus que l'effort de prévention consenti par les établissements hospitaliers, qui s'établit à une centaine de millions d'euros. Ce rapide calcul montre combien le coût de la non-qualité est supérieur à celui de la prévention .
c) Des demandes de réparation plus fréquentes
Un régime de responsabilité spécifique
Le calcul du coût des infections nosocomiales doit également, et de plus en plus, prendre en compte celui de l'indemnisation du dommage. Depuis la loi du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé, les victimes d'infections nosocomiales postérieures au 5 septembre 2001 bénéficient, en effet, d'un régime d'indemnisation plus favorable que celui applicable à la réparation des autres accidents médicaux.
Ainsi, la responsabilité de l'établissement de santé est automatique , sauf à ce qu'il prouve lui-même que l'infection est due à une cause étrangère (patient ou tiers porteur d'un germe infectieux par exemple) et il revient à l'assureur de l'établissement de prendre en charge la réparation.
Toutefois, face à la menace des assureurs d'une augmentation importante de leurs tarifs, la loi du 30 décembre 2002 relative à la responsabilité civile médicale a complété ce dispositif et confié à la solidarité nationale , via l'office national d'indemnisation des accidents médicaux (Oniam), la prise en charge de l'ensemble des infections, que l'établissement en soit ou non responsable, qui ont entraîné le décès du patient ou un taux d'incapacité permanente partielle (IPP) au moins égal à 25 %. L'Oniam peut cependant se retourner ensuite contre l'assureur de l'établissement, s'il estime que la faute est manifeste.
En cas d'infection grave ouvrant droit à réparation au titre de la solidarité nationale, il est également possible, pour la victime, de demander un règlement à l'amiable du préjudice auprès d'une commission régionale de conciliation et d'indemnisation (CRCI).
Un système d'indemnisation favorable bien qu'encore perfectible
Ce système pose toutefois deux difficultés :
- il n'est pas applicable aux infections acquises en médecine de ville, pour lesquelles il revient au patient d'apporter la preuve de la faute du professionnel de santé ;
- les infections graves survenues entre le 5 septembre 2001 et le 1 er janvier 2003 relèvent d'un régime juridique incertain. L'interrogation demeure en effet sur leur prise en charge, par les assureurs ou par la solidarité nationale, en l' absence de rétroactivité claire de la loi du 30 décembre 2002 et du fait de la jurisprudence contradictoire sur ce point.
Il n'en demeure pas moins, malgré ces deux lacunes, que l'indemnisation des victimes d'infections nosocomiales a fait l'objet d'une attention particulière des pouvoirs publics. Le nombre croissant de dossiers indemnisés par l'Oniam - dix-neuf en 2004, quarante-huit en 2005 - en témoigne, même s'il ne représente encore qu'une part très faible du nombre de décès enregistrés. Il s'agit essentiellement de contentieux liés à un acte chirurgical, notamment en chirurgie orthopédique.
Pour la part des réparations revenant aux assureurs, l'augmentation du nombre de victimes prises en charge est également réelle puisque les déclarations de dommages ont triplé entre 2002 et 2004. Les infections nosocomiales représentent désormais environ 17 % du coût des sinistres . Cette augmentation des coûts a conduit les assureurs à réformer leur politique de prime : plus élevées, elles sont aussi désormais souvent corrélées à l'effort entrepris par l'établissement de santé en matière de prévention.
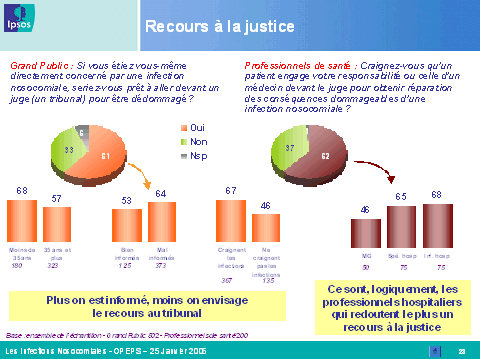
L'amélioration progressive de l'indemnisation des victimes d'infections nosocomiales et l'obligation d'informer le patient sur les causes et les circonstances du dommage ont permis de faire connaître au grand public le système de réparation mis en place en 2002. Ainsi, l'enquête menée par l'Ipsos à la demande de l'Opeps sur la perception des infections nosocomiales auprès des professionnels de santé et de la population dans son ensemble indique que plus de 60 % des personnes interrogées seraient aujourd'hui prêtes à réclamer la réparation du préjudice subi si elles étaient confrontées à cette situation .
B. LA POLITIQUE DE LUTTE CONTRE LES INFECTIONS NOSOCOMIALES : UN EFFORT À POURSUIVRE
Dès 1988, les pouvoirs publics ont pris conscience des risques sanitaires liés aux infections contractées dans les établissements de santé et ont mis en place les premières structures de prévention. Près de vingt ans plus tard, la politique de lutte contre les infections nosocomiales affiche des résultats encourageants même si des améliorations sont encore attendues dans de nombreux domaines.
1. Les premiers succès de la politique de prévention
a) Un maillage des établissements de santé
Si les circulaires de 1973 et de 1975 avaient commencé à sensibiliser les établissements de santé à la gestion du risque infectieux, la politique de lutte contre les infections nosocomiales a été véritablement lancée avec le décret du 6 mai 1988 rendant obligatoires les comités de lutte contre les infections nosocomiales (Clin) dans tous les établissements de santé publics ou participant au service public. Les Clin ont pour mission d'organiser la surveillance des infections dans l'établissement, de former les personnels et de proposer toute recommandation utile à la prévention.
L'arrêté du 3 août 1992 a ensuite instauré le comité national de lutte contre les infections nosocomiales (CTIN) et les cinq centres de coordination de lutte contre les infections nosocomiales (Cclin) chargés de la coordination des actions menées par les établissements qui ressortent de leur inter-région, du recueil épidémiologique de prévalence, de la réalisation d'études épidémiologiques et de la veille bibliographique et réglementaire.
Depuis 1995, plusieurs circulaires ont ensuite précisé les actions engagées et la loi du 1 er juillet 1998 relative au renforcement de la veille sanitaire et au contrôle de la sécurité sanitaire des produits destinés à l'homme a étendu le dispositif aux cliniques privées .
La surveillance épidémiologique a été améliorée dès 2001 par la mise en place du réseau d'alerte, d'investigation et de surveillance des infections nosocomiales (Raisin) , en lien avec l'institut de veille sanitaire (InVS).
Cette politique a produit des résultats non négligeables en termes de prévalence des infections nosocomiales parmi les patients hospitalisés. Ainsi, entre l'enquête de prévalence de 1996 et celle menée en 2001, ce taux a été ramené de 8,3 % à 7,2 % dans les centres hospitaliers universitaires et de 6,5 % à 5 % dans les centres hospitaliers. La prochaine enquête de prévalence est en cours ; il sera utile d'observer si cette tendance se confirme ou non.
Sur la période récente, les pouvoirs publics ont souhaité renforcer et moderniser le dispositif de prévention par :
- la mise en place d'un programme de lutte contre les infections pour la période 2005-2008 , qui a pour objectifs de renforcer les structures à l'échelon local (équipes d'hygiène), régional, interrégional (coopération entre établissements) et national ; d'améliorer la qualité de la prise en charge du patient infecté ; d'actualiser et assurer l'appropriation des recommandations par les professionnels de santé ; de développer l'évaluation des pratiques professionnelles ; de renforcer la surveillance épidémiologique des infections mais aussi de mieux informer les usagers sur le risque infectieux ;
- la publication progressive d'indicateurs de qualité pour chaque établissement de santé, dans un souci de transparence : un indicateur composite d'évaluation des activités de prévention a ainsi été rendu public par Xavier Bertrand, ministre de la santé et des solidarités, en février 2006. Il sera suivi, dans les prochains mois, par la publication de quatre indicateurs supplémentaires : le taux d'infections du site opératoire par type d'acte opératoire, le volume annuel de produits hydro-alcooliques utilisés pour l'hygiène des mains, le taux de staphylocoque doré résistant à la méticilline (SARM) et le suivi de la consommation d'antibiotiques ;
- l'amélioration de l'information du public grâce à la création de la mission nationale d'information et de développement de la médiation sur les infections nosocomiales (Idmin) au sein de la Haute Autorité de santé, qui dispose à cet effet d'un numéro vert et d'un site Internet.
Désormais, la lutte contre les infections nosocomiales ne s'envisage plus comme une politique sectorielle mais s'inscrit dans un système de santé publique qui prend en compte l'ensemble des risques sanitaires.
b) Une prise de conscience collective
Près de vingt ans après la mise en place des premières mesures de lutte contre les infections nosocomiales, l'Opeps a considéré qu'il serait utile de disposer d'indicateurs permettant de mesurer la perception du risque d'infections nosocomiales (survenance, causes, possibilité d'indemnisation, etc.) à la fois par les professionnels de santé et par le grand public. Une enquête a été confiée en ce sens à l'institut de sondages Ipsos, qui a interrogé un échantillon représentatif d'environ cinq cents personnes ainsi que deux cents professionnels de santé.
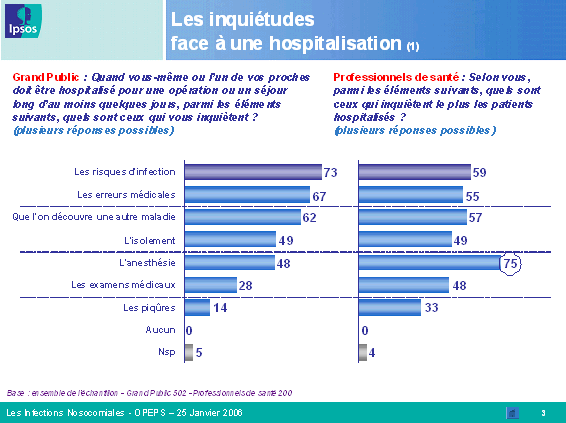
Il ressort de ce travail d'investigation que les risques d'infection constituent la source d'inquiétude première des Français dans le cadre d'une hospitalisation, avant les erreurs médicales. Cette crainte est, en revanche, sous-estimée par les professionnels de santé, qui considèrent que la peur de l'anesthésie serait leur premier facteur d'anxiété.
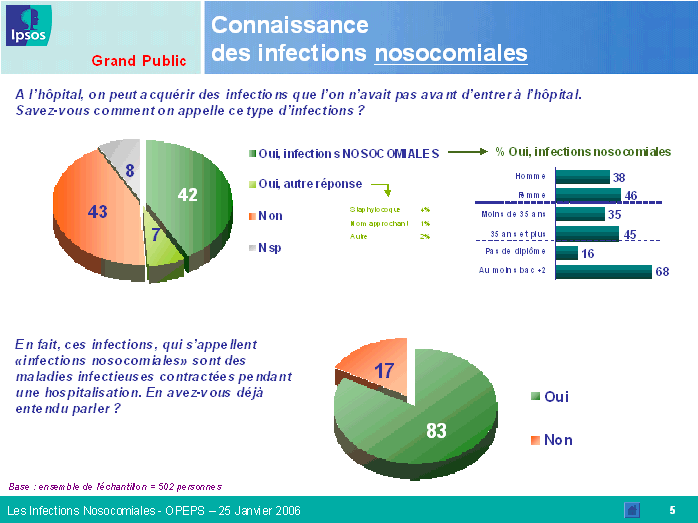
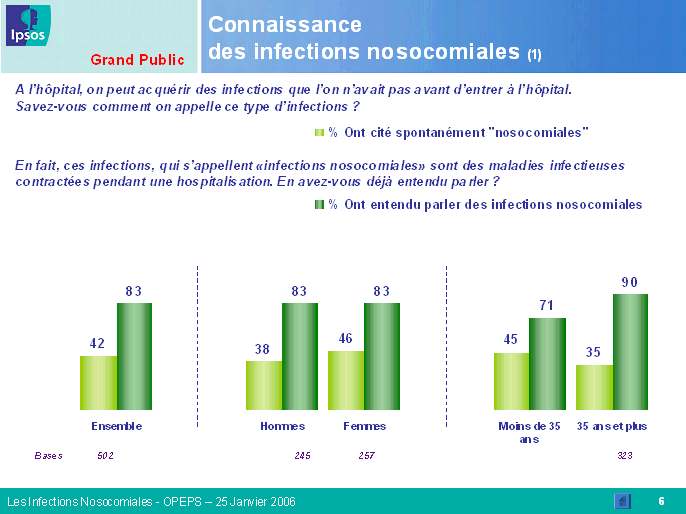
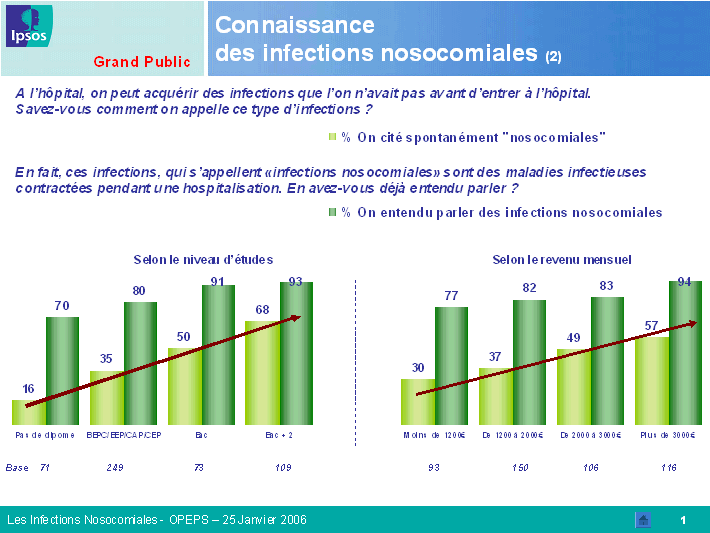
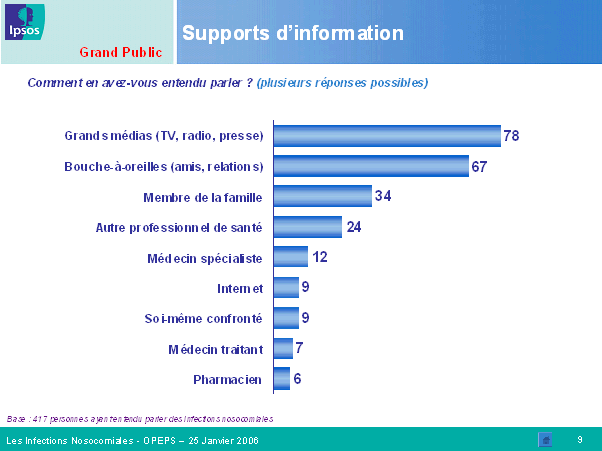
La connaissance de l'existence des infections nosocomiales est désormais bien répandue : 83 % des personnes interrogées en ont entendu parler ; cette proportion est en particulier élevée chez les personnes de plus de trente-cinq ans et issues d'un milieu socioprofessionnel favorisé. L'information provient le plus fréquemment de la presse, écrite ou orale, mais aussi du bouche-à-oreille. Là encore, les professionnels de santé sous-évaluent la réalité puisqu'ils considèrent que moins de la moitié de la population connaît l'existence de ce risque.
En revanche, le grand public ne s'estime pas correctement informé sur les causes et les conséquences des infections nosocomiales ; c'est notamment vrai dans les zones rurales et les foyers à faibles revenus. Tout aussi inquiétante est l'observation suivant laquelle seuls 50 % des professionnels interrogés admettent connaître le mécanisme de réparation issu de la loi du 4 mars 2002.
Les résultats de cette enquête sont instructifs sur deux points :
- le risque d'infection à l'hôpital est désormais connu par la grande majorité des Français, qui ont pris conscience des conséquences possibles d'une hospitalisation ;
- l'information est en revanche encore trop partielle, s'agissant des facteurs de risque et des conséquences sanitaires. De la même manière, les professionnels de santé doivent être sensibilisés au mécanisme d'indemnisation, notamment pour être en mesure d'informer correctement leurs patients de son existence.
En conséquence, l'effort en matière de lutte contre les infections nosocomiales devra, dans les années à venir, mettre l'accent sur l'information des professionnels de santé, comme de la population dans son ensemble.
2. Des améliorations souhaitables
Outre le renforcement de l'information, et à la lumière de l'étude menée par le CNEH, la politique de lutte contre les infections nosocomiales doit aujourd'hui, pour poursuivre la diminution de leur taux de prévalence dans les hôpitaux français, orienter son action dans trois directions.
a) Renforcer la prévention dans les établissements de santé
La première cause d'infection exogène au patient réside, on l'a vu, dans une hygiène imparfaite des locaux de l'établissement, des soins et/ou du personnel de santé. C'est pourquoi la politique de lutte contre les infections nosocomiales a, dès son implantation, mis l'accent sur l'amélioration et le respect des normes d'hygiène dans les établissements de santé. Si les progrès sont visibles, la situation, très variable qui plus est d'un établissement à l'autre, est encore loin de garantir une absolue qualité des soins.
La première recommandation concerne, en conséquence, la poursuite de la politique d'hygiène et de prévention. Pour ce faire, il convient d'accroître les efforts dans trois directions :
- une meilleure reconnaissance des métiers de l'hygiène dans les établissements de santé et ce, par deux moyens : la création d'un statut de l'infirmière hygiéniste afin de lui conférer une visibilité plus grande dans chaque service et l'harmonisation de la formation et de la répartition des médecins hygiénistes afin de rendre la filière plus attractive ;
- une application plus stricte des mesures de prévention par les professionnels de santé, comme la désinfection systématique des mains ou l'interdiction du port de bijoux, ainsi que, plus largement, le respect des bonnes pratiques pour ce qui concerne les soins, en particulier ceux liés à un dispositif invasif ;
- enfin, le développement des examens de dépistage de la présence de bactéries endogènes chez le patient - notamment des dépistages nasaux du SARM - avant une opération à risque.
Au-delà des mesures prises par les établissements de santé, la prévention des infections nosocomiales passe également par la promotion, dans l'ensemble du système de santé mais aussi auprès du grand public, des pratiques de bon usage des antibiotiques nécessaires à la limitation de l'évolution constatée des bactéries multirésistantes (prescription d'antibiotiques seulement lorsque la certitude d'un processus infectieux est acquise, utilisation des antibiotiques en rotation pour éviter l'accoutumance, campagnes d'information sur les risques de l'automédication, etc.).
b) Promouvoir la recherche et adapter le traitement des infections nosocomiales
Si le renforcement des mesures d'hygiène devrait permettre une diminution du taux de prévalence des infections nosocomiales, leur disparition totale est, de l'avis de l'ensemble des spécialistes, un objectif impossible à atteindre. La politique de lutte contre les infections nosocomiales doit, de ce fait, s'attacher également à la recherche des meilleurs traitements pour les patients qui en sont atteints.
Il s'agit notamment d'accélérer la mise en place des unités spécialisées dans la prise en charge des infections ostéo-articulaires prévues par le programme national de lutte contre les infections nosocomiales 2005-2008. L'objectif est d'éviter les complications graves liées à un traitement inadapté. Le développement de ces centres de référence nécessite la formation d'équipes de soignants spécialisées en infectiologie et en chirurgie, en nombre insuffisant aujourd'hui.
Par ailleurs, afin d'adapter au mieux les mesures de prévention et les traitements, il convient de développer la recherche sur l'origine des infections nosocomiales , en particulier sur les raisons pour lesquelles les bactéries exogènes parviennent dans la plaie opératoire et les relations entre la présence de bactéries endogènes avant l'opération et la survenance d'une infection postopératoire.
Enfin, les connaissances sont largement insuffisantes pour ce qui concerne les séquelles des infections et le suivi des patients susceptibles de développer une infection. A cet effet, il serait utile de constituer un registre des patients porteurs de prothèses orthopédiques , permettant aux professionnels de santé de les orienter rapidement, en cas d'alerte, vers un dispositif adapté.
c) Clarifier le dispositif juridique
S'il est encore trop tôt pour juger de l'efficacité du dispositif de réparation mis en place par les lois du 4 mars et du 30 décembre 2002, pour lequel l'augmentation régulière du nombre de dossiers traités par l'Oniam, encore très inférieur à celui des patients potentiellement concernés, constitue un encouragement, il convient de remédier rapidement à une difficulté clairement identifiée : celle de la rétroactivité ou non de la loi du 30 décembre 2002 .
A cet égard, il revient au Parlement se prononcer sans tarder sur le dispositif juridique qui doit être appliqué à l'indemnisation des infections survenues entre le 5 septembre 2001 et le 1 er janvier 2003, en le mettant en concordance avec le régime issu de la loi du 4 mars 2002 ou en affirmant la spécificité du système applicable sur cette période.
*
* *
Les infections nosocomiales constituent encore aujourd'hui, malgré la politique de lutte mise en place depuis près de vingt ans, un risque majeur pour le patient accueilli dans un établissement de santé.
Afin de poursuivre la diminution du taux de prévalence des infections nosocomiales, l'accent doit être mis, auprès des professionnels de santé, sur l'absolue nécessité de respecter les mesures de prévention pour assurer la qualité des soins.
Reconnaissant toutefois que certaines de ces infections ne sont pas évitables, la politique de santé publique doit également, dans ce domaine, orienter ses efforts sur la recherche des causes et sur les traitements adaptés aux pathologies infectieuses afin, en améliorant les connaissances sur ce phénomène, de mieux en maîtriser l'apparition et les conséquences.
C- RÉUNIONS DE L'OFFICE
1- Compte rendu de la réunion du jeudi 15 juin 2006
Réuni le jeudi 15 juin 2006 , sous la présidence de M. Nicolas About, président, l'Office parlementaire d'évaluation des politiques de santé (Opeps) a procédé à la présentation de l'étude consacrée à la politique de lutte contre les infections nosocomiales.
Rappelant que le Sénat a confié l'étude préparatoire de son rapport sur la politique de lutte contre les infections nosocomiales au centre national d'expertise hospitalière (CNEH), M. Alain Vasselle, sénateur, rapporteur , a précisé que, conformément au cahier des charges, elle devait comprendre un panorama de la qualité des soins dans les hôpitaux français à partir des données disponibles sur les infections nosocomiales, la présentation des outils de lutte mis en place et leur comparaison avec les exemples étrangers, notamment européens, l'étude des conséquences sanitaires, économiques et judiciaires des infections nosocomiales, et une analyse de la perception de la qualité des soins à l'hôpital par la population et les professionnels de santé, établie sous la forme d'un sondage d'opinion.
Des réunions ont été organisées à trois reprises avec l'équipe du CNEH au cours des huit mois de l'étude pour prendre acte de l'avancée des travaux. Elles ont été le lieu de débats fructueux sur les difficultés posées par les infections nosocomiales en matière de qualité des soins à l'hôpital et sur les moyens les plus efficaces pour limiter leur apparition.
Il a considéré que l'étude remise par le CNEH comprend une synthèse très complète du sujet retenu et plusieurs propositions concrètes et opportunes d'amélioration de la politique de lutte contre les infections nosocomiales, qu'il a souhaité voir reprises lors de prochains travaux parlementaires.
M. Roland Cash, expert du CNEH , a indiqué que la politique de lutte contre les infections nosocomiales a, pour la première fois, été mise en oeuvre en France il y a une trentaine d'années. Ses structures ont été progressivement organisées et ont été accompagnées d'un développement des moyens de surveillance épidémiologique. Elle s'appuie sur deux fondements législatifs majeurs : la loi du 1er juillet 1998 relative au renforcement de la veille sanitaire et au contrôle de la sécurité sanitaire et celle du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé. Plus récemment, un programme de lutte contre les infections nosocomiales, piloté par le ministère de la santé et un groupe d'experts, a été mis en place pour la période 2003-2008 et des tableaux de bord comparatifs des établissements de santé ont été publiés.
La méthodologie appliquée par le CNEH a consisté en plusieurs entretiens auprès des institutions, des représentants des établissements de santé, des assureurs et des experts, en une analyse bibliographique poussée de la littérature française, européenne et internationale sur le sujet des infections nosocomiales et en une enquête sur place dans trois sites hospitaliers, comportant l'analyse de dossiers de patients particulièrement caractéristiques. Ce travail d'investigation a été complété par une enquête menée par l'Ipsos auprès de professionnels de santé et du grand public.
Selon l'enquête de prévalence menée en 2001, 6,9 % des patients sont infectés lors d'une hospitalisation : il s'agit, dans 40 % des cas, d'infections urinaires, d'infections du site opératoire dans 10 % des cas et de pneumopathies dans 10 % des cas. Ce taux est orienté à la baisse par rapport à l'enquête de 1996. Au total, les infections liées à un soin représentent 22 % des accidents médicaux. Ainsi, 1,5 % des infections chirurgicales ont été suivies d'une infection (cette proportion s'établit à 0,62 % pour les patients dits « à risque faible ») et 14,9 % des patients en réanimation ont été touchés, essentiellement en développant une pneumopathie.
Plusieurs facteurs favorisent la survenance des infections nosocomiales : l'âge élevé du patient, la fragilité de son état de santé, mais aussi la présence d'interventions invasives, de traumatismes ou encore de brûlures. En outre, la résistance élevée des germes aux antibiotiques rend leur traitement délicat, même si le taux de résistance évolue favorablement : la proportion de Staphylococcus aureus résistant à la méticilline (SARM) a ainsi augmenté dans les pays d'Europe, sauf en France où il a diminué (28 % en 2004, contre 33 % en 2002). On estime toutefois qu'un tiers de ces infections pourrait être évité grâce à des mesures de prévention.
Pour les infections nosocomiales acquises en unité de soins intensifs (pneumonie, bactériémie, infection urinaire) et après une intervention chirurgicale, la France se situe dans la moyenne européenne du taux d'infections nosocomiales et même dans la fourchette basse pour certaines interventions, comme celles sur le colon, les cholécystectomies ou les arthroplasties de la hanche.
M. Roland Cash, expert du CNEH , a ensuite procédé à une évaluation de la mortalité liée aux infections nosocomiales, dont on estime qu'elles multiplient par trois le risque de décès. Globalement, le taux de décès imputable d'une façon certaine aux infections nosocomiales serait de 6,6 % des décès totaux en établissement hospitalier de court séjour. Parmi ces décès imputables à une infection, aucune autre cause de décès à court terme n'était présente pour 2,8 % d'entre eux. Si on restreint l'analyse aux décès imputables à la seule infection chez des patients dont le pronostic vital n'était pas engagé à court terme, le taux est de l'ordre de 1,2 %.
Ainsi, on peut estimer le nombre de décès annuels dus aux infections nosocomiales en secteur hospitalier à environ 9.000, dont 4.200 chez des patients pour lesquels le pronostic vital n'était pas engagé à court terme, dont la moitié sans autre cause de décès apparente. Si on applique à ce résultat un taux d'évitabilité de 30 %, il y aurait donc de l'ordre de 1.250 décès directement imputables à une infection, évitables chaque année.
Les surcoûts attribuables aux infections nosocomiales ont fait l'objet d'évaluations à de nombreuses reprises dans la littérature médicale, mais avec des champs d'investigation et des méthodes variables. Ils varient de 500 euros pour une infection urinaire à 40.000 euros pour une bactériémie sévère en réanimation, et suivant le type d'infection, le germe en cause, le site de l'infection, l'unité d'hospitalisation, les facteurs de risque propres au patient et la pathologie pour laquelle il est pris en charge. Ils résultent essentiellement de l'allongement des durées de séjour.
Compte tenu du nombre d'infections constatées et de leur coût moyen, on estime le surcoût total des infections nosocomiales en France entre 0,73 et 1,8 milliard d'euros. De fait, une diminution de 10 % du taux d'infection conduirait à une économie de 240 à 600 millions d'euros. Or, on peut chiffrer l'effort de prévention réalisé par les établissements de santé à environ 100 millions d'euros. Ces mesures de prévention présentent donc un rapport coût-bénéfice favorable.
M. Roland Cash, expert du CNEH, a enfin abordé les effets pervers engendrés par la publication de tableaux de bord des infections nosocomiales dans les établissements de santé. La diffusion publique de données de résultats de soins poursuit deux objectifs : la transparence vis-à-vis des usagers et l'incitation des établissements à s'améliorer, pour conserver leur réputation. Or, en pratique, ces démarches ne produisent pas d'effets favorables évidents dans les pays occidentaux. Elles présentent, en revanche, le risque de pervertir la qualité des données si les établissements se trouvent pénalisés par un mauvais classement.
Pour pallier cet inconvénient, les Etats-Unis ont mis en place des structures neutres indépendantes, qui collectent les données d'accidents médicaux par établissement de manière anonyme, dans un esprit d'amélioration de la qualité de soins.
En matière d'infections nosocomiales, la France a, pour sa part, engagé une politique de publication d'indicateurs, les établissements étant répartis en catégories homogènes pour produire des comparaisons valides. Cinq indicateurs ont été retenus : un indicateur de moyens, l'Icalin, publié au début de l'année 2006, la consommation de produits hydro-alcooliques de désinfection, le taux de staphylocoques dorés résistant à la méticilline, le taux d'infections du site opératoire et la consommation d'antibiotiques, ce dernier indicateur devant devenir un indicateur composite du bon usage des antibiotiques.
M. Nicolas About, sénateur, président , a demandé si un indicateur relatif à la durée de l'hospitalisation en fonction de la pathologie ne serait pas plus pertinent.
M. Roland Cash, expert du CNEH , en est convenu, mais a précisé qu'un tel indicateur n'a pas été retenu à ce jour par le Gouvernement.
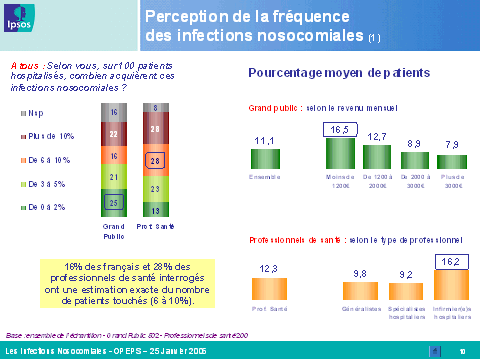
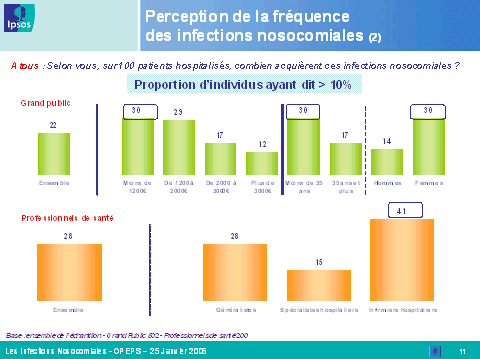
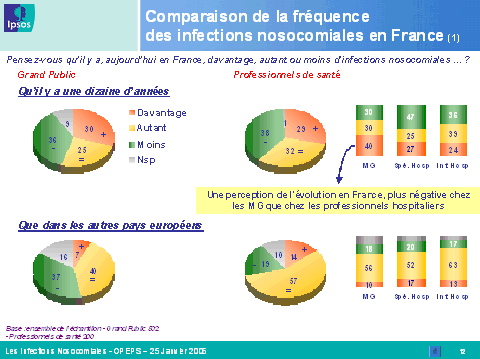
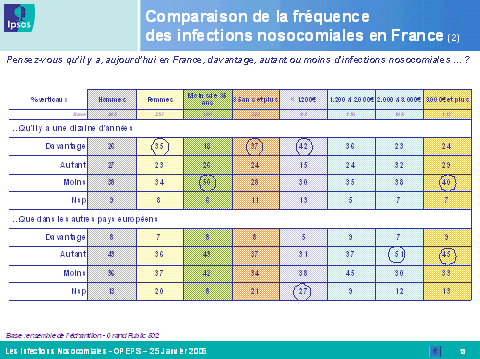
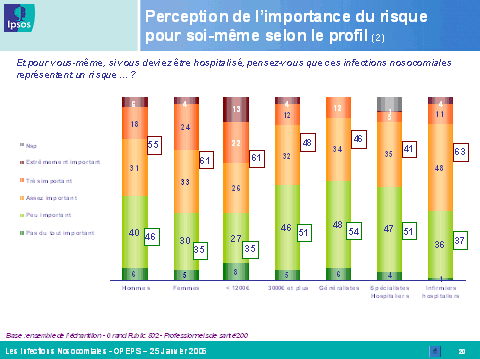
Mme Marion Stéphan, directrice adjointe du département santé de l'Ipsos , a ensuite présenté les conclusions de l'enquête menée par l'institut de sondage sur la perception des infections nosocomiales par le grand public et les professionnels de santé.
Ce sondage a été mené courant janvier par téléphone auprès d'un échantillon de 502 personnes de plus de quinze ans, représentatif de la population française, et de 200 professionnels de santé (médecins généralistes, médecins hospitaliers, infirmiers hospitaliers).
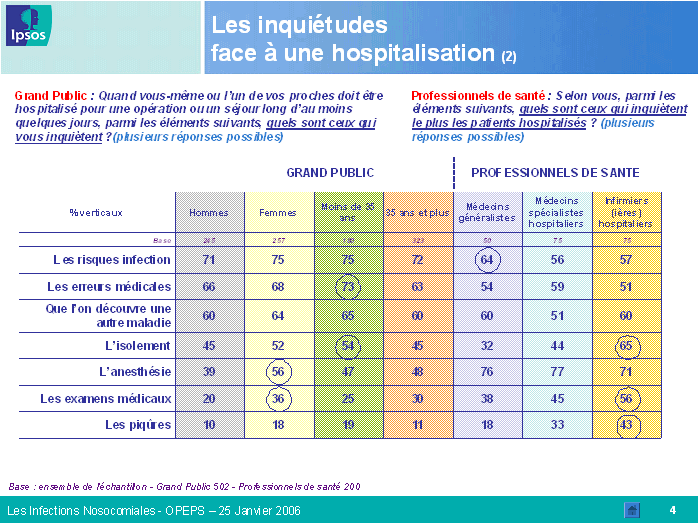
Les résultats obtenus font apparaître des différences majeures entre l'appréciation de la population dans son ensemble et celle des professionnels de santé. Plus encore, on note des écarts importants en fonction de la tranche d'âge et du niveau d'études de la personne interrogée, mais aussi de la spécialité médicale du professionnel. Ainsi, le risque d'infection constitue, pour le grand public, une source d'inquiétude majeure lors d'une hospitalisation, loin devant l'erreur médicale. Les infections nosocomiales sont relativement bien connues, notamment par les individus de plus de trente-cinq ans et par ceux dont le niveau d'études est élevé. Toutefois, il existe toujours un déficit d'information dans les zones rurales, dans les foyers à faibles revenus et auprès des individus dont le niveau d'études est inférieur à bac + 2.
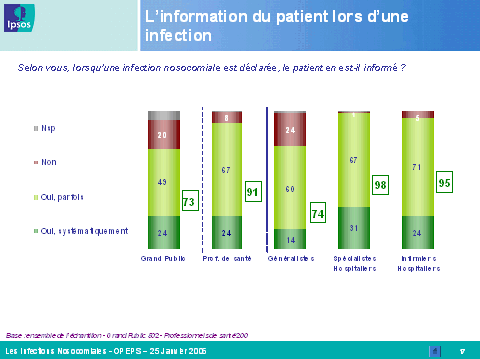
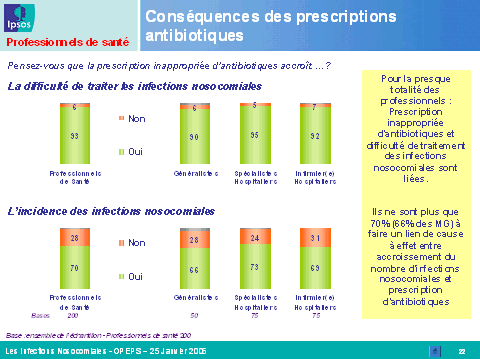
En revanche, les professionnels de santé sous-estiment l'inquiétude et le niveau de connaissance des Français en la matière, alors qu'ils se considèrent eux-mêmes comme très bien informés, notamment les médecins et les infirmiers hospitaliers. Ils connaissent toutefois encore mal, pour près de la moitié d'entre eux, le mécanisme de réparation des infections nosocomiales introduit par la loi du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé.
Enfin, il apparaît que plus de 60 % des personnes interrogées seraient prêtes à recourir à la justice pour être dédommagées si elles étaient touchées par une infection. Parallèlement, un pourcentage identique des professionnels de santé craint de voir sa responsabilité engagée devant le juge.
Puis Mme Claudine Esper, expert du CNEH , a présenté l'analyse du dispositif juridique relatif aux infections nosocomiales mis en place par la loi du 4 mars 2002 pour réparer les préjudices subis par les patients pour les accidents survenus après le 5 septembre 2001.
Dans le cadre du droit commun des accidents médicaux, la faute doit être prouvée par la victime, la solidarité nationale ne joue qu'en l'absence de faute et à certaines conditions (notamment la gravité du dommage). Enfin, une procédure de règlement amiable peut être utilisée au-delà d'un seuil de dommage.
La réparation des préjudices liés aux infections nosocomiales comporte, pour sa part, plusieurs particularités : la responsabilité de l'établissement de santé est automatique, sauf s'il fait la preuve de la cause étrangère (la victime doit en revanche toujours prouver la faute dans le cadre de la médecine de ville) ; en l'absence de faute, la solidarité nationale s'applique dans les mêmes conditions qu'en droit commun. La loi du 30 décembre 2002 relative à la responsabilité civile médicale a par la suite prévu que, lorsque le préjudice subi entraîne une incapacité supérieure à 25 % ou le décès du patient, l'Oniam prend en charge systématiquement la réparation. Le système de réparation est donc complexe et diffère selon le mode de soins (hôpital ou médecine de ville).
A ce socle législatif s'ajoutent des règles spécifiques relatives à l'information : information obligatoire du patient par l'établissement de santé pour tout dommage subi, signalement des infections, par les commissions régionales de conciliation et d'indemnisation (CRCI) et l'Oniam, aux agences régionales de l'hospitalisation (ARH).
L'étude sur les conséquences juridiques des infections nosocomiales a été menée à partir des données fournies par l'Oniam, les assureurs des professionnels de santé (Sham et MACSF), l'Assistance publique-hôpitaux de Paris (AP-HP), qui est son propre assureur, et par trois professionnels de santé. Il apparaît, à cet égard, difficile d'obtenir des chiffres précis identifiant les infections nosocomiales dans les réclamations et les procédures.
Il ressort de cette analyse que l'Oniam a traité dix-neuf dossiers relatifs à une infection nosocomiale en 2004 et quarante-huit en 2005 au titre de préjudices très lourds, ce qui semble très peu au regard des 4.000 décès imputables chaque année à ce phénomène. Les données fournies par ailleurs par les assureurs et l'AP-HP indiquent que la chirurgie orthopédique est particulièrement concernée, que les infections nosocomiales représentent 17 % du coût des sinistres déclarés par les établissements de santé, que les déclarations relatives à ces infections ont presque triplé entre 2002 et 2004 et qu'une liaison tend à s'établir entre la politique de prime adoptée par les assureurs et les mesures de prévention mises en oeuvre.
Mme Claudine Esper, expert du CNEH , a ensuite proposé plusieurs voies de réflexion et de recommandations pour la partie de l'étude relative au dispositif juridique. Elle a estimé qu'une réflexion doit être menée sur le régime préférentiel dont bénéficient actuellement les usagers victimes d'une infection en milieu hospitalier par rapport aux autres victimes d'un accident médical. Selon la volonté politique, ce régime pourrait être étendu ou, au contraire, allégé.
Elle a toutefois jugé prématuré de modifier des textes dont l'application est encore balbutiante, mais a mis l'accent sur le besoin de disposer de données précises et fiables sur le coût des accidents médicaux, l'importance de l'information des patients et des familles, la nécessité d'approfondir les connaissances sur les infections nosocomiales en médecine de ville et de clarifier la rétroactivité de la loi du 30 décembre 2002, dont on ne sait si elle s'applique aux accidents survenus entre le 5 septembre 2001 et le 1er janvier 2003. Elle a enfin souhaité que l'incitation à la gestion du risque soit renforcée par une politique d'assurance cohérente, qui prenne en compte les efforts de prévention réalisés par les établissements de santé.
M. Nicolas About, sénateur, président , a demandé si la clarification de la rétroactivité de la loi du 30 décembre 2002 nécessite une modification législative ou si elle peut être tranchée par la Cour de cassation.
Mme Claudine Esper, expert du CNEH, a indiqué qu'un texte législatif serait approprié au problème posé.
M. Jean Carlet, expert du CNEH , a ensuite exposé les recommandations proposées par le rapport. Elles concernent en premier lieu le renforcement des politiques de bon usage des antibiotiques en l'inscrivant dans les programmes de formation médicale continue des médecins de ville, en donnant un support réglementaire à la commission antibiotiques et en mettant en place des équipes opérationnelles sur l'antibiothérapie dans les établissements de santé.
Il s'agit, en second lieu, d'améliorer l'application des recommandations en matière d'hygiène et des mesures de prévention, en développant les audits de pratiques et les revues de morbi-mortalité dans les établissements, en créant un statut d'infirmière hygiéniste et en revalorisant la fonction et le rôle des médecins hygiénistes.
Il convient également de mettre en place des unités de référence pour la prise en charge des infections ostéo-articulaires et, afin de mieux connaître les séquelles des infections, de constituer un registre des patients porteurs de prothèses orthopédiques ainsi que, plus largement, de promouvoir la recherche en matière d'infections nosocomiales, notamment dans quatre domaines mal connus : la physiopathologie des infections du site opératoire et leur prévention, l'évitabilité réelle des infections nosocomiales, le comportement des professionnels de santé et la survenance d'infections dans les établissements d'hébergement des personnes âgées.
Enfin, il a proposé de faire évoluer la politique de publication d'indicateurs de qualité, avec une distinction des tableaux de bord « grand public » et des tableaux de bord opérationnels pour les établissements dans le cadre de leur politique interne d'amélioration continue de la qualité et une réflexion sur d'autres indicateurs, comme la vaccination anti-grippale du personnel.
M. Nicolas About, sénateur, président , a salué la qualité de l'étude présentée et a souhaité que ses recommandations puissent être reprises dans le cadre des prochains projets de loi de financement de la sécurité sociale.
M. Jean-Michel Dubernard, député, vice-président , s'est déclaré favorablement impressionné par le rapport du CNEH, notamment pour la partie qui concerne l'enquête de l'Ipsos. Il a estimé à cet égard que la méthode de sondage utilisée doit être validée pour que les résultats puissent être considérés comme significatifs.
Rappelant que l'objectif de l'Opeps est d'éclairer le Parlement au moment des débats du projet de loi de financement de la sécurité sociale, il a souhaité que M. Alain Vasselle, sénateur, rapporteur, tire de cette étude les éléments qui pourront être repris dans ce cadre à l'automne.
Concernant les infections urinaires, qui représentent jusqu'à 40 % des infections nosocomiales, il a estimé, si elles sont simples à prévenir, qu'elles sont difficiles à traiter et qu'il faut donc développer les mesures de prévention.
Il a enfin abordé la question du lien entre l'architecture hospitalière, notamment au niveau de l'organisation du bloc opératoire, et l'apparition plus ou moins fréquente d'infections nosocomiales. Il a indiqué, à cet égard, que la durée de vie d'un hôpital est inférieure à trente ans aux Etats-Unis alors qu'elle peut, en France, dépasser plusieurs centaines d'années. Il a regretté le faible nombre d'architectes hospitaliers spécialisés dans notre pays et a cité l'exemple des flux laminaires, mis au point il y a trente ans, qui ont permis une nette diminution des infections en chirurgie orthopédique.
M. Nicolas About, sénateur, président , a considéré que les médecins libéraux ne pourraient supporter, en termes d'assurance, un système d'indemnisation de la victime sans faute, identique à celui applicable aux établissements de santé. Il s'est également interrogé sur les outils mis en oeuvre pour permettre le suivi des indicateurs et le contrôle des données dans les hôpitaux.
M. Gilbert Barbier, sénateur , a estimé que la formation initiale des médecins doit être renforcée en matière d'hygiène et de prescription d'antibiotiques. Il s'est interrogé sur la réalité de l'accusation portée sur les chirurgiens orthopédiques, alors que les infections nosocomiales sont souvent d'origine endogène.
M. Paul Blanc, sénateur , a demandé pour quelles raisons la France est le seul pays d'Europe où la résistance du staphylocoque doré à la méticilline a diminué ces dernières années.
M. Alain Vasselle, sénateur, rapporteur , a précisé que les recommandations du CNEH mettent également l'accent sur la formation initiale des médecins. Il a souhaité qu'un système d'incitation financière s'applique aux établissements de santé les plus performants en matière de prévention des infections nosocomiales.
M. Nicolas About, sénateur, président , s'est interrogé sur la validité de la comparaison entre le coût de la prévention et celui des infections nosocomiales et sur la réalité des mesures d'économies engendrées par la prévention.
M. Roland Cash, expert du CNEH , a rappelé que l'enjeu des politiques de lutte contre les infections nosocomiales est la diminution du taux de prévalence de celles-ci. On estime à l'heure actuelle qu'une diminution de 10 % rend les mesures de prévention économiquement efficaces.
Il a indiqué que le Gouvernement a récemment mis à la disposition des établissements de santé une déclaration standard de leurs données concernant les infections nosocomiales. Les ARH sont également mobilisées pour contrôler le contenu de ces déclarations.
M. Jean Carlet, expert du CNEH , a reconnu que l'architecture hospitalière constitue un facteur important de prévention des infections, mais a estimé qu'il ne doit pas devenir un prétexte qui excuserait les comportements des professionnels de santé.
Il a souligné que, pour connaître plus finement les origines des infections nosocomiales, il convient de développer la recherche en physiopathologie. On estime, à cet égard, que de nombreuses infections interviennent après l'opération et ne mettent pas en jeu l'équipe chirurgicale.
M. Pascal Astagneau, membre du conseil d'experts de l'Opeps , a considéré que le taux d'infections nosocomiales constitue un indicateur délicat de jugement de la qualité d'un hôpital. Il peut en effet être dangereux de le considérer isolément sans prendre en compte la prise en charge de la douleur, la satisfaction des patients ou l'organisation de la filière de soins.
2- Compte rendu de la réunion du mercredi 21 juin 2006
Réuni le mercredi 21 juin 2006 , sous la présidence de M. Nicolas About, président, l'Office parlementaire d'évaluation des politiques de santé (Opeps) a procédé à l'examen du rapport de M. Alain Vasselle, sénateur, sur la politique de lutte contre les infections nosocomiales.
M. Alain Vasselle, sénateur, rapporteur, a indiqué que, dans 6 % à 7 % des cas d'hospitalisation, en France, le malade développe une infection nosocomiale plus ou moins grave, soit 750.000 cas déplorés chaque année, avec des conséquences parfois dramatiques.
Ces infections peuvent provenir d'une bactérie endogène du patient : elles sont alors imprévisibles et souvent graves lorsqu'elles surviennent dans la zone anatomique opérée ; elles peuvent être aussi causées par une bactérie exogène présente dans l'établissement de santé, chez le personnel soignant, un autre patient ou un visiteur ; elles peuvent enfin, ce qui est alors souvent bénin, résulter d'un virus.
Les infections nosocomiales se traduisent le plus souvent par des infections urinaires (40 % des cas), des infections de la peau et des tissus (11 % des cas, notamment dans les services de long séjour et en psychiatrie), des pneumopathies (10 % des cas, souvent en réanimation) et des infections respiratoires hautes (9 %). Par ailleurs, les infections de l'organe opéré ou de la cicatrice et les bactériémies représentent respectivement 10 % et 4 % des infections nosocomiales.
La part des infections nosocomiales dans l'ensemble des accidents médicaux ne doit toutefois pas être surestimée dans la mesure où, si elles constituent 22 % des événements graves liés aux soins, les accidents médicamenteux, par exemple, en causent 27,5 %.
La survenance d'une infection nosocomiale est souvent liée à la pratique de soins invasifs, par exemple la pose d'une sonde ou d'un cathéter, à la réalisation d'un acte chirurgical, comme la pose d'une prothèse, et parfois au traitement lui-même, notamment lorsqu'il nécessite une transfusion ou une ventilation artificielle. Enfin, une immuno-dépression, un mauvais état général du patient, un âge avancé ou une pathologie menaçant le pronostic vital constituent des facteurs de risques majeurs.
La gravité de l'infection peut, par ailleurs, être exacerbée par l'utilisation d'antibiotiques qui sélectionnent des bactéries résistantes aux traitements. Or, la France détient, en Europe, le record du taux de résistance aux antibiotiques, notamment ceux utilisés pour combattre les principales bactéries à l'origine des infections nosocomiales.
M. Alain Vasselle, sénateur, rapporteur , a fait valoir que, du fait de leur origine endogène fréquente, il semble que 70 % des infections nosocomiales ne pourraient être évitées, même en faisant preuve d'une meilleure prévention.
Rappelant que la mesure précise du nombre de décès directement dus à une infection nosocomiale constitue un exercice délicat, dans la mesure où les patients entrent souvent à l'hôpital avec une pathologie grave et dans un état de fragilité générale, il a indiqué qu'environ 6,6 % des 136.000 décès qui interviennent chaque année à l'hôpital ou après une hospitalisation surviennent en présence d'une infection de ce type. Elle serait donc en cause pour environ 9.000 décès par an, dont 4.200 concernent des patients pour lesquels le pronostic vital n'était pas engagé à court terme à leur entrée à l'hôpital. Pour la moitié de ces 4.200 décès, aucune autre cause de décès n'a été identifiée.
Les infections nosocomiales sont également la cause de séquelles souvent considérables à moyen et long termes, notamment au niveau fonctionnel ; leur gravité dépend largement de la zone anatomique touchée par l'infection. Les infections abdominales, ostéo-articulaires, en particulier sur les prothèses, ou encore les infections suivant un acte de neurochirurgie sont susceptibles d'entraîner les conséquences sanitaires les plus dramatiques. Il a regretté, à cet égard, qu'aucune étude globale n'ait encore été menée sur les séquelles dues à une infection et sur leurs conséquences en termes sanitaires et économiques.
Puis M. Alain Vasselle, sénateur, rapporteur , a indiqué que les infections nosocomiales entraînent également un surcoût financier important, essentiellement dû à un allongement de la durée d'hospitalisation, qui atteint quatre jours en moyenne, au traitement anti-infectieux et aux examens de laboratoire nécessaires au diagnostic et à la surveillance de l'infection. La survenance d'une infection prolonge ainsi le séjour en chirurgie orthopédique de près de deux semaines et augmente les coûts de prise en charge de 300 %.
Les différentes études disponibles font état d'une échelle de coûts très large, allant de 340 euros en moyenne pour une infection urinaire à 40.000 euros pour une bactériémie sévère en réanimation. En appliquant une fourchette de surcoût moyen de 3.500 à 8.000 euros par infection aux 750.000 infections nosocomiales annuelles, on atteint un montant de dépenses de 2,4 à 6 milliards d'euros. Ainsi, une diminution de 10 % du nombre d'infections conduirait à une économie de 240 à 600 millions d'euros, soit jusqu'à six fois plus que l'effort de prévention, qui s'établit à 100 millions d'euros, consenti par les établissements hospitaliers.
Le calcul du coût des infections nosocomiales doit également prendre en compte celui de l'indemnisation du dommage. Depuis la loi du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé, les victimes d'infections nosocomiales postérieures au 5 septembre 2001 bénéficient d'un régime d'indemnisation plus favorable que celui applicable à la réparation des autres accidents médicaux. Ainsi, la responsabilité de l'établissement de santé est automatique, sauf à ce qu'il prouve lui-même que l'infection est due à une cause étrangère, et il revient à son assureur de prendre en charge la réparation.
La loi du 30 décembre 2002 relative à la responsabilité civile médicale a complété ce dispositif en confiant à la solidarité nationale, via l'office national d'indemnisation des accidents médicaux (Oniam), la prise en charge de l'ensemble des infections, que l'établissement en soit ou non responsable, lorsqu'elles ont entraîné le décès du patient ou un taux d'incapacité permanente partielle au moins égal à 25 %.
Ce dispositif d'indemnisation protecteur des victimes pose deux difficultés : d'abord, il n'est pas applicable aux infections acquises en médecine de ville, pour lesquelles il revient au patient d'apporter la preuve de la faute du professionnel de santé ; ensuite, les infections graves survenues entre le 5 septembre 2001 et le 1 er janvier 2003 relèvent d'un régime juridique incertain : l'interrogation demeure sur leur prise en charge, par les assureurs ou par la solidarité nationale, en l'absence de rétroactivité claire de la loi du 30 décembre 2002 et du fait d'une jurisprudence contradictoire sur ce point.
M. Alain Vasselle, sénateur, rapporteur , a ensuite présenté la politique de lutte contre les infections nosocomiales. Il a rappelé que les premières structures de prévention ont été mises en place en 1988 avec la création obligatoire d'un comité de lutte contre les infections nosocomiales dans chaque établissement de santé public ou participant au service public, avec pour mission d'organiser la surveillance des infections dans l'établissement, de former les personnels et de proposer toute recommandation utile à la prévention.
Cette première étape a été suivie, en 1992, par la création du comité national de lutte contre les infections nosocomiales et de cinq centres de coordination de lutte contre les infections nosocomiales, chargés notamment de la coordination des actions menées par les établissements qui ressortent de leur compétence régionale, ainsi que du recueil épidémiologique de prévalence et de la réalisation d'études épidémiologiques.
Puis la loi du 1 er juillet 1998 relative au renforcement de la veille sanitaire et au contrôle de la sécurité sanitaire des produits destinés à l'homme a étendu le dispositif aux cliniques privées. Enfin, la surveillance épidémiologique a été améliorée à partir de 2001 par la mise en place du réseau d'alerte, d'investigation et de surveillance des infections nosocomiales (Raisin), en lien avec l'institut de veille sanitaire (InVS).
Cette politique a produit des résultats non négligeables en termes de prévalence des infections nosocomiales parmi les patients hospitalisés : entre 1996 et 2001, leur taux a été ramené de 8,3 % à 7,2 % dans les centres hospitaliers universitaires et de 6,5 % à 5 % dans les centres hospitaliers. La nouvelle enquête de prévalence, en cours, montrera si cette tendance se confirme.
Récemment, le dispositif de prévention a été renforcé et modernisé par la mise en place d'un programme de lutte contre les infections pour la période 2005-2008, qui a pour objectifs de renforcer les structures, d'améliorer la qualité de la prise en charge du patient infecté, d'actualiser les recommandations, de renforcer la surveillance épidémiologique des infections, mais aussi de mieux informer les usagers sur le risque infectieux. La publication progressive d'indicateurs de qualité pour chaque établissement de santé a commencé avec la présentation, en février 2006, d'un indicateur composite d'évaluation des activités de prévention, qui sera suivie, dans les prochains mois, par la publication de quatre indicateurs supplémentaires : le taux d'infections par type d'acte opératoire, le volume annuel de produits hydro-alcooliques utilisés pour l'hygiène des mains, le taux de staphylocoques dorés résistants à la méticilline et le suivi de la consommation d'antibiotiques.
Enfin, une mission nationale d'information et de développement de la médiation sur les infections nosocomiales (Idmin) a été créée au sein de la Haute Autorité de santé pour améliorer l'information des usagers.
M. Alain Vasselle, sénateur, rapporteur , a rappelé que, dans le cadre de son étude sur les infections nosocomiales, l'Opeps a confié à l'institut de sondages Ipsos une enquête sur la perception du risque d'infections nosocomiales à la fois par les professionnels de santé et par le grand public. Il en ressort que le risque d'infection à l'hôpital est désormais connu par la grande majorité des Français, qui ont pris conscience des conséquences possibles d'une hospitalisation, mais que l'information est encore trop partielle s'agissant des facteurs de risque et des conséquences sanitaires. De la même manière, les professionnels de santé doivent être davantage sensibilisés au mécanisme d'indemnisation, notamment pour être en mesure d'informer correctement leurs patients de son existence.
Il a estimé que la politique de lutte contre les infections nosocomiales doit désormais s'orienter dans trois directions pour assurer la réduction du taux de prévalence de ce type d'infections dans les hôpitaux français :
- la première piste concerne la poursuite de la politique d'hygiène et de prévention grâce à une meilleure reconnaissance des métiers de l'hygiène, infirmier hygiéniste et médecin hygiéniste, et au strict respect des mesures de prévention par les professionnels de santé, comme la désinfection systématique des mains ou l'observation des bonnes pratiques pour ce qui concerne les soins, en particulier ceux liés à un dispositif invasif. La politique de prévention doit aussi promouvoir le développement des examens de dépistage de la présence de bactéries endogènes chez le patient avant une opération à risques et l'application des pratiques de bon usage des antibiotiques nécessaires à la limitation de l'évolution constatée des bactéries multirésistantes ;
- la deuxième piste concerne la recherche des meilleurs traitements pour les patients atteints d'une infection. Il s'agit notamment d'accélérer la mise en place des unités spécialisées dans la prise en charge des infections ostéo-articulaires prévues par le programme national de lutte contre les infections nosocomiales 2005-2008 et destinées à éviter les complications graves liées à un traitement inadapté, ce qui suppose la formation d'équipes de soignants spécialisées en infectiologie et en chirurgie, en nombre insuffisant aujourd'hui. Par ailleurs, l'effort de recherche doit porter sur l'origine des infections nosocomiales, en particulier les raisons pour lesquelles les bactéries exogènes parviennent dans la plaie opératoire et les relations entre la présence de bactéries endogènes avant l'opération et la survenance d'une infection postopératoire, et sur les séquelles des infections et le suivi des patients susceptibles de développer une infection, grâce à la constitution d'un registre des patients porteurs de prothèses orthopédiques, pour réagir vite en cas d'alerte ;
- la troisième piste porte sur la clarification du dispositif juridique d'indemnisation afin de trancher sans tarder, au niveau législatif, la question de la rétroactivité, ou non, de la loi du 30 décembre 2002 pour les infections survenues entre le 5 septembre 2001 et le 1er janvier 2003.
M. Jean-François Picheral, sénateur , s'est étonné, au regard de la politique affichée par les pouvoirs publics d'intensification de la lutte contre les infections nosocomiales, que trois hôpitaux publics des environs d'Aix-en-Provence aient dû fermer leurs services de stérilisation, qui n'étaient plus aux normes, pour en confier l'activité à des entreprises extérieures. Il a estimé que cette décision n'est pas cohérente avec l'objectif de maîtrise du risque infectieux dans les établissements de santé. Il a souhaité, à cet égard, la mise en place d'une organisation nationale des services de stérilisation pour l'hôpital public.
M. Gérard Bapt, député , a fait valoir que les décisions de fermeture de services sont souvent prises pour des raisons de gestion locale de l'organisation des soins. Il a considéré qu'il est préférable de fermer les services dangereux pour y investir les crédits nécessaires à leur mise aux normes.
M. Jean-François Picheral, sénateur , a estimé qu'il convient au contraire d'aider les services des hôpitaux publics à assurer une prestation de qualité, avant que leur vétusté n'oblige à les fermer.
M. Gérard Bapt, député, a rappelé qu'un groupe de travail existe à l'Assemblée nationale sur les infections nosocomiales, dont l'activité a été suspendue pendant la durée de l'étude de l'Opeps sur le même thème. Il a souhaité qu'il puisse suivre l'application des recommandations du rapport dans les prochains mois. Il a demandé combien d'hôpitaux sont équipés de livrets de bonnes pratiques sur les protocoles de soins.
Mme Maryvonne Briot, députée , s'est interrogée sur l'existence de données pour la légionellose.
Citant l'exemple de l'hôpital européen Georges Pompidou, M. Paul-Henri Cugnenc, député , a estimé que les cas de légionellose n'y ont pas été plus nombreux qu'ailleurs, mais que les médias s'y sont particulièrement intéressés en raison de sa réputation d'établissement modèle. Il a indiqué qu'après six ans de dysfonctionnements, le fonctionnement de cet hôpital est désormais conforme aux exigences de qualité.
En réponse aux intervenants, M. Alain Vasselle, sénateur, rapporteur , a indiqué que l'étude du centre national d'expertise hospitalière n'a pas traité particulièrement des cas de légionellose. Il a rappelé que ce type de données devrait être apprécié avec le retour des fiches de signalements des hôpitaux, qui doivent faire connaître les infections les plus graves ainsi que les mesures de prévention mises en oeuvre.
Mme Maryvonne Briot, députée , a considéré que le premier geste de prévention est celui d'un bon entretien des locaux hospitaliers. Rappelant que le nombre d'agents de service est en diminution constante, elle s'est interrogée sur le respect des protocoles d'hygiène par des équipes extérieures à l'établissement.
M. Paul-Henri Cugnenc, député , a estimé que les gestes d'hygiène résultent avant tout du bon sens, comme le nettoyage des mains et des locaux pour éviter le développement de germes.
M. Gérard Bapt, député , a fait valoir qu'il est nécessaire de disposer d'un personnel soignant et d'entretien permanent pour assurer le bon respect de ces règles.
M. Alain Vasselle, sénateur, rapporteur , a rappelé, à cet égard, l'importance du rôle, insuffisamment reconnu, des infirmières hygiénistes dans les établissements de santé.
A l'issue de ce débat, l'Opeps a autorisé la publication du présent rapport d'information.
II. ETUDE
|
|
CNEH 3 RUE DANTON 92240 MALAKOFF DÉPARTEMENT 01 41 17 15 36 |
SÉNAT
OFFICE PARLEMENTAIRE D'ÉVALUATION
DES POLITIQUES DE SANTÉ

LA POLITIQUE DE LUTTE
CONTRE LES INFECTIONS NOSOCOMIALES

RAPPORT FINAL
JUIN 2006
La conclusion s'affirma de suite : ce sont les doigts des étudiants, souillés au cours de récentes dissections, qui vont porter les fatales particules cadavériques dans tous les organes génitaux des femmes enceintes.
Semmelweis a, de suite, idée de la prophylaxie : « désodoriser les mains » en les lavant dans une solution de chlorure de chaux. Le résultat ne se fait pas attendre, il est magnifique. Dans les mois suivants, à la maternité de Bartch qui a recueilli Semmelweis sur l'insistance de Skoda, la mortalité par fièvre puerpérale devient presque nulle ; elle s'abaisse pour la première fois au taux actuel des meilleures maternités du monde, 0,23%.
Il semblait qu'obstétrique et chirurgie eussent dû accueillir avec enthousiasme l'immense progrès qui leur était offert. Il n'en fut rien.
Céline, Les derniers jours de Semmelweis, 1924
A. INTRODUCTION
La présente étude, réalisée à l'initiative de l'OPEPS, a pour objet de dresser un panorama d'ensemble de la politique de lutte contre les infections nosocomiales (IN), pour aboutir à une série de recommandations opérationnelles.
Cette analyse se place dans un contexte particulier puisqu'un programme national de lutte contre les infections nosocomiales vient d'être engagé sur la période 2005-2008 (faisant suite d'ailleurs à un programme précédent ayant déjà fait avancer de nombreux dossiers), et que ce programme a justement pour vocation de résoudre les points de blocage identifiés. Nous en analyserons les composantes dans le présent rapport ; ce programme a déjà connu quelques réalisations avec la publication du premier indicateur constituant le tableau de bord de lutte contre les IN ; cet indicateur, l'ICALIN, est un indicateur de moyens, mais témoigne de la volonté des pouvoirs publics de renforcer la transparence dans ce domaine.
Cette volonté de transparence et d'amélioration des pratiques, de la surveillance et de la prévention des IN a été notamment manifeste suite à certaines affaires dramatiques comme l'affaire de la clinique du Sport, dont l'une des conséquences a été la création d'une association, le LIEN, extrêmement active dans le domaine. Le vote de la loi de mars 2002 sur les « droits des malades » a été un autre moment fort, manifestant la nouvelle place que prennent les usagers dans les choix opérés dans le système de soins. Il s'agit, dans ce dossier des IN, d'un élément très structurant.
Même si, comme nous le verrons, les IN ne représentent pas le principal problème en matière d'accidents médicaux sur le plan quantitatif, elles constituent par contre de très loin le premier thème de sensibilisation des citoyens vis-à-vis de la sécurité des soins. Le terme est connu, assorti le plus souvent et malheureusement de la notion de faute (alors que la plupart des IN sont inévitables, en ce sens qu'aucune mesure de prévention ne permettrait de les éviter), ajoutant à la « judiciarisation » croissante des activités de soins. Il est possible qu'il y ait toutefois dans ce dossier un fort malentendu entre les professionnels de santé et les patients : les professionnels connaissent avec les IN, comme avec les autres accidents médicaux, une culpabilisation, un sentiment d'échec, même en l'absence de faute, et craignent le contentieux ; de leur côté, les patients ne cherchent pas tant à engager un tel contentieux qu'à être informés de ce qui arrive, et c'est très souvent dans cette absence d'information et de considération que se noue le conflit. La situation est rendue encore plus difficile par la complexité des IN, la variabilité des situations, la discussion sur « l'évitabilité », etc. Et les connaissances dans ce domaine sont encore insuffisantes : on ignore encore l'essentiel de la physiopathologie des infections du site opératoire par exemple ; on ne sait pas bien déterminer, au sein des différentes mesures de prévention disponibles, lesquelles sont les plus efficaces, etc.
A noter que, pour ajouter à cette complexité, le terme d'IN tend à être remplacé par le terme d'infections liées aux soins, pour englober les infections acquises en dehors de la sphère hospitalière.
En tout état de cause, la lutte contre les infections nosocomiales est une préoccupation des pouvoirs publics français depuis près de 20 ans.
L'effort entrepris semble avoir porté ses fruits, puisque selon la dernière enquête nationale de prévalence des incidences nosocomiales réalisée en 2001, leur taux de prévalence aurait diminué de 13% pour les patients hospitalisés dans les CHU et de 24% pour les patients hospitalisés dans les CH par rapport à l'enquête précédente.
La France dispose pour suivre ces évolutions de nombreux outils concernant la lutte contre les infections nosocomiales : les rapports du Réseau d'Alerte d'Investigation et de Surveillance des Infections Nosocomiales (RAISIN) coordonné par les CCLIN sur la surveillance des sites opératoires et des services de réanimation, les données collectées par l'Institut National de Veille Sanitaire, les bilans standardisés des CLIN des établissements de santé.
Cependant, si l'amélioration est indéniable, l'effort dans la lutte contre les infections nosocomiales doit être poursuivi.
Il est intéressant de souligner que, dans la dernière enquête effectuée par la Fédération hospitalière de France en avril 2006 auprès d'un échantillon de 1000 français adultes, la tendance de l'opinion s'inverse par rapport à 2004. Les répondants ne sont plus que 44% à estimer qu'il y a plus de risques liés aux infections nosocomiales qu'il y a quelques années, une proportion en repli de 19 points depuis 2004. En parallèle, 42% soulignent une amélioration, soit 18 points de plus que lors de la dernière enquête.
Dès lors, que peut ajouter un travail supplémentaire sur les IN ? Nous avons choisi de nous concentrer sur quelques aspects de ce dossier, afin de :
o situer la France parmi ses voisins dans cette politique de lutte contre les IN,
o déterminer quelle peut être la mortalité attribuable aux IN,
o discuter la question du coût des IN et déterminer si les actions menées présentent un rapport coût/bénéfice favorable, compte tenu du fort taux d'IN non évitables,
o comprendre comment a évolué la politique de lutte contre les IN ces dernières décennies, en nous arrêtant notamment sur la publication d'indicateurs de qualité dans la lutte contre les IN,
o faire le point sur le dispositif juridique complexe régissant les recours possibles des patients victimes d'une IN et les conséquences judiciaires des IN,
afin d'aboutir à des recommandations, sachant que sur de nombreux points, ces recommandations constituent des accents particuliers portés sur les axes du programme national. Il s'agit surtout de prioriser ces actions, éventuellement de les compléter.
Enfin, pour éclairer le contexte, une enquête auprès du grand public et des professionnels de santé a été réalisée par l'IPSOS, afin de mieux appréhender et prendre en compte les attentes des usagers comme des professionnels, et d'évaluer les représentations, les opinions, les attitudes et les comportements en ce qui concerne les risques de santé à l'hôpital.
Certains aspects ne sont par contre pas détaillés, notamment la physiopathologie des IN ou les recommandations pour la prévention ; il s'agit de thèmes évidemment fondamentaux, qui relèvent directement de l'expertise des professionnels et des sociétés savantes.
B. METHODOLOGIE
Le schéma suivant retrace les différentes étapes du projet :
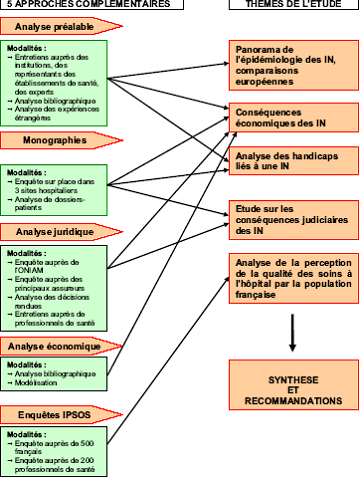
Nous reviendrons sur chacune de ces étapes dans les chapitres qui suivent. A la fin de chacun de ces chapitres, une courte synthèse en résume les principaux enseignements.
Il est évident que ce travail n'aurait pas pu aboutir sans l'aide précieuse de l'ensemble des experts que nous avons interrogés et sollicités, que nous tenons à remercier :
o Pr Pascal ASTAGNEAU, APHP/La Pitié, CCLIN Paris Nord
o Pr Gilles BEAUCAIRE, CHU Lille.
o Dr Anne-Carole BENSADON, DHOS, Accord-cadre national relatif au bon usage des antibiotiques dans les établissements de santé
o M. Frédéric BIOSSE-DUPLAN, UFC Que Choisir ?
o M. Frédéric BOUSQUET, HAS
o Pr Christian BRUN-BUISSON, réanimateur, APHP/Henri Mondor, coordinateur du programme national de lutte contre les infections nosocomiales
o M. Alain-Michel CERETTI, ancien président du LIEN, président de l'IDMIN
o Dr Bruno COIGNARD, Institut de Veille Sanitaire
o Pr Jacques FABRY, Hospices Civils de Lyon, coordonnateur Helics
o Dr Jeannot GAUDIAS, anesthésiste-réanimateur, CTO de Strasbourg
o Pr Alain LORTAT-JACOB, chirurgie orthopédique, Hôpital Ambroise Paré, Assistance Publique-Hôpitaux de Paris
o Pr Jean-Christophe LUCET, APHP/Bichat, Unité d'hygiène et de lutte contre les IN (UHLIN)
o Dr Patrick MAMOUDY, Hôpital de la Croix Saint Simon, chirurgie orthopédique
o M. Etienne MINVIELLE, INSERM, projet COMPAQH
o Pr Pierre PARNEIX, CHU Bordeaux, CCLIN Sud-Ouest
o M. Loïc RICOUR, directeur de l'IDMIN
o Mme Valérie SALOMON, DHOS, cellule infections nosocomiales
o Pr Benoît SCHLEMMER, APHP/Saint-Louis,
o M. Benoît Schlemmer, CHU Saint-Louis, Plan National d'action pour préserver l'efficacité des antibiotiques 2001 - 2005
o Dr Jean-Pierre SOLLET, réanimation polyvalente, Centre hospitalier Victor Dupouy, Argenteuil
o Dr Daniel TALON, bactériologie, CHU de Besançon
o Pr Alain VAILLANT, chirurgie cardiaque, Clinique Clairval, Marseille
L'équipe en charge de la réalisation de cette étude et de la rédaction du rapport est la suivante :
o CNEH :
o Dr Jean CARLET
o Dr Evelyne CASH
o Dr Roland CASH
o Catherine DUPILET
o Claudine ESPER
o Sanaa MARZOUG
o Stéphanie SEGUI
o IPSOS :
o Patrick KLEIN
o Marion STEPHAN
o o C. EPIDEMIOLOGIE DES INFECTIONS NOSOCOMIALES
Introduction et points clés
Une infection est dite nosocomiale si elle était absente à l'admission à l'hôpital. Autrement, on parle d'infection communautaire. Un délai de 48 h est en général accepté pour distinguer une infection communautaire d'une infection nosocomiale. En outre, pour les infections du site opératoire (ISO), on accepte comme nosocomiales les infections survenues 30 jours après l'intervention (et même 1 an après pose de prothèse).
Deux voies de contamination sont possibles :
o la voie endogène : les sites normalement stériles sont contaminés puis colonisés par la flore dont est porteur le patient lui-même, à la faveur d'un acte invasif et/ou en raison d'une fragilité particulière ;
o la voie exogène, associée à la colonisation du patient par des bactéries extérieures, provenant d'autres malades, du personnel ou de l'environnement, transmises de manière indirecte (aérosols, manuportage, matériels...). Ces contaminations peuvent être limitées en grande partie (mais pas totalement) par une bonne observance de l'hygiène des mains, un entretien de l'environnement et des matériels adéquats.
Le patient
Le développement d'une infection bactérienne implique la présence chez le patient d'une sensibilité particulière à développer une telle infection (facteur génétique, âge, co-morbidités, etc.) ; ces facteurs de risque ne peuvent donc pas être éliminés. Par contre, d'autres facteurs de risque connus peuvent l'être, ou du moins fortement réduits, comme certaines procédures invasives (par exemple le sondage vésical pour les infections urinaires, IN la plus fréquente), des facteurs environnementaux (chambres à plusieurs lits), des facteurs organisationnels (absence de personnels dédiés à l'hygiène, mauvaise accessibilité aux postes de lavage des mains) et une charge de travail trop importante des infirmières, des puéricultrices, etc.
Plus précisément, il est possible de lister les facteurs qui prédisposent aux IN, en les rangeant dans 4 catégories :
o facteurs liés à l'état du patient :
âge avancé / nouveau-nés
malnutrition
alcoolisme
tabagisme
maladie chronique pulmonaire
diabète
immunodépression (VIH, myélome...)
o facteurs liés à un processus aigu :
traumatisme
brûlures
o facteurs liés à une intervention invasive :
intervention chirurgicale
intubation endotrachéale ou nasale (associée selon un rapport du NNIS (National Nosocomial Infection Surveillance) à 83% des pneumonies nosocomiales, sur 498 998 patients)
cathétérisation veineuse centrale (associée selon un rapport du NNIS à 87% des bactériémies nosocomiales), ou périphérique
dialyse
drains chirurgicaux
tube nasogastrique
trachéotomie
cathéter urinaire (associé selon un rapport du NNIS à 97% des infections urinaires nosocomiales)
o facteurs liés au traitement :
transfusions
traitement récent anti-bactérien
traitement immuno-suppresseur (comme les corticostéroïdes)
prophylaxie de l'ulcère de stress
position du patient
nutrition parentérale
IN liées à une bactérie endogène
Ce sont de loin les plus fréquentes.
Parmi les IN liées à un soin, celles qui sont acquises sur site opératoire posent des problèmes car mal comprises, donc difficiles à combattre puisque dans la majorité des IN du site opératoire, ce sont les bactéries endogènes du patient qui sont responsables de l'infection (flore cutanée du patient). Des préconisations existent sous forme d'administration prophylactique d'antibiotiques.
Un autre exemple de ce type d'IN est l'infection du poumon avec ventilation artificielle ; ce sont les bactéries situées dans les sécrétions oro-pharyngées, qui sont, en majorité, responsables de l'infection. Une décontamination oro-pharyngée, la position semi-assise du patient, semblent réduire la fréquence des pneumopathies.
La résistance des bactéries aux antibiotiques
Les résistances les plus préoccupantes sont les suivantes :
o Staphyclococcus aureus à la méticilline (SARM)
o Entérocoques à la vancomycine
o Escherichia coli à la 3ème génération des céphalosporines
o Pseudomonas aeruginosa aux quinolones, à l'imipeneme et à la 3ème génération des céphalosporines
Rappelons que selon une étude réalisée en 1992 dans les réanimations européennes (étude EPIC, et résultats publiés dans JAMA, en 1995, par JL Vincent et al.), les plus fortes résistances de Staphylococcus aureus et de Pseudomonas aeruginosa étaient observées dans les unités de soins intensifs italiennes, françaises et grecques. En 2004, il est noté par l'EARSS une diminution du taux de SARM en France (voir plus loin), mais pour l'instant, les résistances aux antibiotiques des bactéries responsables des IN restent à des taux élevés.
La forte résistance aux antibiotiques des bactéries impliquées dans les IN implique la nécessité d'un changement de comportement de la population française quant à l'utilisation abusive des antibiotiques ; ce changement semble s'amorcer grâce aux campagnes nationales sur le sujet.
Premiers constats
Quelques points clés peuvent d'ores et déjà être évoqués (Wilcox MH, revue dans Hospital Medecine, 2004) :
o il existe en Europe, et particulièrement en France, un important réseau qui relie les établissements et qui permet de fournir de nombreuses données sur les IN et de suivre leur évolution ;
o entre 5 à 10% de patients acquièrent une IN au cours de leur hospitalisation ;
o un patient développant une IN à Staphylococcus aureus résistant à la méticilline (SARM) a un risque 2 fois plus élevé de mourir qu'un patient avec une infection à Staphylococcus aureus sensible à la méticilline (données cependant encore controversées).
Les IN virales
Beaucoup moins étudiées que les IN dues à des bactéries, les affections causées par des virus sont probablement très fréquentes. Elles n'ont pas de traitement spécifique, contrairement aux bactéries pour lesquelles nous disposons des antibiotiques, et sont le plus souvent bénignes. Les virus les plus fréquemment impliqués lors d'une IN sont les virus influenza et parainfluenza, qui provoquent une infection de type respiratoire (grippe par exemple) et les virus ayant pour cible le tractus digestif, les entérovirus comme les adénovirus, les rotavirus, etc. La transmission de la grippe entre personnels de santé et patients conduit à supposer que la vaccination des personnels de santé pourrait être utile (et pas seulement pour éviter cette transmission !) ; des recommandations américaines évoquent d'ailleurs la possibilité d'utiliser le nombre de personnels de santé vaccinés contre la grippe comme un indicateur de qualité.
Les IN virales sont particulièrement fréquentes en pédiatrie puisque selon Aho et al., elles peuvent atteindre 23% des IN dans les services de pédiatrie. Les rotavirus et le virus respiratoire syncitial (VRS) sont les plus fréquemment isolés, mais d'autres sont fréquents comme les influenza et parainfluenza, les rhinovirus, adénovirus, etc... Des mesures d'hygiène de mains, de vaccination, d'isolement permettent d'agir efficacement contre ce type d'IN.
Évolution de la définition des IN
La définition des IN a connu une évolution ces dernières années (cf. la dénomination du nouveau comité national, le CTINILS : comité technique national des infections nosocomiales et des infections liées aux soins), rejoignant celle des pays anglo-saxons, en élargissant le concept à l'ensemble des infections associées aux soins (IAS) qui englobent tout événement infectieux en rapport plus ou moins proche avec un processus, une démarche de soins, une structure de soins [non seulement les établissements de soins de tous types (centres de dialyse, dispensaires de soins, établissements d'hébergement pour personnes âgées dépendantes, etc.) mais aussi le domicile du patient (hospitalisation à domicile, services de soins à domicile, consultation à domicile), les cabinets ou laboratoires de ville...].
Cette nouvelle définition ouvrirait donc le champ dans l'espace et dans le temps des infections possiblement acquises puisque l'IAS couvre la dispensation des soins en continuum de l'établissement de santé aux soins extra-hospitaliers.
Par contre, l'IAS ne comprendra pas, comme par le passé, les colonisations asymptomatiques (infections urinaires sans symptôme, infections sur cathéter sans symptôme, etc.), ni, mais ceci était déjà acquis, les infections présentes ou en incubation lors du contact avec le système de santé et les infections foeto-maternelles. Certaines infections très précoces de réanimation (pneumopathies par inhalation respiratoire au moment du traumatisme par exemple) ne serons plus prises en compte, car non reliées à la qualité des soins.
Place des IN dans l'ensemble des accidents médicaux
Les infections nosocomiales constituent un problème sérieux de santé publique, mais ne représentent qu'une partie des accidents médicaux. La DREES (Ministère de la Santé) a mené une enquête nationale sur les événements indésirables graves liés aux soins (EIG) en 2004 dans 292 unités de 71 établissements de santé (Enquête ENEIS) 5 ( * ) .
Sur un échantillon de 35 000 journées d'hospitalisation (pour 8 754 patients), 450 EIG ont été identifiés : 195 événements sont à l'origine même du séjour à l'hôpital (dont les 2/3 sont générés suite à une prise en charge en médecine de ville, le reste étant consécutif à une hospitalisation antérieure), et 255 ont été identifiés pendant la période d'hospitalisation. Ces événements touchent surtout des patients fragiles, âgés, présentant souvent une situation clinique grave.
Dans la première catégorie, 41 événements (soit 19%) sont des infections liées aux soins, dont 10,6% sont des infections du site opératoire. 37% de ces infections ont été considérés comme évitables (16% seulement pour les infections du site opératoire).
Pour la catégorie des EIG identifiés au cours de l'hospitalisation, la densité d'incidence est estimée à 6,6 pour 1000 journées d'hospitalisation. 35% de ces événements ont été considérés comme évitables par les enquêteurs et des équipes de soins. Au sein de cet ensemble, les infections liées aux soins représentent 57 événements (24%), dont 13 sont des infections du site opératoire. 41% de ces infections sont apparues comme évitables (mais seulement 2% pour les infections du site opératoire).
Ces événements aboutissent en général à une prolongation de la durée d'hospitalisation, parfois en engageant le pronostic vital. Aucun décès directement lié à un événement indésirable n'a toutefois été observé pendant l'enquête.
Parmi les causes latentes des EIG, sont notés en particulier l'absence de protocoles, l'insuffisance d'échange d'informations entre les professionnels et le patient, l'importance de la charge de travail, l'inadaptation de la planification des tâches et les défauts de communication interne.
Ainsi, au sein de l'ensemble des événements graves liés aux soins, la proportion des infections liées aux soins est d'après cette enquête de 22%, dont 7,3% sont des infections du site opératoire. Environ 40% de ces infections étaient évitables selon les critères de l'enquête.
Ces chiffres permettent de replacer les infections liées aux soins dans le contexte plus large des accidents médicaux, et de souligner que d'autres problèmes de qualité de soins sont plus importants sur le plan quantitatif : les autres suites d'une intervention chirurgicale représentent 37,5% des EIG observés, et les accidents médicamenteux en représentent 27,5% (notamment suite à des soins de ville). Les infections liées aux soins (dont une partie seulement est d'origine nosocomiale) ne constituent que la troisième cause d'accidents médicaux.
De même, la Commission Nationale des Accidents Médicaux, dans son rapport 2004-2005, note que, au sein des saisines des commissions régionales de conciliation et d'indemnisation (CRCI), soit plus de 3 000 dossiers enregistrés et 655 propositions d'indemnisation, les infections nosocomiales ont représenté 31% du nombre de propositions d'indemnisation (le 1/3 de ces avis impliquant l'ONIAM).
Données épidémiologiques en France
Quelle est la prévalence de ces infections ?
« On estime que 5 - 6% des hospitalisations se compliquent d'une IN. Comme il y a 15 millions d'hospitalisations par an, il y aurait environ 750 000 IN/an » déclarait Pr. Bernard Regnier dans `Pour la Science', en avril 2005.
La deuxième enquête de prévalence nationale coordonnée par RAISIN (Réseau d'Alerte, d'Investigation et de surveillance des Infections Nosocomiales) en 2001 a été réalisée à partir des données transmises sur la base du volontariat, par 1 533 établissements privés et publics un jour donné.
Une enquête similaire avait été effectuée en 1996 et avaient englobé 830 établissements. Ainsi l'évolution des données a pu être étudiée. Les résultats de cette importante étude montrent, outre la forte motivation des établissements de soins français, les points suivants :
1. La prévalence des patients infectés était de 6,9% en 2001 (dont 1% par acquisition de l'IN dans un autre établissement), et la prévalence des infections de 7,5% (certains patients ayant contracté deux IN, voire plus).
2. En termes de localisation, on observe en majorité des infections urinaires (40% des IN), des infections de la peau ou des tissus mous (11%) (surtout présentes dans les services de long séjour ou en psychiatrie), des pneumopathies (en réanimation surtout) (10%) et infections respiratoires hautes (9%), des infections du site opératoire (10% des IN). Les bactériémies représentent 4% du total, et les infections sur cathéter 3%. En termes de prévalence, 3% des patients présents à l'hôpital lors de l'étude avaient une infection urinaire et 2,7% des patients opérés avaient une IN du site opératoire ; la prévalence des autres types d'IN était inférieure à 1%.
3. Les pathogènes trouvés étaient Escherischia coli (dans les infections urinaires), Staphylococcus aureus (infections respiratoires et du site opératoire) et Pseudomonas aeruginosa (infections respiratoires) ; ces germes à eux trois représentaient plus de la moitié des germes isolés. La fréquence des résistances des germes isolés à certains antibiotiques était particulièrement élevée : 64% des Staphylococcus aureus étaient résistants à la méticilline. Lors de l'enquête en 1996, cette fréquence était de 57% ! Cette résistance était particulièrement élevée dans les services de long séjour et SSR. La résistance aux antibiotiques (céphalosporines de 3 ème génération) des Pseudomonas aeruginosa se retrouvait dans 17% des prélèvements.
4. La survenue d'IN est souvent liée à la pratique de soins invasifs : infections urinaires (13 fois plus fréquentes chez les patients sondés, 2 fois plus fréquentes chez les patients ayant un cathéter) ; de plus, chez ces patients sondés ou cathétérisés, la fréquence des IN (autres qu'urinaires) augmente. Bien sûr, la présence d'une immunodépression, un âge élevé, une pathologie menaçant le pronostic vital sont des facteurs de risque.
5. Lors de l'enquête, un patient hospitalisé sur 6 recevait un antibiotique ; la large utilisation de certains antibiotiques (fluoroquinolones) fait craindre le développement encore accru de résistances.
6. De nombreuses différences ont été notées entre établissements privés et établissement publics mais du fait des recrutements différents des patients et des activités de soins différentes, ces différences sont a priori d'interprétation difficile.
7. La comparaison des résultats de l'enquête menée en 2001 par rapport à celle de 1996 montre qu'il y aurait une baisse de la prévalence des IN parmi les patients hospitalisés dans les CHU (de 8,3% à 7,2% hors infections urinaires) et les CH (de 6,5% à 5%). Il s'agit d'une tendance à confirmer au cours d'autres enquêtes.
8. Des données 2003 indiquent que les bactériémies nosocomiales présentent un taux d'incidence de 0,4 pour 1000 journées d'hospitalisation, le taux le plus élevé étant observé en réanimation (2,75). Les portes d'entrée sont avant tout les cathéters et infections urinaires. Le patient décède dans 12,6% des cas.
IN en réanimation
Plus proche de nous, une enquête RAISIN portant sur les services de réanimation vient d'être publiée. 133 services de réanimation en France y ont participé du 1 er janvier au 30 juin 2004.
L'étude a recueilli des données concernant 16 566 patients hospitalisés plus de 2 jours en réanimation.
Les caractéristiques des patients étaient :
o Age moyen de 62 ans, ratio H/F = 1,64 ;
o Facteurs de risque : 48% de patients bénéficiaient d'un traitement antibiotique, 10% étaient des patients traumatologiques, 13% étaient immunodéprimés ;
o 14,9% des patients ont bénéficié d'une ventilation non invasive, plus de la moitié d'une intubation/trachéotomie (parmi les intubés, certains ont subi une ré-intubation, ce qui accroît le risque d'IN). Presque 80% des patients étaient porteurs d'une sonde à demeure.
Parmi les 16 566 patients, 2 335 soit 14,1% ont présenté au moins un site de surveillance infecté, totalisant 3 710 infections/colonisations. Les pneumopathies sont les plus fréquemment observées (44,6%), suivies des infections urinaires (21,3%), des colonisations de cathéters veineux centraux (CVC) et des bactériémies (16,2%). Les délais d'apparition sont de 8 jours pour les pneumopathies et 10 jours pour les bactériémies, 11 jours pour les infections urinaires et 12 jours pour les colonisations de CVC.
Les agents pathogènes isolés sont, pour les plus fréquents, le Staphylococcus aureus, souvent résistant (48,7% des souches), Enterococcus dont 22% sont résistants à l'ampicilline, les entérobactéries dont presque 18% sont résistantes aux céphalosporines de 3 ème génération.
Les facteurs de risque les plus fréquemment trouvés étaient :
o Pour les pneumopathies, outre l'existence d'une intubation/trachéotomie : la durée d'intubation, le sexe masculin, patient venant de service de médecine
o Pour les infections urinaires, outre la sonde à demeure : la durée de sondage, le sexe féminin, patiente venant de service de médecine
o Pour les colonisations de CVC : la durée du cathétérisme
Un certain nombre de facteurs de risque liés aux caractéristiques du patient sont peu accessibles à la prévention ou à la thérapeutique. Par contre, le facteur de risque majeur qu'est l'exposition du patient au dispositif invasif peut se moduler par l'optimisation des pratiques de soins, en réduisant par exemple les indications de dispositifs invasifs.
De plus, l'étude révèle que les caractéristiques des services de réanimation sont très hétérogènes ainsi que leurs taux d'incidence d'IN.
Le réseau REA-RAISIN poursuit ses travaux.
IN du site opératoire
Les résultats de l'enquête annuelle d'incidence des infections du site opératoire (ISO) pour les années 2001, 2002 et 2003 sont disponibles sur le site de l'Institut national de veille sanitaire (INVS). Depuis 1993 les 5 centres de coordination de la lutte contre les IN (C-CLIN) ont progressivement mis en place des réseaux de surveillance des infections du site opératoire (ISO).
Dans le cadre du RAISIN, les 5 C-CLIN ont défini en 1999 une méthode nationale de surveillance des ISO.
En 2003, 107 576 interventions chirurgicales ont été inclues dans l'étude, 1616 (1,5%) ont été suivies d'une ISO ; 44,3% étaient recensées à la sortie de l'hôpital. Le délai médian de survenue des ISO était de 10 jours pour les infections superficielles ou profondes de la cicatrice et 9 jours pour les infections touchant le site ou l'organe siège de l'intervention (exemple, ostéite sur ostéosynthèse).
Globalement, 40,3% des ISO étaient des infections de localisation profonde (incision ou organe/site opéré).
L'incidence des ISO était de 0,62% pour les interventions classées NNIS-0 (`intervention sans risque') sur des patients n'ayant aucun facteur de risque.
La France dispose ainsi de l'un des plus gros réseaux de surveillance de l'infection du site opératoire, et peut comparer ses taux à ceux des autres pays européens (voir plus loin).
IN de type bactériémie
Les derniers résultats en 2004 du CCLIN Sud-Ouest (Centre de Coordination de Lutte Contre les IN, réunissant les régions Aquitaine, Midi-Pyrénées, Poitou-Charentes et La Martinique) ont porté sur l'analyse des bactériémies. Cette analyse s'est faite grâce à la collaboration de 64 laboratoires issus de 62 établissements (CHU, CH, PSPH, Etablissements privés).
La bactériémie est une infection grave dont la mortalité est élevée. 2 601 épisodes ont été analysés sur 2 592 patients. L'origine des bactériémies était soit communautaire (44%), soit nosocomiale (40%).
Les caractéristiques des bactériémies d'origine nosocomiale acquises dans les établissements étudiés, sont données dans ce tableau :
|
Acquise (%) |
Délai médian d'acquisition (jours) |
Porte d'entrée |
Bactéries en cause |
|
|
Médecine |
40,5 |
13 |
Urinaire puis digestif/abdominal |
S. aureus puis E. coli |
|
Chirurgie (adulte & enfants) |
21,8 |
10 |
Urinaire puis digestif/abdominal |
S. aureus puis E. coli |
|
Réanimation adulte |
19,6 |
9 |
Pulmonaire puis cathéter central et digestif/abdominal |
Cocci + (S. aureus et coagulase nég.) |
Il faut noter que pour les bactériémies d'origine communautaire, les mêmes portes d'entrée étaient retrouvées, avec en plus pour les bactériémies d'origine nosocomiale, le cathéter central. En ce qui concerne les bactéries en cause, les mêmes types de bactéries étaient retrouvés (S. aureus, entérobactéries) avec une fréquence plus importante du streptocoque pneumoniae pour les bactériémies d'origine communautaire.
Les sensibilités aux antibiotiques des bactéries avaient les caractéristiques suivantes :
o pour le S. aureus : 20% résistants à la méticilline et sensibles à la gentamycine ; sensibilité à la méticilline plus importante qu'en 2002 (52,6% seulement en 2002, contre 69% en 2004 pour les bactériémies nosocomiales)
o pour les entérocoques : bonne sensibilité à l'ampicilline (environ 10% de résistance)
o pour Escherischia coli (E. coli) : environ 47% résistants à l'ampicilline mais sensibles à la céfotaxime.
Ces études épidémiologiques sont particulièrement nombreuses sur le territoire et se poursuivent à l'heure actuelle.
Citons notamment la troisième enquête nationale de prévalence (ENP) 2006 des IN, coordonnée au niveau national par l'InVS et proposée par le RAISIN via les 5 CCLIN.
L'enquête se déroulera du lundi 29 mai 2006 au 30 juin 2006 inclus, dans les établissements de santé français (privé, public, PSPH comprenant les établissements de soins de suite, les unités de soins de longue durée et les établissements de court séjour) sauf les maisons de retraite des hôpitaux, les lits d'hospitalisation de nuit des CHS, les services d'HAD et d'HDJ. Les résultats seront analysés, comparés avec ceux obtenus en 2001 et publiés courant 2007.
De même, une enquête de prévalence a été réalisée il y a quelques mois dans les EHPAD (maisons de retraite) (enquête PRIAM), dans un département (Val de Marne). Une enquête nationale est prévue prochainement.
Données épidémiologiques en Europe
Les données européennes sont regroupées dans le projet HELICS (Hospital In Europe Link for Infection Control through Surveillance) dont les travaux furent prolongés en 2005 au sein du projet IPSE (Improving Patient Safety in Europe).
Le projet publié en mars 2005 avait pour but de collecter les données pour ensuite diminuer le nombre d'IN dans les hôpitaux européens.
Deux types d'études ont été réalisés : une au sein des unités de soins intensifs (USI) et l'autre sur l'exposition aux IN du site opératoire (ISO, infection du site opératoire).
etude statistique portant sur les in dans les usi de 2000 a 2004 dans huit pays
o Champ : 437 081 patients hospitalisés en USI (659 USI) de 8 pays.
o Trois types d'IN sont relevés : pneumonie, septicémie et infection urinaire
o Les pays sont désignés par les abréviations suivantes :
o Autriche (AT), Belgique (BE), Allemagne (DE), Espagne (ES), France (FR),
o Luxembourg (LU), Hollande (NL), Portugal (PT)
Pneumonie acquise lors d'un séjour en USI
Le pourcentage des patients qui ont acquis au moins une pneumonie au cours de leur séjour dans une USI varie de 1% en Allemagne à 15,5% au Portugal. Ces chiffres sont à prendre avec une certaine précaution puisque, par exemple en Allemagne, les patients ayant séjourné moins de 2 jours en USI ont été inclus, contrairement aux autres pays. En excluant l'Allemagne, le pourcentage global de patients ayant une pneumonie acquise en USI est de 6,8%.
|
Pays |
% pneumonie |
Densité incidence pneumonie / 1000 patients-jours pour patients intubés > 60% |
Densité incidence pneumonie / 1000 patients-jours pour patients intubés <30% |
Nombre médian de jours avant survenue de PN |
Bactérie la plus fréquente |
|
AT |
8,0 |
16,2 |
3,7 |
10 |
Pa |
|
BE |
5,6 |
11,5 |
5,3 |
6 |
Pa |
|
DE |
1,0 |
3,6 |
1,8 |
8 |
Sa |
|
ES |
6,1 |
10,1 |
5,3 |
8 |
Sa/pa |
|
FR |
9,2 |
9,5 |
3,8 |
11 |
Pa/sa |
|
LU |
4,0 |
3,1 |
7 |
Sa |
|
|
NL |
12,3 |
14,2 |
15,8 |
8 |
Pa |
|
PT |
15,5 |
12,3 |
9 |
pa |
Ce pourcentage est comme attendu corrélé avec le pourcentage de patients intubés et avec la durée de séjour des patients.
La densité d'incidence est calculée en ajustant les deux facteurs, durée de séjour et intubation (nombre d'épisodes de pneumonie par 1000 patients-jours) :
o pour les patients ayant subi une intubation (dans le tableau, pour les patients ayant subi le plus fréquemment une intubation, > 60%) ;
o et pour les patients n'ayant pas ou peu subi d'intubation (<30%).
La pneumonie survenait de 6 jours d'hospitalisation en USI en Belgique à 11 jours en France. Ces résultats indiqueraient que, soit la pneumonie survient plus tôt en Belgique ce qui serait un indicateur de faible qualité, soit la surveillance en Belgique est plus effective, ce qui semble être le plus probable.
Ces premiers résultats montrent combien il est important de faire attention aux différences intrinsèques entre pays malgré les harmonisations de méthodes et de définitions.
Les micro-organismes impliqués dans la pneumonie sont, pour les plus fréquemment retrouvés, le Staphylococcus aureus (sa) et Pseudomonas aeruginosa (pa) avec de grandes variations entre pays. Le Candida albicans est fréquemment trouvé également, mais est le plus souvent un simple colonisant.
Bactériémie acquise lors d'un séjour en USI
Le pourcentage des patients qui ont acquis au moins une bactériémie au cours de leur séjour dans une USI varie de 0,4% en Allemagne à 6,9% au Portugal. En excluant l'Allemagne pour la raison déjà énoncée, le pourcentage global de patients ayant une pneumonie acquise en USI est de 3,1%.
|
Pays |
% bactériémie |
Densité incidence bactériémie / 1000 patient-jours pour patients intubés > 60% |
Densité incidence bactériémie / 1000 patient-jours pour patients intubés <30% |
Nombre médian de jours avant survenue IN |
|
AT |
2,2 |
1,5 |
2,8 |
9,5 |
|
BE |
2,0 |
3,5 |
2,2 |
11 |
|
DE |
0,4 |
2,0 |
0,6 |
14 |
|
ES |
3,9 |
7,2 |
3,6 |
13 |
|
FR |
4,0 |
4,3 |
4,2 |
13 |
|
LU |
4,3 |
3,3 |
13 |
|
|
NL |
6,4 |
8,2 |
3 |
10 |
|
PT |
6,9 |
5,4 |
19 |
Ce pourcentage est comme attendu corrélé avec le pourcentage de patients intubés et avec la durée de séjour des patients, de même qu'avec la durée du cathétérisme veineux.
La bactériémie survenait après 13 jours d'hospitalisation en USI en moyenne ; cette durée de survenue est donc supérieure à celle observée pour une pneumonie. Cette durée variait de 9,5 jours en Autriche à 19 jours au Portugal. De nouveau, ces résultats indiqueraient que soit la bactériémie survient plus tôt en Autriche, ce qui serait un indicateur de faible qualité, soit la surveillance y est plus effective.
Le micro-organisme impliqué dans la bactériémie est pour le plus fréquemment retrouvé, un staphylocoque coagulase-négatif, pour tous les pays (excepté pour le Luxembourg où une entérobactérie est très fréquemment retrouvée). Ce germe est en effet fréquemment retrouvé dans les infections liées à la présence d'un cathéter.
Infection urinaire acquise lors d'un séjour en USI
Le pourcentage des patients qui ont acquis au moins une infection urinaire (IU) au cours de leur séjour dans une USI a été mesuré dans 6 pays ; ce chiffre est de 4,9%. Les pourcentages des pays doivent être interprétés avec précaution dans la mesure où la définition, la détection des infections urinaires varient d'un pays à l'autre...
|
Pays |
% infection urinaire (IU) |
Densité incidence IU / 1000 patients-jour pour patients intubés > 60% |
Densité incidence IU / 1000 patients-jour pour patients intubés <30% |
Nombre médian de jours avant survenue de IU |
|
AT |
2,3 |
1,7 |
2,2 |
11 |
|
DE |
0,6 |
3 |
0,8 |
15 |
|
ES |
3,1 |
6 |
2,3 |
11 |
|
FR |
6,8 |
7 |
6,6 |
15 |
|
LU |
8,3 |
7,2 |
12 |
|
|
NL |
6,7 |
7,2 |
2,8 |
11 |
Ce pourcentage est comme attendu corrélé avec le pourcentage de patients intubés, avec la durée de séjour des patients, et avec la durée de pose de la sonde urinaire.
L'infection urinaire survenait après 11 jours d'hospitalisation en USI en Autriche, Espagne et Hollande ou après 15 jours en France, en Allemagne, avec une moyenne de 14 jours. Dans 96,2% des infections, un cathéter urinaire était présent dans les 48 heures ayant précédé l'infection.
Les micro-organismes impliqués dans l'infection urinaire sont, pour les plus fréquemment retrouvés, Escherichia coli, suivi d'enterococcus, de candida et de Pseudomonas aeruginosa.
Les données sur les résistances aux antibiotiques
Les données recueillies sur 6 pays ont montré que le Staphylococcus aureus résistant aux antibiotiques (oxacilline/meticilline) est plus fréquemment détecté lors des bactériémies que lors des pneumonies acquises lors d'un séjour en USI.
|
Pays |
% résistance de s. aureus à la méticilline |
|
AT |
44,2 |
|
BE |
38,1 |
|
DE |
29,2 |
|
ES |
36,0 |
|
FR |
39,3 |
|
PT |
73 |
En ce qui concerne l'utilisation des antibiotiques, un total de 164 491 jours d'antibiotique pour 11 650 patients a été enregistré. La prophylaxie antibiotique représente 15%, le traitement empirique 53,3% et la thérapie spécifique 31,7%. Pour cette dernière, des disparités entre pays ont été notées : 39,9% en Espagne, 20,5% en Belgique et 20,4% au Portugal.
Commentaires sur les données statistiques
Les données statistiques portant sur les patients changent quelque peu la vision des données. Si on tient compte du type de patient admis en USI, la hiérarchie des pays peut changer puisque les case-mix de chaque pays ne sont pas les mêmes (d'après des critères comme : durée moyenne du séjour en USI, mortalité en USI, moyenne du score de sévérité, facteurs de risque).
Des analyses préliminaires ont été réalisées afin de mieux cerner tous les facteurs de risque. Lors de ces premières analyses dans les pays participants, au nombre de 7 (Belgique, Allemagne, Finlande, Hongrie, Pologne, Slovénie et Espagne), il a été remarqué l'existence de grandes variations concernant les processus de qualité dont certains ont un impact dans la détection des IN (comme la fréquence des hémocultures) et les mesures de contrôle de l'infection (l'isolation en chambre à un lit de patients porteurs de Staphylococcus aureus multi-résistant).
etude statistique portant sur les iso de 2000 a 2003 dans dix pays
De nombreuses études statistiques (outre celle présentée ci-dessous) réalisées en Europe et aux USA ont donné la fréquence des IN selon la catégorie des interventions chirurgicales 6 ( * ) .
En bref, les IN les plus fréquentes sont les ISO après amputation de la jambe (14% selon NNIS, National Nosocomial Infection Surveillance) et les interventions chirurgicales sur l'intestin (10% environ), toutes deux ayant comme porte d'entrée une incision superficielle (dans environ 60% des cas) ; mais les plus forts taux de mortalité liée à une IN sont observés à la suite des interventions pour prothèse de hanche et interventions vasculaires (risque de mortalité multiplié par 3 par rapport à ce même type d'intervention sans ISO). Comme pour toutes IN, une ISO implique un prolongement du séjour hospitalier (le maximum étant de 21 jours pour une ISO après amputation de jambe).
Une ISO augmente avec certains facteurs de risque (définis par l'American National Nosocomial Infection, facteurs de risque qui sont : score de morbidité pré-opératoire défini par la société des anesthésistes américains, classe de contamination (classification d'Altemeier), durée de l'intervention).
D'une manière générale, dans les interventions en orthopédie, les ISO impliquent une 2 ème hospitalisation, un coût 4 fois plus élevé que celui d'une intervention orthopédique sans ISO, et des conséquences sur la qualité de vie, essentiellement de type réduction de l'activité physique. Peu, voire pas d'études ont été réalisées pour analyser ces conséquences.
Les facteurs de risque ont également été étudiés ; par exemple lors des ISO avec Staphylococcus aureus, les patients de plus de 70 ans avaient, après ISO, une mortalité 4 fois plus élevée (22%).
De plus, ces patients âgés prolongeaient davantage leur séjour hospitalier que les patients moins âgés et ayant également acquis une ISO. Outre l'âge, les comorbidités (diabète, hypertension artérielle, insuffisance rénale) constituent un autre facteur de risque.
Les Résultats Helics (rapport statistique 2000 - 2003)
Champ : 171 927 interventions chirurgicales (600 hôpitaux) dans 10 pays.
Les pays sont désignés par les abréviations suivantes :
o Belgique (BE), Allemagne (DE), Espagne (ES), France (FR), Grèce (GR), Hollande (NL), Lituanie (LT), Finlande(FI), Pologne (PL), Grande Bretagne (Angleterre UK-EN, Nord Irlande UK-NI, Ecosse UK-SC, Pays de Galles UK-WA).
Les interventions chirurgicales étudiées sont :
o Pontage coronaire (Pont. Coro.)
o Cholécystectomie (Chol.)
o Intervention chirurgicale sur colon (Colon)
o Césarienne (César.)
o Arthroplastie de la hanche (Hanche)
o Laminectomie (Lamin.)
Caractéristiques des ISO
Les ISO sont classées en 3 catégories selon leur localisation :
o incision superficielle
o incision profonde
o organe/site opéré
Dans toutes les catégories d'interventions, la France détient la plus basse proportion d'infection sur incision superficielle, et la Hollande n'a aucune infection sur organe/site opéré. Ces larges différences entre pays peuvent toutefois être dues à des interprétations différentes entre les pays et des disparités de recueil.
Peu de pays ont des informations sur les micro-organismes responsables de l'ISO. La distribution des micro-organismes qui a pu être établie provient des informations données par la Belgique, l'Allemagne (en 2001), la Pologne et l'Angleterre.
La distribution des micro-organismes les plus fréquemment retrouvés est présentée dans le tableau suivant :
|
% |
Pont. coro. |
Chol. |
Colon |
César. |
Hanche |
Total |
|
Staph. aureus |
43,7 |
11,7 |
7,7 |
28,9 |
48,6 |
30,4 |
|
Coagulase-négative staph. |
34,9 |
10,8 |
7,1 |
15,8 |
12,7 |
13,9 |
|
Gram -, entérobactéries |
15,1 |
46,7 |
53,9 |
13,2 |
9,4 |
36,9 |
|
Gram -, non entérobactéries |
2,4 |
8,3 |
10,1 |
4,4 |
8,7 |
7,9 |
Incidence de l'infection
Deux indicateurs sont analysés :
o Le pourcentage des interventions chirurgicales avec ISO, appelé `incidence cumulative' (ISO détectée dans les 30 jours après intervention). Ces pourcentages sont présentés dans le premier tableau ci-dessous.
o Le nombre d'ISO par 1 000 jours post-intervention dans l'hôpital, appelé `densité d'incidence' (deuxième tableau ci-dessous).
L'incidence cumulative :
|
Pays |
Pont. coro |
Chol |
Colon |
Cesar. |
Hanche |
Lamin. |
|
BE |
1,8 |
5,9 |
1,9 |
0,8 |
||
|
DE |
2,7 |
1,4 |
6,4 |
1,6 |
||
|
ES |
6 |
4,8 |
21,6 |
5,5 |
3,1 |
1,8 |
|
FI |
4 |
|||||
|
FR |
4,0 |
1,1 |
7,3 |
2,1 |
1,3 |
|
|
GR |
7,2 |
|||||
|
LT |
1,7 |
22 |
3,8 |
0,5 |
||
|
NL |
2,1 |
1 |
8,6 |
1 |
3,2 |
0,6 |
|
PL |
1,9 |
1,3 |
5,2 |
1,9 |
||
|
UK-EN |
2,9 |
8,6 |
2,8 |
|||
|
UK-NI |
0,9 |
|||||
|
UK-SC |
9,8 |
2 |
||||
|
UK-WA |
3 |
|||||
|
Total |
2,7 |
1,4 |
8,1 |
2,1 |
2,7 |
0,8 |
La densité d'incidence :
|
Pays |
Pont. coro |
Chol |
Colon |
Cesar. |
Hanche |
Lamin. |
|
BE |
1,4 |
3,9 |
0,7 |
0,6 |
||
|
DE |
||||||
|
ES |
4,7 |
6,3 |
17,3 |
7,1 |
2,4 |
2,3 |
|
FI |
2,5 |
|||||
|
FR |
1 |
4,6 |
2 |
0,5 |
||
|
GR |
7,9 |
|||||
|
LT |
2,6 |
16,9 |
5,4 |
0,4 |
||
|
NL |
0,9 |
1,8 |
5,8 |
0,7 |
1,9 |
0 |
|
PL |
||||||
|
UK-EN |
3 |
2 |
||||
|
UK-NI |
0,5 |
|||||
|
UK-SC |
4,2 |
1,9 |
||||
|
UK-WA |
1,8 |
|||||
|
Total |
2,8 |
2,9 |
7,3 |
3,8 |
1,8 |
0,6 |
La densité d'incidence n'englobe que les pays où sont inclus au moins 1 000 jours d'hospitalisation en post-intervention.
De nombreuses difficultés surviennent pour obtenir un chiffre précis puisque dans chaque pays, le diagnostic et la sortie de l'hôpital du patient relèvent d'habitudes différentes ; de plus, le nombre d'observation peut être bas. Toutes ces considérations doivent être prises en compte pour l'interprétation des résultats.
Il est cependant clair qu'il existe des différences significatives entre ISO selon le type d'intervention chirurgicale. Ainsi les interventions sur colon ont le plus fort taux d'ISO, ce qui est parfaitement logique.
En outre, l'incidence d'ISO est liée à l'indice du risque NNIS (indice synthétique basé sur trois niveaux de risque : 0, 1 et 2/3). Par exemple, pour les interventions sur le colon, entre le risque 0 (bon état physique du patient) et le risque 2/3, l'incidence cumulative d'ISO passe de 5 à 11% (même type de progression pour la densité d'incidence).
Le délai de survenue de l'ISO :
o Les mesures des incidences ont montré que le pic d'ISO survient entre les 6ème et 10ème jour après l'intervention chirurgicale. Ce pic est suivi par un déclin rapide. Après 3 semaines, l'incidence devient très basse. Cela est vrai quelque soit le type des interventions chirurgicales et se confirme quand on analyse les incidences en fonction du temps pays par pays.
Interprétation des résultats de l'étude
Entre pays, il existe quelques différences de caractéristiques des patients subissant les interventions chirurgicales étudiées (en termes de sexe et d'âge). Il existe également une différence dans la durée d'hospitalisation entre pays mais la plus grande différence se trouve dans le niveau de surveillance de la survenue d'une ISO, puisqu'il n'y a aucune surveillance à la sortie du patient de l'hôpital dans certains pays. Ce dernier point a évidemment une grande importance pour l'interprétation de ces résultats.
De plus, le type de patient par indice de risque varie d'un pays à l'autre ; par exemple l'Allemagne a des patients ayant des indices de haut risque pour les interventions sur le colon...
Enfin, la densité d'incidence est considérée comme le meilleur indicateur pour comparer les pays entre eux puisqu'il y a alors une unité de temps (1 000 jours après intervention). Mais malheureusement, il ne fut pas possible de le calculer pour certains pays, et n'inclut pas l'infection détectée après la sortie.
La résistance bactérienne aux antibiotiques
« Les bactéries sont dites multirésistantes aux antibiotiques lorsque du fait de l'accumulation de résistances acquises à plusieurs familles d'antibiotiques, elles ne sont plus sensibles qu'à un petit nombre d'antibiotiques utilisables en thérapeutique (résistance à plus de trois familles différentes).
La multirésistance est ainsi une étape vers l'impasse thérapeutique. Elle concerne les bactéries des infections communautaires (ex : pneumocoque, bacilles de la tuberculose) et les bactéries des IN. » Cette phrase est tirée du rapport RAISIN paru en janvier 2006 sur lequel nous revenons dans les lignes suivantes.
Ce problème, qui émerge depuis plusieurs années, fait maintenant pleinement partie du « dossier IN », et cela que les observations aient lieu en France ou en Europe, aux Etats Unis ou au Canada... C'est un des sujets les plus préoccupants en médecine actuellement puisque la résistance des bactéries aux antibiotiques s'est développée très rapidement (ces dernières décennies) de par le monde et qu'aucune classe nouvelle d'antibiotique n'est attendue dans les prochaines années.
Ce problème ne touche pas seulement les bactéries responsables des IN. La propagation des souches bactériennes résistantes aux antibiotiques est un problème plus vaste qui touche toutes les infections et constitue une menace de santé publique pour les années à venir. Prenons un exemple issu d'une publication récente sur la résistance du pneumocoque aux antibiotiques.
La pathologie liée à Streptococcus pneumoniae est très variée et fréquente (en Europe, environ 800 cas pour 100 000 habitants). 22 observatoires qui représentent 403 laboratoires ont permis au cours de l'année 2003 d'étudier la sensibilité aux antibiotiques du pneumocoque.
Le pneumocoque est résistant à la pénicilline G (à 62% sur les souches prélevées chez les enfants et 43% chez l'adulte), à l'amoxicilline (36% chez l'enfant), à la céfotaxime (24% chez l'enfant) et à l'érythromycine (54%... et même 89% pour les souches résistantes à la pénicilline G). Les taux de résistance sont plus faibles pour les tétracyclines (31%) et le cotrimoxazole (36%). 17% des souches étaient résistantes au chloramphénicol. Les pourcentages de résistance sont plus élevés chez l'enfant que chez l'adulte.
La comparaison de ces résultats avec ceux des années précédentes montre une baisse de la résistance des pneumocoques à la pénicilline G : 55,4% en 2001, 50% en 2003, surtout chez l'enfant. Le taux de résistance étudiée par région montre que la plus forte baisse de résistance, en Poitou-Charente, a eu lieu là où la résistance était la plus forte en 2001.
La France est le pays en Europe qui détient le triste record des taux de résistance aux antibiotiques (selon Gilles Brücker, dans le BEH, 2006, n°1) : ce taux de résistance à la pénicilline de 50% observé pour le pneumocoque (même s'il est en progrès par rapport à 2001) en est le témoin, devançant nettement la Roumanie, 2 ème pays touché, qui présente un taux de 36,3%.
Bien évidemment, les bactéries responsables des IN sont de même parfois résistantes aux antibiotiques, ce qui en redouble la gravité. L'INVS a mis au point un système d'alerte efficace. Ce système met en relation les établissements qui alertent l'INVS quand une épidémie ou une infection résistante surviennent ; RAISIN produit alors des recommandations s'il y a lieu. Deux exemples récents peuvent être cités :
o entérocoque résistant à la vancomycine (alerte en juillet 2005)
o acinetobacter baumannii multi-résistant aux antibiotiques, signalé dans 54 établissements répartis dans 15 départements (recommandations juin 2004)
Le RAISIN (Réseau d'Alerte, d'Investigation et de Surveillance des IN) vient par ailleurs de rendre disponible en janvier 2006 un rapport sur la résistance aux antibiotiques, regroupant les analyses des CCLIN Est, Ouest, Paris-Nord, Sud-Ouest, Sud-Est et de l'INVS sur l'année 2002. Un protocole national permet aux 5 CCLIN de générer des données portant sur deux types de bactéries multirésistantes : Staphylococcus aureus résistant à la méticilline (SARM) et les entérobactéries productrices de ?-lactamases à spectre étendu (EBLSE).
Les bactéries multi-résistantes ont une place particulièrement importante dans les IN en France.
Les souches SARM sont les bactéries multi-résistantes les plus fréquemment retrouvées (environ 13% de l'ensemble des bactéries des IN), suivies par les entérobactéries résistantes au céfotaxime (environ 5%). Les autres bactéries résistantes aux antibiotiques sont pseudomonas aeruginosa résistant à la ticarcilline (4% des bactéries des IN), les entérocoques résistants à l'ampicilline ou aux glycopeptides (moins de 1% des bactéries des IN).
En 2002, 478 établissements de soins ont participé à la surveillance (soit près de 170 000 lits, 1/3 du total des lits en France). La densité d'incidence pour 1000 journées d'hospitalisation (indicateur retenu le plus fiable) était de 0,63 pour les SARM et 0,13 pour les EBLSE, soit 5 fois moins élevée que celle des SARM.
Les cas de SARM étaient repérés en médecine pour 40% des cas, en chirurgie pour 20%, en réanimation pour 10%, en SSR-SLD pour 24%. Les SARM étaient retrouvés dans les urines (20%), les prélèvements respiratoires (17%), dans les hémocultures (7%) et les séreuses et prélèvements de pus profond (8%).
La densité d'incidence pour les EBLSE avait une distribution plus élargie d'une inter-région à une autre que les SARM. Il y a un facteur de 4 à 5 entre les incidences les plus basses (Ouest, Est) et les incidences les plus élevées (Paris-Nord, Sud-Est). Les services concernés par les EBLSE l'étaient dans les proportions similaires à celles observées pour les SARM. Les EBLSE étaient détectées surtout dans les urines (60% des cas) puis dans les prélèvements respiratoires (14%), dans les hémocultures (5%), séreuses et pus profond (5%).
Par extrapolation, le nombre de SARM isolés dans les prélèvements à visée diagnostique peut être estimé à environ 63 000 par an en France en 2002, dont 4 500 bactériémies. Le nombre de cas annuels de EBLSE serait d'environ 13 000 cas / an (dont 650 bactériémies). Le nombre total de cas SARM et EBLSE, pris ensemble, doit être de l'ordre de 76 000 par an pour les hôpitaux publics et PSPH.
L'évolution des chiffres obtenus permet, selon l'ensemble des résultats disponibles, de montrer que les taux de SARM sont élevés en France mais ont peu augmenté depuis le début des années 1990 (par contraste avec l'augmentation qui s'était produite durant les années 1980), alors qu'ils ont beaucoup augmenté dans quelques pays voisins comme la Grande-Bretagne selon les résultats de l'EARSS (réseau européen de surveillance de la résistance bactérienne aux antibiotiques). L'EARSS, qui compare les pays européens sur la résistance aux antibiotiques, plaçait la France en 2002 au 1 er rang des pays porteurs de résistance pour le S. pneumoniae à la pénicilline G (sur 26 pays) et au deuxième pour la résistance aux macrolides, avec plus de 50% de résistance dans les deux cas, au 6 ème pour E. coli résistant à l'ampicilline (avec 52% de résistance), au 10 ème pour S. aureus résistant à la méticilline. Les données provenaient de 296 laboratoires hospitaliers pour S. pneumoniae (sur 418 laboratoires hospitaliers en France) et de 21 laboratoires (13 CHU et 8 CHG) pour les autres bactéries.
Les derniers résultats de 2004 de l'EARSS montrent une nette diminution du taux de SARM en France (28% en 2004 contre 33% en 2002) alors que les autres pays européens ont vu leur taux globalement augmenter. Mais il faut souligner le fait que la France se situe dans le groupe de tête pour le taux de SARM avec l'Espagne, l'Italie, la Suisse, le Royaume Uni (groupe avec 25-50% de SARM). Pour la résistance aux antibiotiques des Enterococcus faecalis, la France est dans le deuxième groupe européen (taux de 10 à 25% de résistance) avec peu d'évolution en 2004.
Pour la résistance d'Escherischia coli aux céphalosporines de 3 ème génération, la France se situe dans le groupe où le taux de résistance est le plus faible (<1%) ; le taux de résistance d'Escherischia coli aux autres antibiotiques est également faible par rapport aux autres pays européens étudiés.
Ces résultats encourageants corroborent ceux enregistrés par exemple à l'AP-HP où le pourcentage de SARM a diminué de ¼ en court séjour et de moitié en réanimation entre 1993 et 2002 (passant de 55% à 24%). Une tendance à la baisse du pourcentage de SARM en réanimation durant les 4 dernières années a été aussi enregistrée dans les CCLIN Paris-Nord et Sud-Ouest.
Ces résultats qui vont dans le bon sens semblent être le fruit d'une mise en place d'un programme spécifique de prévention de la transmission croisée des bactéries multi-résistantes, et d'un meilleur usage des antibiotiques.
Mais la vigilance demeure de mise et des progrès restent à faire. Par exemple, la proportion des souches EBLSE a diminué depuis 1993 (diminution régulière dans le temps) mais, en revanche, la résistance de ces bactéries a gagné l'espèce E. coli, espèce commensale majeure, ce qui fait craindre une diffusion dans la communauté. Elle a gagné aussi l'espèce E. aerogenes.
Une étude préliminaire européenne pilotée par Helics (publication mars 2005) sur l'amélioration de la qualité des soins apportés aux patients, propose des mesures de prévention pour enrayer la propagation du staphylocoque doré résistant à la méticilline.
Cette étude a comparé les procédures dans 7 pays européens (Belgique, Allemagne, Finlande, Hongrie, Pologne, Slovénie, Espagne) et a trouvé de grandes variations dans l'exécution de ces procédures, que ce soit dans les unités de soins intensifs ou dans les blocs opératoires (l'intervention chirurgicale sur la hanche a été prise comme exemple).
Les procédures destinées à éviter la propagation du S.aureus résistant à la méticilline pour lesquelles étaient trouvées des différences d'application entre pays, étaient :
o au lit du malade, solution de désinfection des mains à base d'alcool
o chambre seule pour les patients porteurs de S.aureus résistant à la méticilline
o possibilité de disposer de chambres seules
o désinfection par Mupirocine (par exemple, décolonisation du nez pour les patients en soins intensifs)
o protocole de `screening' de S.aureus résistant.
Les procédures qui étaient adoptées par tous les pays étaient :
o la mise en place d'un `sas' ou d'un système de barrière à l'entrée des unités de soins intensifs ou des blocs opératoires
Une publication récente d'avril 2006 s'est justement intéressée, par modélisation d'impact, aux différentes mesures préventives pour maîtriser le taux de SARM.
Ce travail compare des protocoles d'éviction des staphylocoques dorés résistants à la méticilline (SARM) dans les pays scandinaves 7 ( * ) . Cette étude part du constat que dans les Pays-Bas et les pays scandinaves, le taux de SARM est inférieur à 1% alors qu'il est en France de 28% selon l'EARSS 2004, et se situe aussi à des taux importants au Royaume Uni, en Allemagne, en Belgique et aux États-Unis (50% selon le National Nosocomial Infections Surveillance System 8 ( * ) ).
Les pays scandinaves et les Pays-Bas, pour obtenir un taux si faible de SARM, ont développé le protocole appelé `Search and Destroy' (S & D).
Les impacts des mesures de ce programme S & D ont été étudiés en utilisant des modèles mathématiques en considérant soit un faible taux de SARM (<1%), soit un fort taux de SARM (>10%).
Les 6 mesures préventives étudiées étaient :
o Mesure I : la prise en charge des porteurs de SARM en chambre seule
o Mesure II : la recherche d'une colonisation et l'isolement des patients à risque, c'est-à-dire les patients déjà identifiés comme porteurs de SARM ou provenant de services à risque
o Mesure III : la recherche systématique de SARM chez tous les patients après la détection d'une IN dans un service
o Mesure IV : mesure III associée à la recherche systématique d'une colonisation par le SARM dans le personnel soignant d'un service infecté, et arrêt de travail jusqu'à décontamination des membres du personnel infectés
o Mesure V : interdiction de nouvelles admissions dans les services présentant une transmission avérée entre les patients, cette mesure étant prolongée jusqu'à isolement en chambre seule de tous les porteurs de SARM
o Mesure VI : la colonisation du SARM est éradiquée à la fin de l'hospitalisation.
Les simples mesures d'hygiène des mains sont sous-entendues dans le comportement du personnel de santé et ne sont donc pas mentionnées en tant que telles bien qu'elles soient indispensables et nécessairement respectées.
o Première constatation :
o dans les modèles à faible taux de SARM (<1%), l'absence de toute mesure de contrôle s'accompagne en 10 ans d'une augmentation du taux atteignant plus de 15%. L'application de la mesure I seule n'est pas suffisante pour maintenir le taux d'IN à SARM à moins de 1% mais l'augmentation est très lente (1,5% en 30 ans). L'association de la mesure I avec la mesure II ou avec la mesure III permet de maintenir un taux de SARM à moins de 1%. L'association des mesures I, II et III donne les meilleurs résultats. Les mesures IV, V, et VI offrent chacune un bénéfice supplémentaire minime.
o Deuxième constatation :
o dans les modèles à fort taux de SARM (>10%), l'application de l'ensemble des mesures du programme S & D réduit le taux de SARM à 1% en 6 à 12 ans. L'application de la mesure I seule le réduit à 5% en 15 ans. Et les applications, par étape ou globalement, de la mesure I avec la mesure II ou avec la mesure III ou avec les mesures II et III aboutissent à une diminution du taux de SARM allant de moins de 2% à moins de 1% sur 20 à 30 ans selon le modèle. Le nombre total de jours requis en isolement par hôpital sur 30 ans est d'une centaine de milliers de jours.
Les pays ayant un fort taux de SARM pourraient s'inspirer de ce programme S & D et de ses 6 mesures. A noter que ces mesures, pour être efficaces, doivent être respectées de façon exhaustive : par exemple, une efficacité d'isolement des patients de seulement 50% ne pourrait conduire à une diminution du taux de SARM.
Mais des limites s'imposent immédiatement pour appliquer un tel programme :
1- il existe en France un problème architectural qui fait que souvent dans les services de réanimation, les réanimateurs ne disposent pas de chambre d'isolement ou n'en disposent pas en nombre suffisant (chambres en réanimation à 3 lits, heureusement de moins en moins fréquentes...) ;
2- en France, il existe également un problème culturel comportemental qui entrave les plus simples mesures d'hygiène, mesures appliquées depuis longtemps dans les pays scandinaves.
Mais ce modèle est à garder à l'esprit. On remarquera à ce propos que les pays ayant de bons résultats en matière de résistance aux antibiotiques ne sont pas toujours ceux qui ont de bons résultats en matière d'IN. Les mesures à prendre pour ces deux objectifs, pourtant très liés, sont distinctes.
|
Synthèse |
|
Les infections nosocomiales (IN) sont les infections contractées dans un établissement de santé. Ses origines sont multiples : elles sont directement liées aux soins dispensés au patient (par exemple, présence d'un cathéter), ou surviennent lors de l'hospitalisation indépendamment de tout acte médical (épidémie de grippe). Les micro-organismes impliqués sont d'origine soit `endogène' : ce sont les bactéries du patient qui infectent une plaie / un organe ; soit `exogène' : ce sont alors les germes des autres patients, du personnel de santé, ou de l'environnement hospitalier (eau, air...). Des facteurs favorisants existent. Ce sont essentiellement l'âge et la pathologie du patient (sujet âgé, nouveau-nés, polytraumatisés, immunodépression, chimiothérapie,...), la réalisation d'actes invasifs et certains traitements (traitements antibiotiques, qui n'augmentent pas le risque infectieux, mais sélectionnent des bactéries résistantes aux antibiotiques). A partir de ces quelques lignes, il est facile de mesurer la complexité de la prévention des IN pour une personne âgée ayant plusieurs pathologies et devant subir un geste chirurgical à haut risque (par exemple, prothèse de hanche). Les programmes de surveillance des IN sont multiples en France et en Europe. Ainsi sur le plan national, les réseaux nationaux de surveillance permettent de fournir des données chiffrées établies sur ces dernières années (2001 - 2004) : o la prévalence des patients infectés est d'environ 7% ; en grande majorité, il s'agit d'une infection urinaire (40% des IN) ; o 1,5% des infections chirurgicales ont été suivies d'une IN sachant que pour les patients dits `à risque faible', ce taux était de 0,62% ; o 14,9% des patients en réanimation ont acquis une IN ; les pneumopathies sont les infections plus fréquemment observées, particulièrement chez les malades sous respiration artificielle ; o l'origine de l'infection de type « bactériémie » (bactéries dans le sang), infection grave car mortelle dans 20 à 30% des cas, est une IN dans 40% des cas étudiés ; o les 3 germes les plus fréquemment retrouvés sont Escherischia coli (infections urinaires), Staphylococcus aureus (infections respiratoires, et du site opératoire, en particulier en chirurgie ostéo-articulaire) et Pseudomonas aeruginosa (infections respiratoires, infections urinaires). La résistance des germes aux antibiotiques est élevée, mais ce taux de résistance évolue favorablement grâce aux efforts effectués ces dernières années (plan national d'action pour préserver l'efficacité des antibiotiques 2001-2005). Le réseau européen EARSS (European Antimicrobial Resistance Surveillance System) montre que la proportion de Staphylococcus aureus résistant à la méticilline (SARM) a augmenté dans les pays d'Europe, sauf en France où il a diminué (28% en 2004, contre 33% en 2002) mais ce taux demeure important et maintient la France dans le groupe des pays européens où la résistance de cette bactérie forte. Grâce aux études de comparaisons européennes (Helics : Hospital in Europe Link for Infection Control through Surveillance), on peut brièvement remarquer que : o pour les IN acquises en Unité de Soins Intensifs (pneumonie, bactériémie, infection urinaire), la France se situe dans la moyenne des 8 pays étudiés ; o pour les IN acquises après intervention chirurgicale, la France se trouve également dans la moyenne des pays étudiés (10 pays), voire dans la fourchette basse du taux d'IN pour certaines interventions (intervention sur le colon, cholécystectomie, arthroplastie de la hanche). o Ce classement est toutefois à prendre avec précaution car les pratiques médicales ne sont pas les mêmes d'un pays à l'autre (indications d'intervention, classement des patients selon le risque, etc.) et il est donc difficile de comparer les taux des différents pays entre eux. |
Quelle est l'estimation de la mortalité attribuable aux IN ?
Plusieurs études récentes françaises ont tenté d'approcher le problème de la mortalité attribuable aux IN, ce qui pose des problèmes méthodologiques particuliers en raison de l'intrication des facteurs. Les patients avant de décéder présentent souvent des pathologies graves, multiples, et certains sont en phase « terminale » de leur maladie (cancers ou autres maladies chroniques). Il est de fait difficile de déterminer ce qui revient à l'affection principale, aux éventuelles pathologies associées, à l'IN elle-même ou à d'autres événements intercurrents. D'ailleurs, il est démontré que les malades qui acquièrent une IN sont en moyenne plus graves à l'admission dans l'établissement. Aussi, les estimations d'imputabilité s'intéressent aux sous-populations de patients décédés avec IN sans maladie à risque vital immédiat. Mais il reste souvent difficile de dire si l'IN est la cause du décès ou a « participé » au décès.
En outre, même s'il y a imputabilité d'un décès à une IN, cela ne signifie pas que cette IN était évitable.
La démarche la plus complète a été menée par le centre inter-régional de lutte contre l'infection nosocomiale de Paris (C-CLIN Paris-Nord) pour évaluer la proportion de décès associés et la proportion de décès imputables à une IN (Kaoutar et al. J Hosp Infect. 2004). Il s'agit d'une étude multicentrique menée dans 16 hôpitaux de l'inter-région (9 CHU et 7 CH) d'avril 2000 à juillet 2001.
L'étude a porté sur les décès survenus au moins 48 heures après l'hospitalisation. 1 945 patients décédés au cours de l'étude ont été inclus ; 26,6% d'entre eux (517 patients) avaient une IN au moment du décès. L'IN a contribué au décès chez 284 patients (le clinicien en charge du patient et l'enquêteur ont estimé de façon consensuelle si le décès était imputable à une infection nosocomiale). Parmi ces décès, l'imputabilité à l'IN était certaine chez 129 patients (6,6%) et possible chez 155 patients (8%). Parmi les 129 décès imputables de façon certaine à une IN, aucune cause de décès à court terme (2 semaines) autre que l'IN n'était présente chez 55 (2,8%) d'entre eux.
Les infections les plus fréquemment en cause étaient les pneumopathies, les bactériémies (et chocs septiques), les infections digestives et les infections du site opératoire. Staphylococcus aureus était le germe le plus souvent retrouvé dans les IN. Les maladies infectieuses (dont 2/3 sont des IN) représentaient la troisième pathologie responsable de décès après les maladies cardiovasculaires et le cancer. Les IN étaient en quatrième position parmi les causes possibles de décès.
Les auteurs ont réalisé une extrapolation à l'ensemble du territoire, en stratifiant les données selon le type d'hôpital : l'IN aurait contribué directement de façon certaine au décès chez 4 188 [2 665 - 6377] patients dont le pronostic vital n'était pas engagé à court terme 9 ( * ) , soit 70 décès par million d'habitants. Indifféremment du pronostic à court terme, une IN aurait contribué directement au décès chez 8 929 [6 715 - 11 837] patients.
Resterait enfin à déterminer au sein de ce chiffre de décès quelle proportion était évitable par des actions de prévention. Car les 55 patients identifiés comme décédés directement à cause d'une IN étaient par ailleurs fragiles (4 prématurés, patients très âgés porteurs de pathologies sévères...).
Le schéma suivant résume l'analyse.
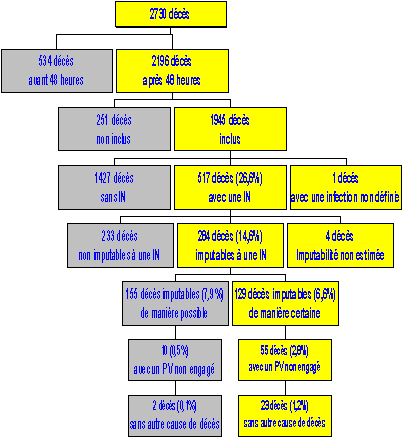
Note : PV = pronostic vital
Source : CCLIN Paris-Nord
A noter que le taux de 6,6% de décès directement imputables à l'IN est proche du taux rapporté dans une étude précédente (Branger et al., 1997) menée au CHU de Rennes 10 ( * ) .
Dans cette étude,
o 200 dossiers de décès ont été tirés au sort sur l'année 1997 (sur 1 371 dossiers au total), qu'ils surviennent ou non dans les 48 heures après l'admission.
o 59 des 200 patients étaient porteurs d'une IN (30% des patients).
o Après analyse d'imputabilité, 12 dossiers ont été retenus, soit 6% des décès considérés comme imputables directement à l'IN.
o Ces 12 patients avaient des facteurs de risque très élevés (4 cancers, 3 pathologies cardio-vasculaires, 1 prématuré...).
o Sur la base de ces travaux, le taux de mortalité des IN, une fois survenues, a été estimé à 4%.
Des résultats un peu différents ont été obtenus au CHU de Besançon avec une observation en continu des décès hospitaliers depuis janvier 2002 11 ( * ) : au cours de l'année 2002, 1 213 décès sont survenus sur 49 796 patients admis (taux brut de 2,44%) ; 380 patients (38,3%) présentaient une infection au moment du décès ; pour 150 d'entre eux, il s'agissait d'une infection acquise pendant l'hospitalisation (dont 83 infections pulmonaires, 49 bactériémies), soit un taux de 15,3% (inférieur au 26,6% de l'étude précédente). 20 de ces 150 patients avaient un score d'imputabilité `possible' (score de Mac Cabe). La recherche d'évitabilité a été menée pour 8 de ces 20 patients. Pour 5 de ces dossiers, l'imputabilité directe a été retenue. Par extrapolation, le taux de mortalité imputable aux IN serait de 1,27%.
Cette analyse a permis de proposer des mesures préventives dans trois cas (considérés donc comme évitables) :
o port systématique du masque en néonatologie pendant les périodes épidémiques communautaires,
o révision du protocole de décontamination nasale en pré-opératoire,
o prévention des fausses routes par pose d'une sonde naso-gastrique chez les patients à risque (mesure toutefois difficile à défendre de façon systématique).
Même si les méthodologies sont différentes, on observe que le taux de mortalité proportionnelle imputable chez des patients au pronostic vital non engagé à court terme et sans autre cause de décès est proche de celui trouvé dans l'étude du CCLIN Paris-Nord (1,27% contre 1,2%).
Pour cette catégorie de décès, l'extrapolation pour l'ensemble des lits d'hospitalisation de court séjour en France donne un total d'environ 1 800 décès hospitaliers chaque année.
L'intérêt de cette étude réside aussi dans la mise en place d'un observatoire permanent des décès liés aux IN. A noter que l'une des mesures essentielles pour la réussite d'un tel observatoire réside dans l'anonymat de la fiche d'observation. Les médecins adhèrent à ce type de démarche si l'analyse est astreinte à la confidentialité et déconnectée du risque de sanction. Cette analyse des décès est fondée sur « la notion culturellement difficile à imposer `d'erreur utile' », concluent les auteurs.
Une autre enquête d'envergure a été réalisée au CHU de Nîmes. Cette étude a porté sur les décès des patients qui avaient été exposés (en comparaison avec des patients non exposés) à une IN.
Cette étude avait pour objectif principal d'évaluer le rôle des IN comme facteurs de risque de décès à 60 jours dans un CHU. Le délai de 60 jours est justifié par le fait que la durée moyenne d'hospitalisation est augmentée de 32 jours en moyenne en cas d'IN grave (bactériémie, pneumopathie). Cette étude a été menée du 7 mai 2001 au 10 janvier 2003 et a été publiée en octobre 2004. Elle a inclus 1 914 patients présentant une IN, dont l'âge médian était de 73 ans, hospitalisés en court séjour de médecine (42,7%), chirurgie (31,7%) et réanimation (11,9%), et 5 172 patients non exposés.
Les IN les plus fréquentes étaient les infections urinaires (56%) puis les infections du site opératoire (11,4%), les pneumopathies (10,9%), les bactériémies (7,8%).
Les 3 pathogènes les plus fréquemment isolés étaient Escherischia coli (27,8%), Staphylococcus aureus (13%) et Pseudomonas aeruginosa (8%) dont certains multi-résistants.
Les comparaisons entre le groupe des patients qui furent exposés à une IN et le groupe non exposé ont montré que les co-morbidités plus fréquemment observées chez le groupe exposé étaient les tumeurs avec ou sans métastases, et que les actes à risque (cathéter périphérique ou central, sonde, etc.) étaient plus fréquemment observés chez les sujets exposés que non exposés.
En ce qui concerne la survenue du décès chez les patients exposés à une IN, on compte 413 décès chez les patients avec IN, soit 22%, contre 429 chez les patients sans IN, soit 8,9% ; le décès est plus fréquent quand le site d'infection est le sang, le poumon et le tractus urinaire, ou quand plusieurs sites sont infectés. En tenant compte des différents facteurs présents chez les 2 types de patients, dont les co-morbidités, l'existence de gestes invasifs, le type de séjours, il persiste un lien significatif entre l'IN et le décès à 60 jours. Les infections les plus à risque sont les bactériémies, les infections de plusieurs sites, les pneumopathies.
Ainsi, les décès imputables aux IN après prise en compte de l'état de gravité des patients sont principalement dus aux bactériémies et pneumopathies, résultats à mettre en parallèle avec les données des études menées en unité de réanimation, et aux infections urinaires. Pour ces dernières, habituellement peu graves, il faut noter que leur incidence étant très élevée, leur impact ne doit pas être minimisé.
|
Synthèse La mortalité due aux IN ne peut être qu'estimée car il est souvent difficile d'imputer le décès du patient à une IN plutôt qu'à la pathologie subie par le patient (tumeur avec métastases...). Peu d'études ont été réalisées mais il semblerait que les IN multiplient le risque de décès par 3 si on compare le nombre de décès des patients ayant acquis une IN à celui des patients « identiques »n'ayant pas acquis une IN. Globalement, le taux de décès imputable d'une façon certaine aux IN serait d'environ 6,6% des décès totaux en établissement hospitalier de court séjour d'après une étude menée dans 16 établissements (9 CHU et 7 CHG) de l'inter-région Paris-Nord ; parmi ces décès imputables à une IN, aucune cause de décès à court terme (2 semaines) autre que l'IN n'était présente chez 2,8% d'entre eux. Et si on restreint l'analyse aux décès imputables à l'IN chez des patients au pronostic vital non engagé à court terme sans autre cause de décès, le taux est de 1,2 à 1,27%. En extrapolant ces données à l'ensemble du territoire, on peut estimer le nombre de décès en secteur hospitalier avec IN à environ 9 000, dont 4 200 chez des patients dont le pronostic vital n'était pas engagé à court terme, dont la moitié sans autre cause de décès. Si on applique un taux d'évitabilité de 30% (en gardant à l'esprit que ce taux est, en la circonstance, difficile à établir), il y aurait de l'ordre de 1 250 décès imputables directement aux IN et évitables chaque année. |
Les séquelles à moyen et long terme
Il n'existe aucun travail spécifique sur les séquelles à distance des IN. Il s'agit donc d'un sujet fondamental mais à défricher entièrement. Les seules données très parcellaires sont fournies par les CRCI et l'ONIAM, la Justice, le LIEN, les assurances professionnelles. Ces données ne peuvent fournir une vision complète du problème mais permettent de montrer que les séquelles, en particulier fonctionnelles, peuvent dans certains cas, être considérables. Elles n'entraînent une prise en charge par la solidarité nationale (ONIAM) que si elles dépassent 24% d'IPP.
Les séquelles sont très fortement influencées par le site anatomique de l'IN. Les infections qui sont, en théorie, susceptibles d'entraîner les plus lourdes séquelles, sont les grandes infections de la paroi abdominale, génératrices d'éventration, les infections ostéo-articulaires, en particulier sur prothèses, les médiastinites, les endocardites nosocomiales sur valve artificielle, les infections sur prothèses vasculaires, les infections après neurochirurgie. Les infections nosocomiales qui entrainent le plus de contacts des usagers avec le LIEN sont les infections après chirurgie orthopédique, en particulier après mise en place de prothèse. Ceci est certainement lié au fait que le LIEN s'est créé à l'issue des infections ostéo-articulaires survenues à la Clinique du Sport.
Les séquelles fonctionnelles de ce type d'infection peuvent être considérables, avec nécessité de changer, voire parfois d'enlever définitivement la prothèse. L'infection peut être chronique, entraînant une forte altération de la qualité de vie pendant des années. De plus, une impotence fonctionnelle importante pour une intervention qui devait apporter un important bénéfice fonctionnel, au cours d'une affection invalidante, mais ne menaçant pas la vie (arthrose), est particulièrement mal « ressentie ».
Un article récent de Whitehouse et al. (2002) a montré que l'infection en chirurgie orthopédique augmentait la durée de séjour de 2 semaines en moyenne, doublant le taux de réhospitalisation, augmentait les coûts de 300% et altérait significativement le pronostic fonctionnel et la qualité de vie (score SF 36).
Il serait très important de mettre en place des études prospectives dans ce domaine avec utilisation de scores évaluant à la fois le domaine fonctionnel et la qualité de vie perçue, dans le cadre d'un suivi systématique, et prospectif des prothèses articulaires (voir propositions).
Le groupe TIRESIAS contacté (Pr Lortat-Jacob) pense également que cette thématique est importante et a l'intention de mettre en place des études sur ce thème.
Pour illustrer cette question, nous présentons ci-après quelques cas cliniques.
ETUDE DE CAS CLINIQUES
Pour illustrer les propos des pages précédentes, nous avons pensé utile de présenter quelques cas cliniques, qui représentent une palette assez large de situations. Ces cas n'ont pas vocation à être représentatifs, mais ils permettent de montrer, dans des situations précises, quels ont été les trajets des patients, quels types de conséquences ils encourent, quelles pistes de prévention se présentent. Ils indiquent aussi à quel point la discussion sur l'évitabilité est complexe.
Ces cas sont des cas réels, présentés par certains des cliniciens rencontrés, que nous remercions ici, la démarche n'étant pas usuelle...
5 Cas illustrant des parcours de patients après intervention orthopédique compliquée d'IN
1 er cas
Patiente née en 1976, habitant la Savoie
1992 : ostéosarcome du fémur droit ; prothèse totale du genou et chimiothérapie à Lyon
1993-94 : ré-intervention à Lyon pour problème mécanique
2000 : récidive de la tumeur avec métastases pulmonaires, d'où chimiothérapie ; septicémie avec fixation bactérienne sur la prothèse (Staphylococcus epidermidis) : intervention chirurgicale pour laver la prothèse + antibiothérapie
2003 : nouvelle intervention car le genou est raide (malgré la récusation de l'indication chirurgicale au CHU) ; échec
2004 : hospitalisation à Paris pour genou raide, la prothèse est en place ; la ponction révèle un Staphylococcus epidermidis multirésistant ; intervention chirurgicale : amputation, prothèse enlevée, lavage du site, insertion d'un morceau de tibia sain dans le restant du fémur, puis appareillage.
2 ème cas
Patiente née en 1963, habitant en Bretagne
1987 : ligamentoplastie suite à une entorse du genou ; mais échec et genou instable
1992 : ré-intervention à Quimper ; IN à Staphylococcus aureus
1993 : ré-intervention : nettoyage du site et antibiothérapie ; mais récidive de l'infection, d'où ré-intervention au CHU (ostéotomie du tibia) + antibiothérapie
1999 : 2 prothèses totales de genou (en deux temps)
2000-2001 : nouvelle prothèse du genou mais nouvel échec
2002 : prothèse retirée, arthrodèse du genou
2003 : retrait du matériel métallique
2004 : adressé à Paris : sans infection, mais genou bloqué, 7 cm de raccourcissement du membre ; amputation et appareillage
3 ème cas
Patiente née en 1957, habitant l'Ile-de-France
Février 2004 : fracture du cotyle gauche (chute à ski) ; intervention à l'AP-HP avec pose d'un fixateur externe sur la hanche opposée ; IN par pseudomonas pyocyanique dans la hanche saine ; l'ostéoarthrite de la hanche implique une ré-intervention en mai 2004 : échec
Mars et mai 2005 : Nettoyage, antibiothérapie, et 2 prothèses totales de hanche (une droite et une gauche)
Procédure (plainte déposée) en cours
4 ème cas
Patient né en 1951, habitant l'Auvergne
1976 : entorse grave du genou (accident du travail) ; multiples interventions (ligamentoplasties)
1992 : prothèse de rotule à Saint-Etienne
1997 : prothèse totale du genou ; mais infection impliquant lavage (sans retirer la prothèse) et antibiothérapie
Fin 1997 : la prothèse est retirée
1998 : le patient refuse le blocage du genou ; pose d'une prothèse ; une fistule (écoulement régulier au niveau du genou) se produit... jusqu'en 2004 !
2004 : douleur au genou ; nettoyage inadapté, synovectomie + antibiotique (germes en cause : staphylocoque doré et streptocoque)
Avril 2005 : Paris : intervention en urgence : prothèse retirée + antibiothérapie
Septembre 2005 : prothèse+ greffe osseuse. Antibiothérapie.
Mars 2006 : récidive de l'infection (typage génétique de la bactérie en cours à l'Institut Pasteur). Nouvelle prothèse programmée. Si échec : arthrodèse ou amputation.
Ce patient, qui a donc subi un accident du travail et des infections mal traitées, et n'a pas pu retravailler depuis 1997, n'a qu'une IPP lui octroyant 150 euros par mois.
5 ème cas
Patient né en 1939
Septembre 2005 : fracture fermée de jambe ; ostéosynthèse par plaque-vis en clinique ; complication : nécrose cutanée, mais nettoyage insuffisant, antibiothérapie avant résultats des prélèvements et de l'antibiogramme (enterobacter cloacae).
Pose d'un fixateur externe après retrait du matériel.
Novembre 2005 : intervention à Paris : l'os infecté pointant à l'air libre est retiré, un plasticien réalise un lambeau, mais il faut prévoir un an d'autogreffes osseuses pour résorber le trou.
Antibiothérapie en KT central (le patient n'a plus de veines !)
Ces 5 cas cliniques illustrent, entre autres, l'importance de la bonne prise en charge de l'infection : rapidité et efficacité de la prise en charge auraient sans doute pu permettre de raccourcir la durée de ces infections.
Cas illustrant la complexité des pathologies des patients ayant acquis une IN (deux cas de septicémie)
1 er cas
Patient né en 1953
Patient hospitalisé en urgence pour une dissection de l'aorte, avec ischémie aigue de jambe. Au 9ème jour après l'intervention chirurgicale, une médiastinite survient ; à partir des hémocultures (septicémie), un staphylocoque doré est isolé.
Après antibiothérapie, le patient sort de l'hôpital.
Discussion sur ce cas :
La septicémie était-elle due aux soins ? La réponse est positive, le staphylocoque doré isolé est en faveur de l'IN.
La septicémie était-elle évitable ? Le patient n'a pas de facteur de risque sur le plan médical ; par contre, sur le plan des facteurs de risque d'IN : le patient est arrivé dans un état d'hygiène médiocre et son état réclamait une intervention chirurgicale en urgence (ischémie aigue du membre inférieur).
L'UHLIN utilise un codage afin de mesurer le caractère évitable de l'IN (de 1 pour évitable à 6 pour inévitable) ; ce patient se situe dans la zone 3 (possiblement évitable par une meilleure préparation du patient à mettre en balance avec le caractère d'extrême urgence, « il fallait sauver la jambe !»).
Il faut noter que les septicémies sur cathéter ont diminué dans l'établissement de moitié en quelques années grâce à un audit des pratiques, un travail avec les services médicaux et chirurgicaux, la distribution de fiches explicatives sur le caractère évitable d'une IN, une étude des facteurs de risque.
2 ème cas
Patient né en 1940
Patient ayant une cardiopathie ischémique : intervention chirurgicale de type pontage en 1992 ; puis artérite des membres inférieurs impliquant un pontage en 1997 et en 2003.
Suite à une pathologie maligne (cancer de la vessie infiltrant), prostatocystectomie ; en 2004, nécrose des 2 uretères et complications vasculaires : ischémie aigue des membres inférieurs évoluant vers un état de choc du patient ayant nécessité l'hospitalisation en urgence (mai 2004).
Le patient subit une intervention chirurgicale digestive, suite à la nécrose des 2 uretères et de l'implant vésical ; une péritonite fait suite à l'intervention digestive avec, comme germes impliqués, un entérocoque et un pyocyanique. Le patient est traité par antibiotique. Au 5ème jour après l'intervention, un drainage sous-pariétal est effectué pour drainer une poche purulente où on retrouve comme germes le pyocyanique et un candida, traités par antibiotique et antifongique. Le patient sort de l'hôpital.
A partir de mai 2004, le patient est suivi en urologie où sont effectués les changements de sonde de néphrostomie régulièrement (changements sous anesthésie locale).
Dernièrement, le patient est hospitalisé car la sonde est tombée, d'où un repositionnement effectué en urgence en chirurgie. Immédiatement après l'intervention, une forte température, des sueurs apparaissent. Hémoculture et ECBU sont effectués, puis antibiothérapie à l'aveugle. L'épisode fiévreux s'arrête. Le germe détecté est citrobacter (une entérobactérie) multi-résistant dans l'hémoculture et les urines. Ce germe est présent dans les 2 néphrostomies. Une antibiothérapie efficace est mise en place. Le patient sort de hôpital.
Discussion sur le cas :
La septicémie était-elle due aux soins ? Ou en d'autres termes : s'agit-il d'une infection sur sonde ou d'une infection liée à l'urine infectée ? Infection a priori sur sonde. Mais pas de prophylaxie effectuée car elle serait inefficace sur les germes.
La septicémie était-elle évitable ? Dans l'absolu, il aurait été souhaitable de faire le drainage chirurgical après avoir réalisé l'antibiogramme et, selon le résultat de celui-ci, donner un flash d'antibiotique adéquat pour détruire le germe présent, et cela juste avant l'intervention chirurgicale ; mais le patient peut difficilement attendre un jour ou deux car il s'agit ici d'une urgence où il faut drainer l'urine ! Cette IN est dans la zone des IN inévitables (code 5 de l'UHLIN).
Cas cliniques recueillis au cours `d'une visite' d'une unité de réanimation ; les patients ont subi un accident médical majeur
1 er cas : IN suite à une intervention chirurgicale
Patiente de 76 ans, diabétique, en assez mauvais état général pré-opératoire.
La patiente subit une intervention chirurgicale avec : remplacement valvulaire aortique et mitral et pontage ; en per-opératoire, une « dissection aortique » survient impliquant un remplacement d'un morceau de l'aorte ; en post-opératoire, une médiastinite se déclare.
La patiente a ainsi subi 2 complications : une liée à la difficulté technique de l'intervention (plaie de l'aorte) et une IN à streptocoque (médiastinite).
La patiente est en réanimation depuis un mois. L'issue est incertaine.
2 ème cas : complication médicale de type `mécanique' puis IN
Patiente de 85 ans (autonomie limitée), qui, sur occlusion, a nécessité une intervention chirurgicale ; suite à cette intervention, une plaie sur le grêle suturée s'est déclarée, entraînant après quelques jours une péritonite par lâchage de la suture, d'où l'IN, qui survient comme conséquence du problème mécanique.
La patiente est décédée.
3 ème cas : conséquences d'une intervention chirurgicale importante, recherche de la cause de l'état infectieux.
Patient de 70 ans, ayant été opéré d'un anévrysme de l'aorte impliquant la pose d'une prothèse aorto-bifémorale. Suite à cette intervention, un `état infectieux like' se déclare. La cause est recherchée : est-ce une infection sur la prothèse ? ou est-ce liée à une ischémie digestive ?
4 ème cas : complication `mécanique' puis IN
Patiente de 70 ans, atteinte de la maladie de Parkinson, avec un état général médiocre en pré-opératoire.
Après une intervention chirurgicale sur méga-oesophage (la patiente ne pouvait plus manger), une fistule post-opératoire et une péritonite digestive se sont déclarées. L'IN est là aussi la conséquence du problème mécanique face à cette intervention difficile.
5 ème cas : IN avec un état cardiaque altéré
Patient de 70 ans.
A la suite d'un triple pontage, avec des suites cardiaques très difficiles (contre pulsion, et drogues) une médiastinite à staphylocoque blanc s'est déclarée. Le pronostic est sombre du fait de l'état cardiaque altéré.
6 ème cas : complication hémorragique
Patiente de 50 ans
Au cours d'un remplacement d'une valve mitrale (4 ème intervention chirurgicale, la patiente ayant été atteinte d'un rhumatisme articulaire aigu, avec destruction de la valve mitrale ayant entraîné la pose d'une prothèse valvulaire mitrale), une tamponnade (état de choc) par hémopéricarde survient. Cet hémopéricarde est dû à une plaie de la veine cave survenue en per-opératoire, en raison d'une intervention extrêmement difficile au plan technique. L'hémomédiastin est drainé.
La patiente va beaucoup mieux, mais le risque d'IN dans ces conditions est fort.
Pour les cas présentés ici, la cause de l'IN est difficile à identifier, et l'IN ne peut être expliquée par le non-respect de simples mesures d'hygiène ! Mesures qui sont par ailleurs appliquées. Ces cas illustrent la complexité des IN et le taux relativement modeste d'évitabilité.
Pour rechercher les causes des ISO et tenter d'agir préventivement, il faut chercher à répondre aux questions suivantes :
o ne pourrait-on pas évaluer l'état de défense en pré-opératoire, et éventuellement stimuler l'état immunitaire de certains patients ?
o serait-il utile de vacciner les patients contre certains germes ?
o quelle serait l'utilité d'optimiser la prophylaxie antibiotique chez certains patients à risque (antibioprophylaxie à la carte) ?
o comment un germe parvient-il dans le site opératoire ? En effet, 20 à 30% des sujets sains sont porteurs de staphylocoque dans le nez, et les germes dans les abcès post opératoires et dans le nez en pré-opératoire sont les mêmes. Il s'agit donc le plus souvent d'une infection endogène. La détection des porteurs, et la décontamination pré-opératoire de ceux ci restent à l'étude, mais n'a pas apporté les résultats espérés. Une recherche active est impérieuse dans ce domaine, ce qui n'est pas le cas actuellement.
De même, pour les IN survenant spécifiquement en USI, les questions sont multiples :
o serait-il utile de procéder à la décontamination de la sphère ORL ?
o serait-il utile d'injecter des immunoglobulines ?
o serait-il utile de vacciner (contre le staphylocoque par exemple) ?
o serait-il utile de donner une antibioprophylaxie chez les grands poly-traumatisés avec coma pour éviter une pneumopathie ?
o quelle manière serait la mieux appropriée pour intuber ?
D. LES COÛTS INDUITS PAR LES INFECTIONS NOSOCOMIALES
Synthèse
Une recherche bibliographique a été menée sur la base de données électronique Medline à partir des combinaisons de mots-clés suivantes : nosocomial infections costs , et hospital acquired infections costs .
Dans un premier temps, toutes les références des articles (1 872) ont été analysées à partir de leur titre et de l'année. Toutes les références hors sujet et/ou antérieures à 2000, ainsi que celles qui ne concernaient pas des pays européens ou nord américains ont été écartées.
La deuxième étape a consisté à étudier l'ensemble des abstracts des références retenues (227).
Les abstracts comportant trop peu de patients, ainsi que ceux dont la période d'observation était antérieure à 1995 n'ont pas été retenus. Lorsque plusieurs articles d'une même équipe portant sur le même thème figuraient, seul l'article le plus récent était retenu. L'analyse bibliographique a finalement porté sur les 23 articles les plus représentatifs, analysés dans le détail ; les autres, qu'ils soient redondants, en périphérie du sujet ou ne représentant que l'expression d'opinions, ont été plus rapidement exploités, à des fins méthodologiques.
Ces articles regroupent des études prospectives, des études rétrospectives et des revues de la littérature. Parmi ces 23 études, cinq étaient françaises, sept européennes et onze américaines.
Toutes ces études sont résumées en annexe 9.
Les cinq études françaises analysent toutes les coûts directs médicaux du point de vue de l'établissement de santé.
La première étude française était une analyse bibliographique réalisée par l'ANAES (ANAES, 2004), cette analyse bibliographique portait à la fois sur le coût de la prévention et sur le coût de la non qualité. Pour ce faire, des études françaises mais aussi étrangères ont été analysées.
Six études françaises ont été analysées dans cette revue ; deux d'entre-elles portaient sur l'ensemble des infections nosocomiales, une sur les staphylocoques méticilline-résistants dans les services de réanimation, deux sur les septicémies et/ou pneumopathies de ventilation en réanimation et une sur les infections urinaires dans les services de médecine, de gériatrie et d'urologie. Ces études aboutissent à une échelle de coûts très large allant de 338 € en moyenne pour une infection urinaire à 35 185 € pour une septicémie en réanimation.
La fourchette de coût retrouvée pour le coût des IN évitables en réanimation varie de 23 à un peu plus de 200 millions d'euros.
Piednoir et al. (2003) ont évalué le coût des gastro-entérites par rotavirus acquises en hospitalisation à partir de l'analyse prospective de deux cohortes de 23 enfants âgés de 1 à 2 ans admis entre décembre 2001 et mars 2002 dans un service du CHU de Reims. Les auteurs ont évalué le surcoût induit par les infections nosocomiales grâce à une comparaison appariée et ajustée. Ils aboutissent à une augmentation de la durée de séjour de 4,9 jours par enfant infecté, soit un coût moyen supplémentaire de 1 930 €. La période d'observation de trois mois sur un seul site, et les pics saisonniers des épidémies de gastro-entérites nuisent à la généralisation des résultats de cette étude.
Brun-Buisson et al. (2003) ont évalué le coût des syndromes septiques en soins intensifs 12 ( * ) à partir de l'analyse prospective d'une cohorte de 224 patients admis dans un service de soins intensifs entre mai 1997 et avril 1998. Ils aboutissent à une estimation de 39 908 € pour les syndromes septiques à 44 851 € pour les patients ayant fait un choc septique.
Le coût supplémentaire induit par les syndromes septiques est plus important lorsque l'infection nosocomiale est contractée durant le séjour en soins intensifs ; le coût par patient admis en soins intensifs avec un syndrome septique qui ne contracte pas d'autre infection nosocomiale durant son séjour en soins intensifs est de 18 871 €, contre 41 006 € pour les patients admis sans syndrome septique en soins intensifs et qui en développent une durant leur séjour dans le service et 49 146 € pour les patients admis avec un syndrome septique qui contractent une autre infection nosocomiale, contre 12 719 € en l'absence de toute infection.
Adrie et al. (2005) ont évalué le coût des infections nosocomiales en soins intensifs à partir de l'analyse rétrospective d'une cohorte de 1 698 patients admis entre 1997 et 2000 dans six services de réanimation. Ils aboutissent à un coût moyen allant de 16 300 € pour la BPCO à 27 900 € pour les péritonites. Le coût moyen en soins intensifs était plus de deux fois supérieur chez les patients ayant une infection sévère (22 800 €) par rapport à ceux sans infection sévère (9 600 €).
Le surcoût entre un patient ayant contracté une IN pendant son séjour en soins intensifs et un patient sans infection est de 25 500 €
Ces deux études évaluent les coûts pour les seuls soins intensifs et ne prennent pas en compte le degré de sévérité de la maladie.
Chaix et al. (1999) ont évalué le coût supplémentaire attribuable à une infection par staphylocoque à partir de l'analyse rétrospective de deux cohortes de 25 patients admis en réanimation à l'hôpital Henri Mondor. Ils aboutissent à un coût supplémentaire en réanimation attribuable au staphylocoque de 9 275 $.
Sept études européennes , deux études italiennes, une allemande, une belge et trois anglaises, ont été analysées. A l'exception d'une des études britanniques qui analyse le coût de fermeture des lits et le coût de la contamination du personnel, les études européennes portent toutes sur l'évaluation des coûts directs médicaux.
La première étude italienne (Lauria et al. , 2003) est une analyse bibliographique du coût des infections nosocomiales et une évaluation du coût des infections nosocomiales dans les établissements italiens ; l'évaluation du coût des infections nosocomiales en Italie est réalisée à partir d'une étude de prévalence réalisée sur 16 établissements de santé italiens et des résultats d'une étude américaine sur l'augmentation de la durée de séjour imputable aux infections nosocomiales. Les auteurs aboutissent à une évaluation du coût des infections nosocomiales de 223 716 € pour un établissement de 270 lits avec un taux d'incidence des infections nosocomiales de 5%, tous sites confondus.
Orsi et al. (2002) ont évalué le coût des bactériémies à partir de l'analyse rétrospective de trois cohortes réunissant 315 patients admis dans huit services de chirurgie et un service de soins intensifs entre janvier 1994 et juin 1995. Les auteurs ont évalué le coût supplémentaire induit par une bactériémie grâce à une comparaison appariée et ajustée. Ils estiment la durée de séjour supplémentaire attribuable à la bactériémie entre 15,7 et 18,7 jours et le coût supplémentaire par patient infecté à 15 413 €. Le coût supplémentaire par patient est presque le double en soins intensifs (18 849 €) par rapport à la chirurgie (9 380 €). Dans cette étude, le degré de sévérité de la maladie des patients n'est pas pris en compte.
Dietrich et al . (2002) ont estimé le coût par patient et par jour attribuable aux pneumonies nosocomiales de deux façons différentes ; la première estimation a été réalisée à partir de l'analyse prospective de deux cohortes de 114 patients admis en soins intensifs entre mai 1998 et mars 1999. Ils ont réalisé une comparaison appariée et ajustée. Avec cette première méthode, les auteurs aboutissent à une durée de séjour supplémentaire en soins intensifs de 6,5 jours par patient infecté, et à un coût supplémentaire de 14 606 DM.
La deuxième estimation a été réalisée à partir de l'analyse rétrospective de deux cohortes réunissant 89 patients admis en soins intensifs entre février 1997 et décembre 1998. Ils ont réalisé une comparaison appariée et ajustée. Cette deuxième méthode aboutit à une durée de séjour totale supplémentaire de 10,14 jours et à un coût total supplémentaire par patient de 29 610 DM.
Pirson et al. (2005) ont estimé le coût des bactériémies à partir de l'analyse rétrospective de deux cohortes totalisant 1 344 patients hospitalisés dans un établissement belge en 2001. Les auteurs ont réalisé une comparaison appariée et ajustée, l'ajustement a été réalisé en fonction du GHM (groupe homogène de malades) des séjours hospitaliers. Les auteurs aboutissent à un coût supplémentaire de 12 853 € par patient.
Lopman et al. (2004) ont estimé le coût des gastro-entérites nosocomiales à partir de l'analyse des établissements de santé du Comté de Avon pendant une année. Les coûts estimés dans cette étude sont le coût de la fermeture des lits en raison de l'épidémie et le coût de l'absence du personnel hospitalier contaminé. Les auteurs ont estimé le coût de la fermeture des lits à environ 480 000 £, et le coût de contamination du personnel à 1,97 millions de £. L'importance de l'estimation du coût dans cette étude est directement liée à la taille du service, l'extrapolation est donc hasardeuse.
Plowman et al. (2001) ont estimé le coût des infections nosocomiales (tous types confondus) à partir de l'analyse prospective d'une cohorte totalisant 4 000 patients hospitalisés dans un établissement anglais entre avril 1994 et mai 1995. Les auteurs ont ensuite extrapolé le coût à l'ensemble de l'Angleterre. 309 patients ont développé une infection nosocomiale. Le coût supplémentaire induit par les infections nosocomiales est de 3 154 £, la durée moyenne de séjour supplémentaire attribuable aux infections nosocomiales est de 14,1 jours. Les surcoûts les plus élevés sont observés en chirurgie, les moins élevés étant notés en obstétrique. L'extrapolation aboutit à un coût de 930,62 millions de £ pour l'Angleterre et 3,64 millions de jours d'hospitalisation supplémentaires.
Coello et al. (2005) ont étudié l'incidence, la mortalité et les coûts induits par les ISO, dans 140 hôpitaux, entre 1997 et 2001. Les calculs de coûts ont été basés sur les résultats de l'étude précédente (Plowman et al., 2001).
Les patients ayant acquis une ISO (2 832 au total sur 67 140 interventions chirurgicales) ont tous une augmentation de durée de séjour allant de 21 jours pour une amputation (sans ISO, la moyenne de durée de séjour est de 13,2 jours) à 3,3 jours pour une hystérectomie (sans ISO, la moyenne de durée de séjour est de 5,1 jours) ; les autres interventions ont une durée additionnelle de séjour d'une douzaine de jours.
Le coût attribuable à l'ISO varie ainsi de 6 103£ pour une amputation à 959£ pour une hystérectomie, les autres interventions se situant aux alentours de 3 000£. La durée de séjour augmente pour les ISO profondes pour toutes les interventions chirurgicales sauf pour les amputations. Le plus fort coût additionnel concerne les ISO profondes sur prothèse de hanche (6 626£) ; le coût tend à presque doubler quand les ISO sont de localisation profonde, ce qui correspond à un doublement de la durée de séjour.
Cette étude souligne la variation des conséquences de l'ISO selon le type d'intervention.
Cinq des onze études américaines menaient une analyse prospective, les six autres reposaient sur une analyse rétrospective. Toutes ces études estiment les coûts directs médicaux.
Elward et al. (2005) ont estimé le coût des infections nosocomiales dans un service de soins intensifs pédiatriques à partir de l'analyse prospective d'une cohorte de 911 enfants admis en soins intensifs entre septembre 1999 et mai 2000. 57 enfants ont subi une IN. Les auteurs aboutissent à un coût supplémentaire par patient de 39 219 $, confirmant des résultats antérieurs.
Whitehouse et al. (2002) ont analysé les conséquences d'une ISO après intervention orthopédique dans 2 établissements entre 1997 et 1998 (étude cas-témoin, 59 patients dans chaque groupe). Les durées de séjour étaient, en cas d'ISO, augmentées en moyenne de 14 jours dans l'année, du fait essentiellement de la plus grande fréquence des réhospitalisations et des réinterventions (risque de réintervention doublé).
Le coût estimé était de 6 636 $ sans ISO et de 24 344 $ avec ISO. Ces résultats étaient les mêmes quelque dans les deux hôpitaux étudiés. Ainsi les coûts étaient multipliés par presque 4 pour les interventions avec ISO, que ce soient les coûts directs fixes ou variables ou les coûts indirects.
McGarry et al. (2004) ont analysé l'impact d'une ISO par Staph. Aureus sur les durées d'hospitalisation et les coûts entre 1994 et 2000 (3 groupes : 96 âgés de plus de 70 ans avec ISO, 131 plus jeunes avec ISO par S. aureus et 59 patients âgés non infectés).
Les patients âgés de plus de 70 ans avec ISO passaient 22 jours à l'hôpital (médiane) contre 7 jours pour les patients du même âge mais sans ISO, alors que les patients plus jeunes ayant également une ISO ne passaient que 14 jours.
Les coûts s'élevaient à 85 650 $ (médiane) pour les patients âgés de plus de 70 ans contre 32 000 $ pour une intervention sans ISO ; les coûts étaient de 45 770$ pour les patients plus jeunes ayant acquis une ISO par S. aureus.
Chez les patients âgés, l'infection à S. aureus constituait un facteur indépendant d'augmentation de la durée de séjour (à hauteur de 12 jours supplémentaires) et des coûts (multiplication par 2, soit de l'ordre de 40 000 $), une fois pris en compte les autres facteurs (diabète, insuffisance rénale, tumeurs...), par rapport aux patients âgés non infectés.
DiGiovine et al. (1999) ont évalué le coût des bactériémies primaires en soins intensifs à partir de l'analyse prospective de deux cohortes appariées après ajustement, sélectionnées parmi 3 003 patients admis dans un service de soins intensifs de médecine entre janvier 1994 et décembre 1996. L'infection nosocomiale entraîne 8 à 10 jours supplémentaires en soins intensifs en moyenne, et un coût supplémentaire d'au moins 24 000 $. Les coûts estimés sont plus importants si l'on ne considère que les patients ayant survécu.
Tambyah et al. (2002) ont estimé le coût des infections urinaires sur sonde urinaire à partir de l'analyse prospective d'une cohorte de 1 497 patients hospitalisés entre 1997 et 1998. Ils aboutissent à un coût supplémentaire de 589 $ par infection.
Slonim et al. (2001) ont estimé le coût des infections nosocomiales en réanimation pédiatrique à partir de l'analyse prospective de deux cohortes appariées après ajustement ; 38 paires ont été constituées à partir des admissions en réanimation entre août 1996 et juillet 1998. Leur estimation aboutit à un coût supplémentaire attribuable à l'infection nosocomiale de 43 267 $ et à une durée de séjour supplémentaire de 14,6 jours. Cette estimation ne porte que pour la partie du séjour passée en réanimation.
Roberts et al. (2003) estiment le coût des infections nosocomiales à partir de l'analyse rétrospective d'une cohorte de 246 patients admis en 1998 au Cook County Hospital de Chicago. Les auteurs montrent une corrélation importante entre le degré de sévérité de la maladie et la survenue d'une infection nosocomiale et donc les coûts, ainsi qu'une corrélation entre le passage en soins intensifs et le surcoût induit par les infections nosocomiales. Le coût supplémentaire par patient attribuable aux infections nosocomiales est de 15 275 $, une fois les deux facteurs pris en compte.
Payne et al. (2004) ont estimé le coût des infections nosocomiales chez les grands prématurés à partir de l'analyse rétrospective d'une cohorte de 2 809 grands prématurés admis dans les établissements participant à l'étude entre janvier 1998 et décembre 1999. L'augmentation du coût est inversement proportionnelle au poids à la naissance du bébé et à la durée de la grossesse. Le coût moyen additionnel varie entre 6 276 $ pour les bébés de 1251 g à 1500 g à 12 480 $ pour les bébés de 400 g à 750 g.
Saint et al. (2000) ont analysé le coût supplémentaire des infections consécutives à la pose d'un cathéter , à partir d'hypothèses d'incidence et d'augmentation de la durée de séjour attribuable à une bactériémie consécutive à la pose d'un cathéter (Pittet et al. : 6,5 jours en soins intensifs suivis de 6 jours en services cliniques).
Ce coût supplémentaire est d'environ 399 $ :
Coût de remplacement du cathéter : 264 $,
Coût des analyses de sang : 71$,
Coût des antibiotiques : 64 $.
Le coût journalier d'une hospitalisation est de 1 152 $ en soins intensifs et 375 $ en service clinique. En considérant les journées supplémentaires d'hospitalisation de l'étude de Pittet et al., le coût supplémentaire attribuable aux bactériémies est de 9 738$.
Hollenbeack et al. (2002) ont procédé à une analyse prospective de deux cohortes appariées (16 cas, 160 témoins) pendant 2 ans, afin d'analyser le coût supplémentaire des ISO.
Une première estimation, consistant en une simple comparaison à partir des deux cohortes non appariées, donne un coût moyen supplémentaire attribuable à l'infection nosocomiale de 20 012 $.
La deuxième estimation, qui en outre ajuste les variables pour apparier les cohortes, donne un coût moyen supplémentaire attribuable à l'infection nosocomiale de 19 579 $.
La troisième estimation utilise un modèle de régression multiple, et aboutit à un coût moyen supplémentaire attribuable à l'infection nosocomiale de 20 103 $. A noter que le diabète n'influe pas sur le coût supplémentaire.
La quatrième estimation procède à un redressement, en tenant compte de la probabilité qu'a le patient d'acquérir une IN eu égard à sa situation pathologique.
Les variables qui augmentent la probabilité de survenue de l'infection de façon significative sont l'obésité et l'insuffisance rénale.
Le coût moyen supplémentaire attribuable à l'infection nosocomiale est de 14 211 $.
Dominguez et al. (2001) ont estimé le coût attribuable aux infections nosocomiales à partir de l'analyse rétrospective d'une cohorte de 1 376 enfants admis en réanimation dans un centre hospitalier universitaire entre le 1 er juillet 1993 et le 30 juin 1994. Ils aboutissent, selon les méthodes d'ajustement, à un coût supplémentaire compris entre 32 040 $ et 48 236$, et à une augmentation de la durée de séjour comprise entre 9 et 17,5 jours. Cette estimation ne concerne que la partie du séjour passée en réanimation.
Une seule étude a estimé les coûts indirects ; il s'agit de l'étude menée par Lopman et al. sur le coût des gastro-entérites nosocomiales. Ils ont mesuré la perte de productivité des patients du fait des arrêts maladie, qu'ils ont estimée à 66 000 £ pour 1 000 lits.
Le tableau suivant récapitule ces résultats.
TABLEAU SYNTHÉTIQUE DES ESTIMATIONS DES COÛTS DES INFECTIONS NOSOCOMIALES
|
Auteur, année |
Pays |
Nombre et types d'infections |
Nature des coûts estimés Méthode |
Coûts des infections nosocomiales Impacts sur les durées de séjour |
|
ANAES Pittet et al, 1994 |
Etats-Unis |
97 patients (bactériémies) |
Surcoût moyen d'un patient infecté : 33 268$ |
|
|
ANAES Shulkin et al, 1993 |
Etats-Unis |
21 patients (toutes) |
Coût moyen par IN : 29 210 $ Coût moyen en excluant un patient très coûteux : 12 542$ |
|
|
ANAES Li et Wang, 1990 |
Chine |
60 patients (chir cardiaque) |
Coût moyen d'une IN : 290 £ |
|
|
ANAES Chaix et al, 1999 |
France |
27 patients (toutes) |
Coût moyen d'une IN : 9 275$ |
|
|
ANAES Coello et al, 1993 |
Espagne |
123 patients (toutes) |
Surcoût moyen par patient infecté : 2 646£ en orthopédie et 404£ en gynécologie |
|
|
ANAES French et Cheng, 1991 |
Hong Kong |
597 patients (toutes) |
Surcoût moyen en antibiotiques par patient : 190$ |
|
|
ANAES Garo et Boles, 1995 |
France |
31 patients (pneumopathies-bactériémies) |
Surcoût moyen par patient infecté : 22 422 F (service de réanimation) |
|
|
ANAES Gray et al, 1995 |
Etats-Unis |
53 patients (bactériémies) |
Coût moyen d'une IN : 25 090$ |
|
|
ANAES Bientz et al, 1994 |
France |
54 patients (infection urinaire) |
Coût moyen d'une IN : 2 070 F |
|
|
ANAES Brun-Buisson et al, 2003 |
France |
42 patients (septicémies) |
Coût moyen d'une IN : entre 26 256 et 35 185€ |
|
ANAES O'Donoghue et Allen, 1992 |
Royaume Uni |
10 patients (infection de plaie) |
Coût moyen par patient : 2 220 £ |
|
|
ANAES Leroyer et al, 1997 |
France |
34 nouveau-nés (toutes IN) |
5,2 jours en moyenne de plus pour les enfants infectés (std : 23,5) Coût associé : 52 192 FF |
|
|
ANAES Vegas et al, 1993 |
Espagne |
129 patients (toutes IN) |
7,3 jours (std :2,88) à 14,3 jours (std : 2,53) selon le type d'infection Coût associé : de 2 850 à 5 617$ |
|
|
ANAES Riley et al, 1995 |
Australie |
90 patients (diarrhée à clostridium difficile) |
Durée médiane de séjour pour les patients infectés : 24,5 jours 1,2 millions $ australiens (coût total de l'infection dans l'ES en 1990) |
|
|
ANAES Kappstein et al, 1992 |
Allemagne |
57 patients (pneumopathie de ventilation) |
10,1 jours en moyenne (std :21,5) Coût associé : 8 880$ |
|
|
Piednoir et al, 2003 |
France |
23 enfants (rotavirus) |
Coût directs Etude cas-témoin |
Coût moyen supplémentaire par enfant : 1 930 € (2002) Suppl. durée de séjour : 4,9 jours en moyenne chez les patients infectés |
|
Brun Buisson et al, 2003 |
France |
87 syndromes septiques / 81 syndromes septiques sévères / 56 chocs septiques |
Coûts directs en réanimation Etude prospective de cohorte |
Surcoût moyen par patient : IN en soins intensifs : 28 287 € IN dès l'admission : 6 152 € IN à l'admission et en soins intensifs : 36 427 € |
|
Adrie et al, 2005 |
France |
1 698 patients Sepsis sévère |
Coûts directs en réanimation Etude rétrospective de cohorte |
Sur coût moyen par patient en soins intensifs : variable selon type d'infections, entre 3 600 € (IN acquise avant, à 29 400 € (deuxième IN contractée en soins intensifs) Durée de séjour : + 2 à 20 jours |
|
Chaix et al, 1999 |
France |
25 patients IN à Staph en réanimation |
Coûts directs en réanimation Etude cas-témoin |
Coût moyen : Témoins : 20 950 $ Cas : 30 225 $ Surcoût : 9 275 $ 4 jours de durée de séjour suppl. (médiane) |
|
Abramson et al, 1999 Cité dans Lauria et al 2003 |
Etats-Unis |
IN à Staphylocoques |
Coût médian : Staph. méti sensible 9 661$ Staph. méti résistant : 27 083 $ |
|
|
Lauria et al, 2003 |
Italie |
Tous types IN Simulations |
Coût de l'augmentation de la durée de séjour × tarif journalier |
Coût total de 223 716 € pour un établissement avec 3 600 entrées, avec taux d'incidence de 5% |
|
Orsi et al, 2002 |
Italie |
Infection du sang 105 cas |
Coût de l'augmentation de la durée de séjour × tarif journalier et coût du traitement Etude rétrospective de 3 cohortes |
Coût supplémentaire par patient : 16 356 € pour l'ensemble des services (dont 15 413 € durée de séjour et 943 € traitement) Durée de séjour supplémentaire : entre 15,7 jours et 18,7 jours en soins intensifs, entre 21,9 jours et 24,6 jours en chirurgie |
|
Dietrich et al, 2002 |
Allemagne |
Pneumonie nosocomiale 93 cas au total, et 110 témoins |
Coûts directs Etude prospective de cohorte et étude rétrospective |
Coût additionnel par patient : -14 606 DM étude prospective - 29 610 DM étude rétrospective Durée moyenne de séjour suppl. en soins intensifs : 6,6 jours |
|
Pirson et al, 2005 |
Belgique |
46 cas d'infections nosocomiales |
Coûts directs Etude rétrospective cas-témoin |
Coût additionnel par patient : 12 853 € Et 11 443 € en soins intensifs Durée de séjour suppl. : 21,1 jours (7,2 en soins intensifs) |
|
Lopman et al, 2004 |
Angleterre |
Rotavirus (227 épidémies) |
Coût de la fermeture des lits et coût des journées d'absence du personnel contaminé |
Coût de la fermeture de 1 000 lits : 480 000 £ Coût d'absence du personnel pour 1000 lits : 1,97 millions de £ |
|
Plowman et al, 2001 |
Angleterre |
Toutes IN 309 IN (sur cohorte de 4000 patients) |
Coûts directs Analyse prospective |
Surcoût de 3154 £ en moyenne, plus important en chirurgie (4899 £) pour 14,1 jours supplémentaires Estimation pour toute l'Angleterre : 930 Millions de £ |
|
Coello et al, 2005 |
Angleterre |
ISO dans 140 hôpitaux : 2832 cas |
Durée de séjour x surcoût journalier de l'IN |
Surcoût variable selon intervention, autour de 3000 £ (max 6600 £ pour ISO profondes après prothèse de hanche) Durée de séjour : augmentation de 3 à 21 jours |
|
Elward et al, 2005 |
Etats-Unis |
Tous types (57 enfants) |
Coûts directs en soins intensifs pédiatriques |
Surcoût d'une IN en soins intensifs : 39 219 $ |
|
Whitehouse et al, 2002 |
Etats-Unis |
ISO après intervention orthopédique 59 cas |
Coûts directs Etude cas-témoins |
Durée médiane de séjour : 14 jours de plus dans la cohorte infectée sur 1 an Surcoût avec ISO : 17 708 $ |
|
McGarry et al, 2004 |
Etats-Unis |
ISO par Staph. Aureus 207 patients avec ISO (dont 96 de plus de 70 ans) |
Coûts directs |
Patients de plus de 70 ans avec ISO: 15 jours de plus que les patients de plus de 70 ans sans ISO, et 53 000 $ de coûts supplémentaires sur 1 an |
|
DiGiovine et al, 1999 |
Etats-Unis |
Bactériémie primaire (68 cas) |
Coûts directs Etude prospective de deux cohortes appariées |
Surcoût : 23 751 $ Durée de séjour totale : +4,9 jours (mais +7,6 jours en soins intensifs) |
|
Tambiah et al, 2002 |
Etats-Unis |
Patients hospitalisés avec sonde urinaire (123 patients infectés) |
Coûts directs Etude prospective de cohorte |
Coût additionnel : 589 $ par patient (1/3 pour examens de labo, 2/3 pour traitements) |
|
Slonim et al, 2001 |
Etats-Unis |
IN en réanimation pédiatrique (38 cas) |
Coûts directs Analyse prospective de 2 cohortes appariées |
Surcoût de l'IN : 43 267 $ Durée de séjour : +14,6 jours |
|
Roberts et al, 2003 |
Etats-Unis |
25 IN |
Coûts directs Etude rétrospective |
Surcoût moyen par patient infecté : avec passage en soins intensifs : 23 307 $ sans passage en soins intensifs : 8 681 $ |
|
Payne et al, 2004 |
Etats-Unis |
IN chez 553 grands prématurés |
Coûts directs Etude rétrospective |
Augmentation des durées de séjour : entre 4 et 7 jours Surcoûts : entre 6 276 $ et 12 480 $ |
|
Saint et al, 2000 |
Etats-Unis |
IN consécutive à la pose d'un cathéter |
Coûts directs (biblio, microcosting) |
Coût supplémentaire : 399 $ pour une infection locale 9 738 $ pour une bactériémie |
|
Hollenbeack et al, 2002 |
Etats-Unis |
ISO (16 cas) |
Coûts directs Analyse prospective |
Coût moyen supplémentaire compris entre 14 211 $ et 20 103 $. |
|
Dominguez et al, 2001 |
Etats Unis |
IN en réanimation (40 IN chez 30 enfants) |
Coûts directs Analyse rétrospective de cohorte |
Coût moyen supplémentaire par patient : 32 040 $ Durée médiane de séjour : +6,5 jours |
Trois études récentes ont comparé le coût des infections nosocomiales au coût des mesures de prévention .
Le rapport de l'ANAES (2004) cite deux études qui estiment le retour sur investissement des mesures de prévention des infections nosocomiales ; la première étude (Jarvis et al., 1996) l'estime positif aux Etats-Unis à partir d'un seuil minimal d'efficacité de 6% ; l'étude anglaise (Mehtar et al., 1995) estime que le coût de l'infection nosocomiale est six fois supérieur à celui de la prévention (4 463 € par infection).
Lauria et al. (2003) ont comparé le coût des infections nosocomiales et celui de leur prévention dans un établissement italien. Le coût du programme de prévention pour cet établissement est estimé à 128 727 € tandis que le coût des infections nosocomiales s'élèverait à 223 716 €.
Chaix et al. (1999) ont comparé le coût supplémentaire attribuable au staphylocoque en réanimation à celui du programme de prévention développé à l'Hôpital Henri Mondor. Ils estiment que les mesures de prévention (mesures d'isolement des patients infectés) présentent un ratio « coûts/bénéfices » favorable à partir d'un seuil d'efficacité de 14% (diminution des staphylocoques de 14%).
A noter aussi que Whitehouse et al. (2002) se livrent à un calcul du même ordre : un hôpital qui assurerait 5000 interventions orthopédiques par an pourrait économiser 350 000 $ par an en coûts directs en mettant en place un programme de prévention qui réduirait le taux d'ISO de 2% à 1% (par exemple prophylaxie antibiotique).
Conclusion
Il est difficile d'extrapoler le coût des infections nosocomiales à partir de ces études ; en dehors de la revue de l'ANAES, trois des études françaises sont monocentriques, la quatrième étude porte sur 6 services de réanimation de Centre Hospitalier Universitaire, qui sont susceptibles d'accueillir des patients plus lourds que des centres hospitaliers.
L'extrapolation à partir d'études étrangères est également hasardeuse, dans la mesure où les parcours de santé ne sont pas équivalents d'un pays à l'autre.
Et intrinsèquement, ces études diffèrent par le champ étudié, les populations de patients, le type de services cliniques concernés, les méthodes de calcul des coûts, si bien qu'il est difficile de dresser une synthèse.
Plusieurs points ressortent toutefois de cette analyse bibliographique :
o Les estimations du surcoût induit par les infections nosocomiales varient en fonction du site de l'infection, de la nature du germe, de la pathologie sous-jacente, mais aussi du service d'hospitalisation ; le coût supplémentaire induit est plus important en soins intensifs.
o Les surcoûts sont essentiellement liés à la prolongation de la durée de séjour (souvent plus d'une semaine), et pour un pourcentage plus modeste (moins de 10%), à l'antibiothérapie. Le degré de sévérité de la pathologie du patient doit être pris en compte dans l'évaluation des coûts ; il existe une corrélation entre le degré de gravité de la pathologie et les coûts de prise en charge. Cette observation conduit à rendre nécessaire le redressement de données sur les IN en fonction de la gravité de la pathologie et de l'état du patient pour tenter une extrapolation.
o Les coûts non médicaux sont exceptionnellement calculés, et les coûts intangibles (perte de qualité de vie) jamais.
o Le problème de différencier les IN évitables des IN non évitables est peu abordé, et on ne peut établir s'il existe une différence de surcoûts entre les deux types d'IN.
o o o Les fourchettes obtenues sont extrêmement larges. Si on en reste aux IN observées en soins intensifs (bactériémies), on constate constamment des chiffres de surcoûts très élevés, entre 25 000 et 40 000 euros. Le surcoût des infections urinaires est à l'inverse plus modeste, de 338 à 589 € par patient.
o Il est donc très difficile de donner un montant de surcoût lié aux IN en France (a fortiori des IN évitables). L'estimation de l'ordre de 200 millions d'euros pour les IN évitables en réanimation, effectuée à partir des données de Brun-Buisson et al. par l'ANAES (2004) donne toutefois un ordre de grandeur. Ce calcul doit cependant être amendé compte tenu des estimations suivantes :
o le nombre de séjours dans les services de réanimation des établissements en France est de 264 458 (DGS, 2002) ;
o le surcoût moyen d'un séjour d'un patient atteint d'une infection nosocomiale en réanimation serait de l'ordre de 6 152 $ à 36 427 $ selon les situations (Brun Buisson et al., 2003) ;
o l'incidence de l'infection des IN en réanimation est d'environ 15-20% ;
o la proportion d'IN évitables en réanimation est au maximum de 20% d'après des études américaines anciennes (des études plus récentes tendent à abaisser cette estimation) ;
o le coût annuel des IN survenant dans les services de réanimation en France serait donc :
o 0,15 * 264458 * [6 152 - 36 427 $] * 0,2 = [49-289] millions $, pour les coûts directs des IN évitables en réanimation.
Si on adopte un raisonnement plus global et que l'on considère qu'il y a entre 700 000 et 750 000 IN en hospitalisation chaque année dans les établissements de santé français. Compte tenu de l'ensemble des données de coûts analysées et de la répartition de ces IN par localisation (40% d'infections urinaires, 10% d'ISO, etc.), on peut adopter une fourchette de surcoût moyen attribuable à l'IN, toutes localisations confondues, de l'ordre de 3 500 à 8 000 € par IN (fourchette assez large, compte tenu de la variabilité des études 13 ( * ) ).
Si on reprend le taux d'évitabilité classique (sans doute sur-estimé aujourd'hui) de 30%, on atteint un montant de dépenses estimées pour les IN évitables au total de :
[700 000 - 750 000] * 0,3 * [3 500 - 8 000] = 0,73 à 1,8 milliards d'euros.
En d'autres termes, une politique qui consisterait à abaisser de 7 à 6,3% le taux d'IN en France (soit -10%, ce qui, selon ces estimations, consiste à éviter le tiers des IN considérées comme évitables) équivaudrait à une économie de 240 à 600 millions d'euros.
A quoi comparer ces données de coûts ?
Il est difficile de faire le bilan de l'ensemble des dépenses engagées pour lutter contre les IN en France : organisation des CLIN, des EOHH, des CCLIN, surveillance par le RAISIN et enquêtes régulières, formations, etc. Les principaux postes de coûts sont cependant au sein des établissements.
2 424 établissements ont produit un bilan de l'activité en matière d'IN (source DHOS) sur l'année 2004 ; 69% disposaient d'une EOHH (soit 1672 établissements) dont 46% conformes aux recommandations. La circulaire du 29 décembre 2000 stipulait que la cible devait être de 1 IDE pour 400 lits et 1 ETP de médecin ou pharmacien pour 800 lits. Respectivement 34% et 24% des établissements respectaient ces objectifs en 2004.
Si on suppose qu'une EOH coûte en moyenne 60 000 euros par établissement (équivalent de 0,2 ETP de médecin, 0,5 ETP d'IDE, 0,1 ETP d'un autre personnel, en moyenne, toutes charges sociales incluses, avec 20% en sus de charges de structure), toutes tailles d'établissement confondues, la dépense totale serait de l'ordre de 100 millions d'euros.
Il ne s'agit pas ici de donner un calcul précis mais de donner l'ordre de grandeur. On constate que face au risque financier représenté par les IN, des moyens significatifs ont été mis en place.
Il faut même prendre garde à ne pas alourdir exagérément les structures et les procédures, et donc les dépenses engagées, qui doivent rester proportionnées aux risques.
Néanmoins, nous avons vu que les études réalisées sur le ratio coût/bénéfice des interventions de prévention des IN montrent un impact économique favorable dès lors que les mesures de prévention permettent de diminuer le taux d'IN dans une certaine proportion ; aux Etats-Unis, il a été ainsi estimé qu'une baisse de prévalence des IN de 6% permettait d'équilibrer le coût du programme (qui a d'autres avantages par ailleurs en termes de morbidité).
|
Synthèse Les surcoûts attribuables aux IN ont été évalués à de nombreuses reprises dans la littérature, mais avec des champs d'investigation et des méthodes variables. Même s'il est difficile de compiler l'ensemble des résultats, il ressort que les surcoûts varient suivant le type d'IN, le type de germe, le site de l'infection, le type d'unité d'hospitalisation, les facteurs de risque dont est atteint le patient, et la pathologie sous-jacente. Ces surcoûts varient entre 500 € (infection urinaire) et 40 000 € (bactériémies les plus sévères en réanimation). Ils sont essentiellement liés à la prolongation des durées de séjour. Une estimation grossière du surcoût total des IN en France donne une fourchette de 0,73 à 1,8 milliards d'euros. Une baisse de 10% du taux d'IN (objectif accessible compte tenu du taux d'évitabilité habituellement retenu) conduirait à une économie de 240 à 600 millions. Face à ces perspectives, des moyens significatifs ont été mis en oeuvre. On peut chiffrer l'effort réalisé dans les établissements à environ 100 millions d'euros, cet effort étant en croissance. Les mesures de prévention des IN présentent donc un rapport coût/bénéfice favorable. |
E. L'ORGANISATION DE LA LUTTE CONTRE LES INFECTIONS NOSOCOMIALES
L'organisation de la lutte contre les infections nosocomiales en France est une préoccupation de santé publique ancienne . Les premiers textes officiels datent des années 1970.
Nous allons en retracer les principales étapes, pour nous arrêter plus particulièrement sur les derniers développements, notamment à travers le programme de lutte contre les IN 2005-2008, et l'inscription de cette politique de façon plus large dans une gestion coordonnée des risques en établissements de santé. Les principaux textes de référence sont en annexe.
Les premières étapes, la structuration de la politique de lutte contre les IN
Une résolution du comité des ministres du conseil de l'Europe datant du 19 septembre 1972 invite les états membres à mettre en place des mesures relatives à l'hygiène hospitalière.
En France , la circulaire du 18 octobre 1973 relative à la prévention des infections hospitalières complétée par celle du 1 er septembre 1975 attire l'attention des établissements de santé publics sur la nécessité de mettre en place un comité de lutte contre l'infection dans chaque établissement public de santé en précisant la composition de celui-ci.
Le décret du 6 mai 1988 relatif à l'organisation de la surveillance et de la prévention des infections nosocomiales dans les établissements de santé publics ou participant au service public rend obligatoire la mise en place des comités de lutte contre les infections nosocomiales (CLIN).
Les missions de ces comités sont :
o Organiser et coordonner une surveillance continue des infections nosocomiales dans l'établissement,
o Promouvoir les actions de formations des personnels de l'établissement dans la surveillance et la lutte contre les infections nosocomiales,
o Transmettre chaque année au directeur de l'établissement, qui le soumet pour examen à l'assemblée délibérante et à la commission médicale d'établissement, un rapport d'activité et lui proposer un programme d'actions de prévention à mettre en oeuvre au cours de l'année suivante. Ce rapport d'activité est transmis à la DDASS qui le transmet à la DRASS qui établit un bilan régional, transmis ensuite au Ministère de la santé.
o Fournir les données de surveillance à transmettre à la DDASS.
o Peut proposer toute recommandation visant à limiter le développement des infections et donner son avis à la demande de la direction de l'établissement sur les aménagements de locaux et acquisitions d'équipements ou matériels susceptibles d'avoir une répercussion sur la prévention et la transmission des infections.
Chaque CLIN comprend 12 membres dont le président et le vice-président de la commission médicale d'établissement.
L'arrêté du 3 août 1992 instaure :
o Le comité national de lutte contre les infections nosocomiales (CTIN), chargé :
de proposer la définition du programme national de lutte contre les infections nosocomiales,
de promouvoir avec le réseau national de santé publique (RNSP qui deviendra l'InVS) un système national de surveillance de ces infections reposant sur les centres de coordination de lutte contre les infections nosocomiales (CCLIN),
de formuler et mettre à jour des recommandations techniques sur la surveillance et la prévention des infections nosocomiales pour les personnels de santé, les organismes publics ou privés de prévention et de soins et pour les CLIN,
d'assurer la coordination des activités et l'évaluation des actions menées par les CCLIN,
de fournir un rapport national annuel élaboré à partir des bilans établis par les DDASS et DRASS,
de faire toute proposition relative à la formation des personnels, au développement de recherches et au financement du programme national de lutte contre les infections nosocomiales
Le CTIN est composé de personnalités qualifiées, du représentant de chaque CCLIN et de représentants des institutions (ministères de la Santé, caisse d'assurance maladie)
o Les 5 centres de coordination de lutte contre les infections nosocomiales (CCLIN) implantés dans les CHU chargés de :
La coordination des actions de lutte contre les infections nosocomiales conduites par les établissements de santé,
L'organisation du recueil épidémiologique standardisé d'incidence et de prévalence des infections nosocomiales,
La mise au point de protocoles d'investigations épidémiologiques,
La réalisation d'études épidémiologiques multicentriques sur les risques infectieux et leur prévention,
L'assistance technique aux établissements de santé lors de la survenue de cas groupés d'infections nosocomiales et lors des programmes de formation ou selon la demande des établissements de santé ou organismes publics de prévention et de soins,
La tenue d'un annuaire de prestataires de services en hygiène hospitalière,
La veille bibliographique et réglementaire,
La fourniture au CTIN d'un rapport annuel d'activité.
Les 5 CCLIN sont organisés en inter-régions, selon la carte ci-après.
|
|
Le premier plan national de lutte contre les infections nosocomiales a été annoncé en novembre 1994 . Dans l'objectif de réduire les infections nosocomiales et la fréquence des bactéries multi-résistantes aux antibiotiques, il décline plusieurs axes de travail :
o le renforcement des structures de lutte contre les infections nosocomiales et l'incitation des établissements à adopter une politique de prévention et de maîtrise des infections nosocomiales,
o l'élaboration et la diffusion de recommandations de bonnes pratiques d'hygiène,
o l'amélioration de la formation des professionnels de santé dans le domaine de l'hygiène et de la qualité des soins,
o le développement d'un programme national de surveillance et l'évaluation de l'impact du plan.
De nombreuses circulaires viennent préciser les actions engagées.
La circulaire du 19 avril 1995 relative à la lutte contre les infections nosocomiales dans les établissements hospitaliers vient préciser la mise en oeuvre de la prévention des infections nosocomiales dans les établissements hospitaliers, les nouveaux objectifs de prévention et de surveillance, le rôle des équipes opérationnelles en hygiène hospitalière, la mise en place de référents en hygiène hospitalière dans les services, les liens des comités de lutte contre les infections nosocomiales avec les structures intra et extra-hospitalières (cf. annexe 1).
La circulaire du 27 mars 1996 précise les modalités de la réalisation de la première enquête nationale de prévalence « un jour donné » des infections nosocomiales dans les établissements hospitaliers afin de sensibiliser l'ensemble des établissements de santé à l'importance quantitative des infections nosocomiales mais aussi de favoriser l'identification des priorités d'actions de prévention à mettre en oeuvre.
Ce sont les premières données fiables dont dispose la France dans ce domaine.
La circulaire du 2 avril 1996 résume les recommandations pour la désinfection des endoscopes.
La circulaire du 27 juin 1997 établit le circuit et modèle des rapports d'activités 1996 des comités de lutte contre les infections nosocomiales.
La circulaire du 17 juillet 1998 établit le modèle des rapports d'activités 1997 des comités de lutte contre les infections nosocomiales.
La circulaire du 4 mai 1999 établit le modèle des rapports d'activités 1998 des comités de lutte contre les infections nosocomiales.
La loi du 1er juillet 1998, relative « au renforcement de la veille sanitaire, et au contrôle de la sécurité sanitaire des produits destinés à l'homme » et le décret du 6 décembre 1999, qui abroge le décret du 6 mai 1988, inscrivent dans les missions des établissements de santé, la lutte contre les infections nosocomiales (Article L. 6111-1 du code santé publique) et étendent ce dispositif aux cliniques privées.
Article L6111-1
(Loi n° 2002-303 du 4 mars 2002 art. 5, art. 23 III Journal Officiel du 5 mars 2002)
Les établissements de santé, publics et privés, assurent les examens de diagnostic, la surveillance et le traitement des malades, des blessés et des femmes enceintes en tenant compte des aspects psychologiques du patient.
Ils participent à des actions de santé publique et notamment à toutes actions médico-sociales coordonnées et à des actions d'éducation pour la santé et de prévention.
Ils participent à la mise en oeuvre du dispositif de vigilance destiné à garantir la sécurité sanitaire, notamment des produits mentionnés à l'article L. 5311-1, et organisent en leur sein la lutte contre les infections nosocomiales et les affections iatrogènes dans les conditions prévues par voie réglementaire.
Ils mènent, en leur sein, une réflexion sur les questions éthiques posées par l'accueil et la prise en charge médicale.
Les établissements de santé mettent en place un système permettant d'assurer la qualité de la stérilisation des dispositifs médicaux répondant à des conditions définies par voie réglementaire.
Article L6144-1
(Loi n° 2002-73 du 17 janvier 2002 art. 1 IV Journal Officiel du 18 janvier 2002)
(Loi n° 2002-303 du 4 mars 2002 art. 84 II Journal Officiel du 5 mars 2002)
(Loi n° 2003-1199 du 18 décembre 2003 art. 29 II a Journal Officiel du 19 décembre 2003 en vigueur le 1er janvier 2005)
(Ordonnance n° 2005-406 du 2 mai 2005 art. 3 I Journal Officiel du 3 mai 2005)
(Ordonnance n° 2005-1112 du 1 septembre 2005 art. 1 IX Journal Officiel du 6 septembre 2005)
I. - Dans chaque établissement public de santé, il est créé une commission médicale d'établissement dotée de compétences consultatives et appelée à préparer, avec le directeur dans les hôpitaux locaux et avec le conseil exécutif dans les autres établissements publics de santé, des décisions dans des matières et dans des conditions fixées par voie réglementaire.
II. - La commission médicale d'établissement comporte au moins une sous-commission spécialisée, créée par le règlement intérieur de l'établissement, en vue de participer par ses avis à l'élaboration de la politique d'amélioration continue de la qualité et de la sécurité des soins, notamment en ce qui concerne :
1° Le dispositif de vigilance destiné à garantir la sécurité sanitaire des produits de santé mentionnés à l'article L. 5311-1 ;
2° La lutte contre les infections nosocomiales mentionnée à l'article L. 6111-1 ;
3° La définition de la politique du médicament et des dispositifs médicaux stériles et l'organisation de la lutte contre les affections iatrogènes mentionnées au dernier alinéa de l'article L. 5126-5 ;
4° La prise en charge de la douleur mentionnée à l'article L. 1112-4.
Cette sous-commission ou ces sous-commissions spécialisées comportent, outre des membres désignés par la commission médicale d'établissement, les professionnels médicaux ou non médicaux dont l'expertise est nécessaire à l'exercice de ces missions.
Le décret du 6 décembre 1999 relatif à l'organisation de la lutte contre les infections nosocomiales dans les établissements de santé et modifiant le chapitre 1 er du titre 1 er du code de la santé publique (article R. 6111-1 à R. 6111-10) décrit les conditions réglementaires de l'application de la loi de sécurité sanitaire de 1998.
Article R 6111-1
Chaque établissement de santé organise en son sein la lutte contre les infections nosocomiales, y compris la prévention de la résistance bactérienne aux antibiotiques. A cet effet, chaque établissement de santé institue en son sein un Comité de lutte contre les infections nosocomiales, se dote d'une équipe opérationnelle d'hygiène hospitalière et définit un programme annuel d'actions tendant à assurer :
1° La prévention des infections nosocomiales, notamment par l'élaboration et la mise en oeuvre de recommandations de bonnes pratiques d'hygiène ;
2° La surveillance des infections nosocomiales ;
3° La définition d'actions d'information et de formation de l'ensemble des professionnels de l'établissement en matière d'hygiène hospitalière et de lutte contre les infections nosocomiales ;
4° L'évaluation périodique des actions de lutte contre les infections nosocomiales, dont les résultats sont utilisés pour l'élaboration des programmes ultérieurs d'actions.
Article R.6111-2
Le Comité de lutte contre les infections nosocomiales :
1° Coordonne l'action des professionnels de l'établissement de santé dans les domaines mentionnés à l'article R. 6111-1 ;
2° Prépare, chaque année, avec l'équipe opérationnelle d'hygiène hospitalière le programme d'actions de lutte contre les infections nosocomiales ;
3° Elabore le rapport annuel d'activité de la lutte contre les infections nosocomiales ; ce rapport d'activité peut être consulté sur place, sur simple demande ; il comporte le bilan des activités, établi selon un modèle défini par arrêté du ministre chargé de la santé ; ce bilan est transmis annuellement, par le représentant légal de l'établissement de santé, à la direction départementale des affaires sanitaires et sociales et au centre de coordination de la lutte contre les infections nosocomiales.
Dans le cadre de ses missions, le comité est notamment chargé de définir, en relation avec les professionnels de soins, les méthodes et indicateurs adaptés aux activités de l'établissement de santé permettant l'identification, l'analyse et le suivi des risques infectieux nosocomiaux.
Le comité est consulté lors de la programmation de travaux, l'aménagement de locaux ou l'acquisition d'équipements susceptibles d'avoir une répercussion sur la prévention et la transmission des infections nosocomiales dans l'établissement.
Article R.6111-3
(Décret n° 2005-1656 du 26 décembre 2005 art. 6 I Journal Officiel du 28 décembre 2005)
Le programme d'actions et le rapport d'activité sont soumis, dans les établissements publics de santé, à l'avis de la commission médicale d'établissement et de la commission des soins infirmiers, de rééducation et médico-techniques, de réadaptation et médico-techniques dans les établissements de santé privés participant au service public hospitalier, à l'avis de la commission médicale d'établissement et, dans les autres établissements de santé privés, à l'avis de la conférence médicale.
Le programme d'actions et le rapport d'activité, après délibération du conseil d'administration dans les établissements publics de santé ou de l'organe qualifié dans les établissements de santé privés, sont transmis au comité d'hygiène, de sécurité et des conditions de travail.
Dans les établissements publics de santé et les établissements de santé privés participant au service public hospitalier, le projet d'établissement définit les objectifs généraux en matière de lutte contre les infections nosocomiales.
Article R6111-8
Chaque établissement de santé constitue une équipe opérationnelle d'hygiène hospitalière comportant le personnel, notamment médical, pharmaceutique et infirmier nécessaire à la mise en oeuvre des actions de lutte contre les infections nosocomiales. Ce personnel suit une formation adaptée à ses fonctions.
Les établissements de santé peuvent satisfaire à l'obligation de se doter d'une telle équipe opérationnelle d'hygiène hospitalière par la voie d'une action de coopération inter-établissements.
Article R6111-9
Le livret d'accueil prévu à l'article L. 1112-2 comporte une information synthétique, définie après avis du Comité de lutte contre les infections nosocomiales, sur la lutte contre ces infections dans l'établissement.
Article R6111-10
Le comité local de lutte contre les infections nosocomiales de chaque hôpital ou groupe hospitalier de l'Assistance Publique-Hôpitaux de Paris, des Hospices Civils de Lyon et de l'Assistance Publique de Marseille exerce les missions définies à l'article R. 6111-2 au sein de l'hôpital ou du groupe hospitalier, dans le cadre de la politique générale définie par le comité de lutte contre les infections nosocomiales de l'établissement.
La composition du comité local de lutte contre les infections nosocomiales est arrêtée dans les conditions prévues à l'article R. 6111-4 par le conseil d'administration
Article R6111-11
Chaque hôpital ou groupe hospitalier de l'Assistance Publique-Hôpitaux de Paris, des Hospices Civils de Lyon et de l'Assistance Publique de Marseille constitue une équipe opérationnelle d'hygiène hospitalière comportant le personnel, notamment médical, pharmaceutique et infirmier nécessaire à la mise en oeuvre des actions de lutte contre les infections nosocomiales. Ce personnel suit une formation adaptée à ses fonctions.
Ainsi,
o Les équipes opérationnelles de lutte contre les infections nosocomiales évoquées déjà dans la circulaire d'avril 1995 sont rendues obligatoires dans chaque établissement de santé par le décret du 6 décembre 1999 (article R.711-1-9 du code de santé publique) ;
o Selon l'article R. 711-1-2, chaque établissement de santé doit établir chaque année un bilan des activités de lutte contre les infections nosocomiales établies en son sein selon un modèle défini par arrêté et le transmette aux autorités de tutelle (DDASS) qui les transmettent aux DRASS pour une synthèse régionale transmise alors au ministère de la Santé (cellule DGS/DHOS des infections nosocomiales) qui établit un bilan annuel national.
L'arrêté du 17 octobre 2000 relatif au bilan annuel standardisé des d'activités de lutte contre les infections nosocomiales dans les établissements de santé définit le modèle de ce bilan qui est transmis à la DDASS.
La circulaire du 29 décembre 2000 complète et précise ce dispositif via notamment la notion de correspondants en hygiène hospitalière, relais du CLIN dans chaque service des établissements de santé (cf. annexe 2).
La surveillance épidémiologique est améliorée dès 2001 par la mise en place effective sous l'égide du réseau d'alerte, d'investigation, et de surveillance des infections nosocomiales (RAISIN) en lien avec l'InVS , d'une surveillance nationale harmonisée et coordonnée concernant les infections du site opératoire, les bactéries multi-résistantes, les bactériémies, les accidents avec exposition au sang et les infections en réanimation, afin de définir des indicateurs nationaux de résultats et établir des priorités.
Une deuxième enquête de prévalence « un jour donné » est mise en place via la circulaire du 18 janvier 2001 , afin de mobiliser les établissements de soins privés dans la politique de lutte contre les infections nosocomiales.
La circulaire du 30 mai 2001 relative au bilan standardisé des activités de lutte contre les infections nosocomiales dans les établissements de santé défini par l'arrêté du 17 octobre 2000 définit les modalités de recueil, de saisie et d`analyse de ce bilan.
Le décret du 26 juillet 2001 relatif à la lutte contre les infections nosocomiales dans les établissements de santé, modifie le code de la santé publique en créant les articles réglementaires qui instaurent le signalement de certaines infections afin notamment d'améliorer la prise en charge et la prévention des événements infectieux nosocomiaux nécessitant une intervention des autorités sanitaires.
Article R6111-12
Les établissements de santé signalent de façon non nominative la survenue de toute infection nosocomiale et recueillent les informations concernant les infections nosocomiales soumises à signalement.
Le signalement peut porter sur plusieurs cas d'infections nosocomiales, notamment lorsque les caractéristiques ou modalités de survenue du ou des premiers cas ne permettent pas d'emblée de répondre aux critères de signalement.
Article R6111-13
Sont signalés conformément à l'article R. 6111-12 :
1° Les infections nosocomiales ayant un caractère rare ou particulier, par rapport aux données épidémiologiques locales, régionales ou nationales, du fait :
a) Soit de la nature, des caractéristiques ou du profil de résistance aux anti-infectieux de l'agent pathogène en cause ;
b) Soit de la localisation de l'infection chez les personnes atteintes ;
c) Soit de l'utilisation d'un dispositif médical ;
d) Soit de procédures ou pratiques pouvant exposer ou avoir exposé, lors d'un acte invasif, d'autres personnes au même risque infectieux ;
2° Tout décès lié à une infection nosocomiale ;
3° Les infections nosocomiales suspectes d'être causées par un germe présent dans l'eau ou dans l'air environnant ;
4° Les maladies faisant l'objet d'une transmission obligatoire de données individuelles à l'autorité sanitaire en application de l'article R. 3113-2 et dont l'origine nosocomiale peut être suspectée.
Article R6111-14
Dans chaque établissement de santé, le recueil des informations concernant les infections nosocomiales devant être signalées est organisé selon des modalités définies par le Comité de lutte contre les infections nosocomiales.
Article R6111-15
Dans chaque établissement de santé, le responsable de l'établissement désigne, après avis du Comité de lutte contre les infections nosocomiales, le professionnel de santé chargé de leur signalement aux autorités sanitaires, ainsi que son suppléant.
Il en informe le directeur départemental des affaires sanitaires et sociales et le directeur du centre de coordination de la lutte contre les infections nosocomiales.
Article R6111-16
Tout médecin, pharmacien, chirurgien-dentiste, sage-femme ou membre du personnel paramédical qui, dans l'exercice de ses missions au sein d'un établissement de santé, constate un ou plusieurs cas d'infections nosocomiales, en informe, d'une part, le médecin responsable du service dans lequel le ou les cas sont apparus dans les établissements publics autres que les hôpitaux locaux ou le médecin responsable du ou des patients dans les autres établissements de santé et, d'autre part, le praticien de l'équipe opérationnelle d'hygiène hospitalière mentionnée à l'article R. 6111-8.
Le praticien de l'équipe opérationnelle d'hygiène hospitalière apprécie si le ou les cas dont il a été avisé correspondent aux critères de signalement énoncés à l'article R. 6111-13. Lorsque ce ou ces cas correspondent à l'un de ces critères, ce praticien, lorsqu'il n'est pas le professionnel de santé désigné à l'article R. 6111-15, informe ce dernier de la nécessité d'un signalement aux autorités sanitaires.
Article R6111-17
Lorsqu'un ou plusieurs cas d'infections nosocomiales ont été détectés et que leur nature correspond à un ou plusieurs des critères de signalement définis à l'article R. 6111-13, le professionnel de santé chargé du signalement y procède par écrit sans délai auprès du directeur départemental des affaires sanitaires et sociales et du directeur du centre de coordination de la lutte contre les infections nosocomiales de l'interrégion. Il informe de la transmission de ce signalement le responsable du service dans lequel le ou les cas sont apparus dans les établissements publics autres que les hôpitaux locaux, le médecin responsable du ou des patients dans les autres établissements de santé, le président du comité de lutte contre les infections nosocomiales, lorsqu'il n'est pas lui-même le professionnel de santé chargé du signalement aux autorités sanitaires, et le représentant légal de l'établissement.
Le nombre annuel de signalements dans l'établissement est indiqué dans le bilan des activités de la lutte contre les infections nosocomiales mentionné à l'article R. 6111-2.
La circulaire du 22 janvier 2004 précise le cadre légal et décrit le signalement des infections nosocomiales et l'information des patients dans les établissements de santé (cf. annexe 3).
Une fiche de signalement est ainsi établie.
L'arrêté du 11 juin 2002 relatif au bilan annuel des activités de lutte contre les infections nosocomiales des établissements de santé abroge l'arrêté du 17 octobre 2000 et définit le modèle de ce bilan à transmettre aux DDASS (cf. annexe 4).
Les circulaires du 31 mars 2003 et du 5 février 2004 relatives au bilan standardisé des activités de lutte contre les infections nosocomiales dans les établissements de santé pour 2002 définissent les modalités de recueil, saisie et analyse des données selon le bilan défini par cet arrêté du 11 juin 2002.
C'est l'exploitation de ce bilan qui donnera lieu à l'établissement du score ICALIN (cf. ci-après).
Le décret du 4 avril 2003 relatif au caractère de gravité des accidents médicaux, affections iatrogènes et infections nosocomiales prévue par l'article L. 1142-1 du code de la santé publique issue de la loi du 4 mars 2002 relative au droit des malades définit les conditions d'indemnisation des patients.
La préparation et le lancement du programme 2005-2008, les mesures en cours de déploiement
L'arrêté du 23 septembre 2004 porte création d'un comité technique des infections nosocomiales et des infections liées aux soins (CTINILS) et modifie l'arrêté du 3 août 1992 relatif à l'organisation des infections nosocomiales, comité placé auprès du Conseil supérieur d'hygiène publique de France, section maladies transmissibles, qui comprend 20 personnalités qualifiées, dont le président est nommé par le Ministre de la Santé et dont les missions sont :
o de fournir une expertise en matière d'évaluation et de gestion du risque infectieux chez l'home en milieu de soin,
o d'élaborer des avis ou recommandations à la prévention du risque infectieux chez l'homme en milieu de soins et aux bonnes pratiques d'hygiène,
o d'examiner toute question d'ordre scientifique ou technique relative au risque infectieux chez l'homme en milieu de soin.
Le comité peut être saisi par le ministre de la santé de toute question relevant de son domaine.
Le programme national de lutte contre les infections nosocomiales 2005/2008 est annoncé par le ministre de la santé.
La circulaire du 13 décembre 2004 relative à la mise en oeuvre du programme national de lutte contre les infections nosocomiales 2005/2008 dans les établissements de santé décline les priorités d'actions à mettre en oeuvre jusqu'en 2008 autour de cinq axes majeurs :
1. Adapter les structures et faire évoluer le dispositif de lutte contre les infections nosocomiales
2. Améliorer l'organisation des soins et les pratiques des professionnels
3. Optimiser le recueil et l'utilisation des données de surveillance et du signalement des infections nosocomiales
4. Mieux informer les patients et communiquer sur le risque infectieux lié aux soins
5. Promouvoir la recherche sur les mécanismes, l'impact, la prévention et la perception des infections nosocomiales
Ce programme sera évalué sur l'atteinte d'objectifs nationaux quantifiés en 2008, démarche originale dans un tel domaine, avec notamment les objectifs suivants :
o 100% des établissements doivent disposer d'une équipe opérationnelle d'hygiène hospitalière (EOHH) [69% en 2004, mais toutes les EOH ne sont pas encore aux normes (1 ETP d'IDE pour 400 lits, 1 ETP de médecin ou pharmacien pour 800 lits] ;
o 75% des établissements doivent réaliser un audit des bonnes pratiques [32% en 2004] ; le thème national proposé pour 2005-2006 est l'hygiène des mains par friction avec des solutions hydro-alcooliques ;
o Généralisation de la surveillance des infections du site opératoire [53% des établissements en 2004, mais sans toujours atteindre l'exhaustivité des services par établissement] ;
o 100% des établissements ont des protocoles de bon usage des antibiotiques [42% en 2004] ;
o 100% des établissements présentent dans le livret d'accueil leur programme de lutte contre les infections nosocomiales [77% en 2004].
L'annexe 5 fournit le détail de ce programme 14 ( * ) .
La circulaire du 18 février 2005 annonce un contrôle qualité sur les données déclarées dans le bilan standardisé des activités de lutte contre les infections nosocomiales pour 2004.
La circulaire du 30 mai 2005 relative au contrôle qualité des données déclarées dans le bilan standardisé des activités de lutte contre les infections nosocomiales pour 2004 décline la méthodologie qui conduit à élaborer le premier indicateur du tableau de bord des infections nosocomiales, l'indice ICALIN : indice composite des activités de lutte contre les infections nosocomiales (cf. ci-après).
La circulaire du 11 août 2005 relative à la stratégie nationale d'audit des pratiques d'hygiène hospitalière s'inscrit dans le programme national de lutte contre les infections nosocomiales.
Le bilan des activités de lutte des infections nosocomiales de 2001 à 2003 montre que seuls 30% des établissements de santé déclarent avoir réalisé un audit de bonnes pratiques. L'objectif du programme national est d'atteindre un taux de 75% ; aussi le groupe de pilotage du programme national a retenu comme première thématique nationale « l'hygiène des mains par friction hydroalcoolique ».
Cette circulaire diffuse le document méthodologique « réussir un audit clinique et son plan d'amélioration » (2003) et l'avis du comité technique national des infections nosocomiales (CTIN) du 5 décembre 2001 sur la place des solutions hydroalcooliques (SHA) dans l'hygiène des mains lors des soins, et précise que les établissements devront réaliser cet audit avant juin 2006, audit qui sera mentionné dans le bilan d'activité des infections nosocomiales.
L'arrêté du 14 novembre 2005 porte création du groupe de pilotage du programme national de lutte contre les infections nosocomiales qui est chargé :
o du suivi des actions prévues dans le programme,
o de faire des propositions sur les méthodes d'évaluation du programme,
o d'assurer la coordination des actions des CCLIN,
o de donner un avis sur l'organisation de dispositif de lutte contre les infections nosocomiales,
o de veiller à l'articulation avec les autres actions de santé publique (antibiotiques, gestion des risques).
Ce comité est composé 20 membres de représentants institutionnels (Ministère, InVS, ARH, des établissements de santé publics et privés), le président du CTINILS, les représentants des CCLIN, des usagers et quatre personnalités qualifiées.
Le coordonnateur du groupe de pilotage est nommé par le ministre de la Santé pour la durée du programme national et de son évaluation.
Enfin, une 3 ème enquête nationale de prévalence (ENP) vient d'être lancée et se déroulera dans les établissements de santé en juin 2006 pour une publication des résultats en 2007
La participation des établissements de santé français à ce type d'enquête est croissante : 830 avaient participé en 1996 et 1 533 en 2001. Les données des deux précédentes ENP suggèrent une baisse de la prévalence des infections nosocomiales en France.
Entre 1996 et 2001, la prévalence (hors infections urinaires asymptomatiques) est passée de 8,3% à 7,2% dans les centres hospitaliers universitaires, et de 6,5% à 5% dans les centres hospitaliers généraux.
La France se situait alors dans la médiane des prévalences habituellement observées lors d'enquêtes conduites entre 1990 et 2005 dans d'autres pays européens (entre 3,5% et 10%).
Parallèlement, un dispositif visant à améliorer l'information des patients est mis en place : une mission nationale d'information et de développement de la médiation sur les infections nosocomiales (IDMIN) confiée à la Haute Autorité de Santé (HAS) afin de renforcer le dialogue entre les usagers du système de soins et les professionnels de santé est créée depuis le 6 mars 2006.
Cette mission ne se substitue pas aux structures d'information et de conciliation existantes :
o la commission de relation avec l'usager (CRU),
o les commissions régionales de conciliation et d'indemnisation (CRCI),
o et l'office national d'indemnisation des accidents médicaux (ONIAM).
Cette mission est présidée par M. Ceretti, ancien président du LIEN (Association de lutte contre les infections nosocomiales). Elle a pour objectifs, en s'appuyant sur une cellule d'une dizaine d'écoutants et d'une quinzaine d'experts à travers un numéro d'appel et un site internet :
o d'informer les usagers sur les infections nosocomiales, les mesures de prévention mises en place par les autorités sanitaires et d'apporter des conseils d'hygiène,
o de recueillir les demandes et réclamations, d'en assurer le suivi, d'orienter les usagers du système de soins et de contribuer au développement de la médiation au niveau local,
o d'informer les autorités sanitaires si nécessaire et assurer un retour d'information vers les usagers.
Deux outils d'informations sont opérationnels :
o le N° Azur, disponible en semaine de 9h à 18h ; une équipe de professionnels de santé est à l'écoute des usagers ;
o le site Internet : www.infonosocomiale.fr apportant des informations générales et organisant un forum. Le dépôt de témoignages est aussi possible. En mars et avril, ont été enregistrées 14 382 visites.
Au mois de mars (lancement le 6 du mois), la ligne d'écoute a reçu 2 892 appels avec un pic d'appels lié au lancement de la mission dans la première semaine. 35% de ces appels étaient des demandes « d'éclairage individuel sur une possible infection contractée au cours d'une hospitalisation ». 19% souhaitaient des informations d'ordre juridique, notamment sur les voies de recours, et 16% cherchaient des informations plus générales. 21% des appels concernaient une demande de conseil d'orientation vers les structures locales de conciliation ou vers des associations, ou une demande de médiation.
En avril, le N° Azur est passé en période de croisière, avec 244 appels sur le mois, se stabilisant autour de 50 appels par semaine. Les proportions des motivations se sont aussi modifiées, avec 51% de demandes d'éclairage individuel, 17% de demandes d'informations générales, 14% de demandes de conseil d'orientation, 5% de demandes d'informations juridiques.
Ainsi, le rôle d'information et d'orientation, voire de conseil juridique, est assuré. En outre, cette mission de la HAS doit assurer un rôle de médiation, en s'appuyant sur les structures déjà existantes et, en cas de besoin, d'organiser des médiations entre les usagers et les professionnels de santé.
La mise en place d'un tableau de bord des infections nosocomiales est accélérée.
Ce tableau prévu dans le programme national 2005-2008 est composé de 5 indicateurs qualité :
o l'indice composite d'évaluation des activités de lutte contre les infections nosocomiales ; le premier indice ICALIN a été publié par le Ministre de la Santé en février 2006. Il a été calculé sur 2 428 établissements de santé à partir du bilan 2004.
o le taux d'infections du site opératoire par type d'acte opératoire (disponible d'ici fin 2006);
o le volume annuel de produits hydro-alcooliques (hygiène des mains) pour 1000 journées d'hospitalisation (disponible d'ici fin 2006) ;
o le taux de staphylocoques dorés résistants à la méticilline pour 1000 journées d'hospitalisation (disponible avant fin 2007) ;
o le suivi de la consommation d'antibiotiques (disponible d'ici fin 2007).
La publication de ces indicateurs de moyens et de résultats est une incitation selon le Ministère de la santé à une meilleure prise en compte de la qualité, et constitue aussi un outil d'information disponible pour tous via le site Internet du Ministère.
Une discussion plus complète sur cet aspect du programme est reprise dans un chapitre spécifique.
Le schéma suivant présente comment est organisée à ce jour la lutte contre les IN en France.
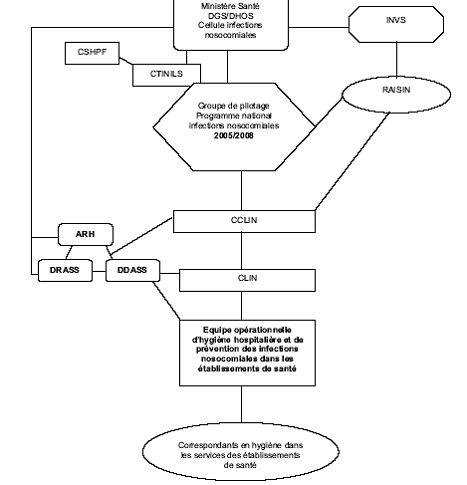
Le dispositif de lutte contre les infections nosocomiales s'appuie donc sur :
o Un dispositif législatif et réglementaire qui s'est construit depuis une quinzaine d'années.
o La mise en place de programmes nationaux spécifiques ou associés (ex : plan national de préservation de l'efficacité des antibiotiques)
o Une diffusion de recommandations de bonnes pratiques via les circulaires et la publication et diffusion de guides de recommandations de bonnes pratiques d'hygiène
Exemples :
l'entretien du matériel médical :
circulaire relative à la désinfection des endoscopes ; circulaire relative à la stérilisation ; circulaire sur les machines à laver les endoscopes ; guide de bonnes pratiques de désinfection des dispositifs médicaux ...
la prévention de la transmission d'infections :
prévention du risque de transmission des agents transmissibles non conventionnels en milieu de soins (circulaire de décembre 1995 et circulaire n°138 du 14 mars 2001) ; surveillance et prévention des infections nosocomiales en réanimation (1995), prévention des accidents d'exposition au sang dans les blocs opératoires guide de recommandations d'isolement septique, les précautions "standard" d'hygiène ; guide sur la maîtrise de la diffusion des bactéries multi-résistantes aux antibiotiques, recommandations devant un risque de transmission par le sang et les liquides biologiques du VHB et du VHC, guide du matériel de sécurité
le bon usage des antibiotiques à l'hôpital
l'organisation de la lutte contre les infections nosocomiales dans les établissements de santé : "100 recommandations pour la surveillance et la prévention des infections nosocomiales"
l'avis du CTIN sur le lavage des mains.
o o A côté de ces recommandations nationales , de nombreux guides de bonnes pratiques d'hygiène sont élaborés par les CCLIN . Ces travaux permettent de mobiliser les acteurs locaux sur une production de « proximité ».
o Afin de faciliter la diffusion des recommandations et de la littérature scientifique, les CCLIN se sont associés pour constituer une base documentaire accessible sur Internet : Nosobase .
o Le renforcement de la vigilance des activités liées aux soins (matériovigilance, hémovigilance, pharmacovigilance, prévention de la iatrogénie...), à travers de nombreux textes législatifs et réglementaires en lien notamment avec les risques émergents (agents transmissibles non conventionnels...).
o Le renforcement de l'évaluation et du contrôle des dispositifs médicaux mis sur le marché.
o La mise en place de programmes d'inspection et de contrôle des activités de soins menés par les services de l'Etat sous la coordination de l'IGAS.
o Le soutien au financement des établissements de santé pour la mise en conformité des divers acteurs de santé.
o L'amélioration de la formation des professionnels de santé en hygiène.
o ex : Guide de bonnes pratiques pour la prévention des infections liées aux soins réalisés en dehors des établissements de santé actualisé en janvier 2006
o Le développement d'études épidémiologiques et d'un système national de surveillance sous l'égide de l 'InVS avec les centres interrégionaux de coordination de la Lutte contre les Infections Nosocomiales (CCLIN) dans le cadre du réseau national d'alerte, d'investigation et de surveillance des infections nosocomiales (RAISIN).
o Le signalement des infections nosocomiales.
o Le développement de l'information du public et l'information individuelle des personnes.
o La mise en place du dispositif de conciliation et d'indemnisation des victimes.
o le développement des pratiques d'audits.
o L' accréditation puis la certification des établissements de santé et l' évaluation des pratiques professionnelles sous l'égide de la Haute Autorité de Santé (HAS).
L'inscription de la lutte contre les IN dans une politique globale de gestion coordonnée des risques
Un dernier point à souligner est constitué par cette politique plus large de gestion des risques dans les établissements de santé, dont nous pouvons indiquer les étapes récentes (source DHOS).
En Mai 2001 , une étude comparative entre la France et l'étranger sur la gestion des risques iatrogènes vise à rechercher des pratiques de gestion de risques adaptables au système de santé français. Cinq pays ont été retenus sur le critère de leur mode de gestion, Etats-Unis, Canada (Province de Québec), Grande-Bretagne, Suisse, Pays-Bas.
En comparaison de ces différents pays, le système français apparaît mixte : réglementé pour certains aspects de la gestion des risques (dispositif de lutte contre les infections nosocomiales ou dispositifs de vigilances liées aux produits de santé) et incitatif (recommandations issues de groupes d'experts, d'agences ou autres institutions).
La recherche d'une régulation équilibrée entre l'État, les professionnels de santé et les usagers peut s'appuyer sur les modes d'organisation expérimentés à l'étranger en matière de gestion des événements indésirables.
En Septembre 2001 , une enquête sur les « modalités d'organisation des programmes de gestion des risques » est mise en oeuvre dans 22 établissements de santé. Elle met en évidence des modalités communes d'organisation des programmes de gestion des risques, avec une démarche projet claire et un pilotage à un niveau hiérarchique élevé. Clairement, la création de structures transversales de gestion des risques au sein de ces établissements a favorisé l'implication des acteurs et conduit à l'élaboration d'une démarche opérationnelle.
En Novembre 2002 une étude sur les « modèles de gestion des risques en établissement de santé: organisation, méthodes et outils » montre l'importance de certains prérequis pour construire une gestion globale des risques en établissement de santé : engagement et soutien fort de la direction, personnel compétent, politique de prévention et de gestion des risques définie avec des objectifs d'amélioration ciblés sur les processus clés de l'établissement, organisation structurée du dispositif de gestion des risques, connaissance précise des processus concernés, système d'information performant, méthodes reconnues et complémentaires entre elles.
Un schéma d'utilisation et de combinaison des méthodes à tester dans les établissements de santé, avec des champs d'application précis (processus identifiés, secteurs d'activités spécifiques) et prenant en compte la capacité des professionnels à se les approprier et à les utiliser est proposé.
Cette étude fait suite à un travail préliminaire réalisé sur la gestion des risques industriels afin de disposer, d'une part, d'une analyse des organisations, des méthodes et outils relatifs à la gestion des risques technologiques dans le secteur industriel et, d'autre part, d'une réflexion pour évaluer le niveau de transposition possible de ces dispositifs industriels dans les établissements de santé.
La Circulaire du 29 mars 2004 relative aux recommandations pour la mise en place d'un programme de gestion des risques dans les établissements de santé propose que chaque établissement de santé développe un programme de gestion globale et coordonnée des risques.
Ce programme comporte les objectifs à atteindre et les actions à mener en matière de prévention et de maîtrise des risques, de sensibilisation, d'information, de formation et d'évaluation du programme.
La problématique, les enjeux de la gestion des risques en établissement de santé, les conditions de développement d'un programme de gestion des risques et les grandes lignes des recommandations auxquelles cette circulaire renvoie sont abordés. Le rôle d'accompagnement des agences régionales d'hospitalisation est explicité (cf. annexe 6).
Le rôle des Agences Régionales d'Hospitalisation (ARH) dans l'accompagnement pour le développement des programmes de gestion des risques
La circulaire du 29 mars 2004 précise que " l'agence contribue au développement des programmes de gestion des risques dans l'ensemble des établissements de santé publics et privés de sa région. L'organisation régionale dans les domaines de la qualité et de la sécurité vise à favoriser le partage d'expériences entre établissements, la mutualisation des compétences, la mise à disposition de méthodes et d'outils communs et à faciliter la veille réglementaire et scientifique. La conduite d'actions en matière d'information, de formation, de sensibilisation aux risques des professionnels de santé est nécessaire à l'impulsion d'une dynamique régionale de développement des programmes (journée régionale par exemple).
Les agences pourront s'appuyer notamment sur les réseaux qualité et/ou les coordinations régionales des vigilances déjà en place. En effet, lorsqu'ils intègrent la problématique de l'amélioration de la sécurité, ces réseaux ou coordinations facilitent le développement d'une politique régionale de gestion des risques ".
Le bilan des expériences de cinq régions, Aquitaine, Midi-Pyrénées, Auvergne, Bourgogne, Franche-Comté, ayant développé une instance régionale de coordination autour des vigilances réglementaires et du risque infectieux nosocomial entre 1996 et 2003 montre que ces instances impulsent une dynamique régionale dans le champ de la sécurité sanitaire et de la gestion des situations d'urgence sanitaire.
Elles participent au développement d'un cadre régional cohérent et global pour la mise en oeuvre d'une politique de santé publique plus particulièrement dans ses dimensions de qualité, sécurité sanitaire et d'évaluation.
Une démarche de contractualisation entre les ARH et le Ministère de la Santé a été engagée à titre expérimental en 2004 avec cinq ARH. Elle est en phase de généralisation à l'ensemble des agences.
Le contrat comporte six objectifs régionaux spécifiques issus des diagnostics partagés et six objectifs nationaux, communs à l'ensemble des agences, dont l'un est relatif à la qualité des soins et à la sécurité sanitaire.
o Objectif général :
o contribuer à développer la qualité des soins et la gestion coordonnée des risques dans les établissements de santé
o o Objectif opérationnel :
o identifier les items du risque sur lesquels les ARH doivent contractualiser avec les établissements de santé, à savoir :
existence d'un gestionnaire de risque identifié dans chaque établissement de santé ;
élaboration d'un document "programme de gestion globale et coordonnée des risques" pouvant comprendre notamment la coordination des vigilances et comprenant les actions menées dans le cadre du programme national de lutte contre les infections nosocomiales ;
validation de ce document par les instances de l'établissement de santé.
Les indicateurs de performance de cette démarche sont le :
o nombre d'établissements ayant signé un contrat d'objectif et de moyens (COM) avec les items du risque ci dessus / nombre total d'établissements dont le COM est signé ;
o nombre d'établissements accrédités avec des réserves en gestion des risques et ayant signé des contrats d'objectifs et de moyens avec les items gestion des risques/ nombre total d'établissements accrédités avec des réserves en gestion des risques ;
o pourcentage d'établissements de la région avec un ICALIN de classe E.
En Mars 2004, sont publiées les « Recommandations pour l'élaboration et la mise en place d'un programme de gestion globale et coordonnée des risques dans les établissements de santé ».
En Juin 2005, une étude sur l'applicabilité de ces recommandations est réalisée dans vingt-huit établissements de santé volontaires. Les recommandations sont perçues par l'ensemble de ces établissements, quel que soit leur niveau d'avancement dans une démarche de gestion des risques, comme adaptées au contexte, utiles et applicables pour la définition, l'organisation et le pilotage d'une politique de gestion des risques.
En Juillet 2005 est actualisé le référentiel « sécurité sanitaire dans les établissements de santé : réglementation applicable version n° 5 juillet 2005 » qui fait l'inventaire des textes juridiques applicables aux établissements de santé en matière de sécurité sanitaire.
Elaboré initialement en 1999 à la demande de l'ANAES pour les experts visiteurs, ce document réactualisé régulièrement sous l'égide de la Direction de l'Hospitalisation et de l'Organisation des Soins, constitue désormais pour les professionnels de santé, au delà d'un outil d'aide à la procédure de certification, un référentiel commun dans le champ de la sécurité sanitaire réglementée.
Cette politique globale de gestion des risques s'inscrit aussi dans un cadre européen et international, l'Union européenne, comme le Conseil de l'Europe et l'Organisation Mondiale de la Santé étant engagé des actions dans ce domaine (annexe 7).
|
Synthèse Initiée dès les années 70, la politique relative à la prévention des infections nosocomiales s'est rattachée en premier lieu au concept alors en vogue de l'hygiène hospitalière et à des préconisations via des circulaires sur l'organisation hospitalière à mettre en place en ce sens. Le système réglementaire relatif à l'organisation de la surveillance et de la prévention des infections nosocomiales dans les établissements de santé publics s'organise en 1988, complété en 1995 par le système interrégional et national de lutte contre ces infections (CTIN, CCLIN). La loi du 1 er juillet 1998 relative au renforcement de la veille sanitaire et au contrôle de la sécurité sanitaire donne son réel fondement législatif à cette politique de prévention. Durant ces années, sont structurés des programmes coordonnés de santé publique relatifs à la prévention des infections nosocomiales, qui viennent compléter ces aspects juridiques en établissant notamment les modalités de surveillance épidémiologique, en lien notamment avec l'INVS, et de formation des personnels. Autre étape décisive en matière législative, la loi du 4 mars 2002 relative au droit des malades inscrit les infections nosocomiales comme un des préjudices liés aux soins ouvrant droit à réparation pour les citoyens. Enfin, depuis 2004, les principes de qualité des soins, de gestion globale des risques, de transparence des résultats des activités de soins et d'information des patients organisent et complètent le système de surveillance et de signalement des infections nosocomiales ; ainsi des tableaux de bord sont rendus publics régulièrement par le ministère de la Santé. |
F. QUELLES DONNÉES, QUELS TAUX FAUT-IL RENDRE PUBLICS ?
La position du problème
La diffusion publique de données relatives à l'activité, la performance et les résultats des établissements de santé est devenu un sujet de plus en plus important, dans l'ensemble des pays occidentaux, pour répondre à une demande - exprimée ou supposée - du grand public face à la complexité croissante de l'organisation de l'offre de soins et des craintes face aux risques de non qualité et de iatrogénie.
La HAS a très récemment fait réaliser une étude bibliographique sur ce thème (rapport de B. Fermon et P. Lévy, novembre 2005), rapport dont les lignes qui suivent s'inspirent largement.
Les objectifs d'une telle diffusion publique d'informations sont multiples, mais on peut dégager deux objectifs généraux distincts :
o D'une manière générale, cette diffusion accompagne la politique dite de « démocratie sanitaire », visant à accroître le niveau d'information et la participation des usagers au fonctionnement du système de soins.
o Elle recherche aussi à accroître l'efficience du système de soins en créant des incitations à l'amélioration de la qualité des soins, et, dans les pays qui ont un mode de régulation davantage orienté vers le marché, en se dotant d'outils de régulation de l'offre par la qualité. Il s'agit en général d'améliorer globalement le niveau moyen de qualité des soins et de responsabiliser les acteurs, plus marginalement d'éliminer du circuit les établissements présentant une qualité trop mauvaise.
Il n'est pas certain que ces deux objectifs ne soient pas contradictoires en pratique, nous allons y revenir.
L'idée est que la diffusion publique agit par deux mécanismes : des mécanismes de marché, via un processus de concurrence par la qualité (orientation du « consommateur » vers le prestataire offrant le meilleur rapport qualité/prix !) ; des mécanismes de réputation, qui stimuleraient les établissements à éviter d'altérer leur image de fournisseurs de soins.
Mais les modalités de la diffusion posent de nombreuses questions : quels types d'information diffuser ? Pour qui ? Comment ? Comment concilier fiabilité et rigueur de l'information d'une part, et lisibilité et accessibilité de cette information d'autre part ? Et finalement, ces stratégies de diffusion de l'information remplissent-elles leurs objectifs ? La diffusion publique est-elle un outil pertinent et efficace d'amélioration de la qualité de soins ?
Aux USA, de nombreux systèmes de diffusion publique se sont développés depuis la fin des années 80, avec des initiatives d'origine diverse, tant publiques que privées, au départ surtout axés sur des taux de mortalité puis s'enrichissant au fur et à mesure (taux de césariennes, taux de complications, suivi de la douleur, etc.) 15 ( * ) . Les établissements sont en général volontaires, le recueil se basant sur des données existantes dans les établissements, éventuellement complétées par des enquêtes spécifiques.
L'évaluation de ces expériences de diffusion donne des résultats mitigés : l'impact sur les consommateurs est peu évident ; l'information qui leur est délivrée est souvent complexe, difficile à intégrer pour des choix individuels (dans la mesure notamment où il n'y a souvent localement pas de choix d'orientation).
Du côté des professionnels par contre, la diffusion publique a un impact démontré : les établissements ont une meilleure connaissance des dysfonctionnements internes, basent sur ces constats des programmes d'amélioration continue de la qualité, et ont une incitation forte à maintenir leur réputation intacte. Il existe cependant des effets négatifs : rétention d'information, désengagement du recueil d'informations, manipulation des données.
Au total, les résultats de ces stratégies de diffusion ne sont pas considérables. Il semble qu'une efficacité ne puisse être observée qu'avec des mesures d'accompagnement, dans le cadre d'une stratégie globale d'amélioration de la qualité, et éventuellement avec des mesures d'incitation financière en parallèle.
Il a été soulevé aussi le problème potentiel de sélection adverse des patients les plus lourds par les établissements qui visent une amélioration de leurs indicateurs. On peut aussi craindre l'effet « loupe » qui ferait que les établissements n'auraient d'attention que sur les paramètres ayant un impact sur l'indicateur si celui-ci prend trop d'importance dans le système.
Il pourrait aussi exister un risque de perte de confiance de l'usager vis-à-vis d'un système qui affiche si ouvertement ses défaillances. A trop parler de non qualité, si le message est mal compris, ce risque peut être réel.
Les expériences publiées sont cependant trop disparates pour délivrer un jugement global. Il semble toutefois que l'effet de réputation soit le moteur principal des comportements.
Au Royaume Uni, on est passé d'un système conçu initialement dans une optique de contrôle à un système cherchant à responsabiliser les acteurs. La diffusion publique d'informations est proposée comme un élément d'une stratégie globale d'évaluation et de management de la performance du système de santé public. Elle est obligatoire. La présentation est détaillée auprès des établissements, et très simplifiée pour le grand public (de zéro à trois étoiles). Des mécanismes incitatifs s'ajoutent au dispositif (plus grande souplesse de gestion). Les critiques sont toujours de même nature : utilité modeste pour les patients (absence de choix de toute façon, indicateurs peu adaptés), risque de manipulation des indicateurs.
A noter que l'initiative privée de diffusion publique d'informations, plus adaptées aux besoins du public, rencontre un vif succès.
D'autres pays européens ont engagé des expériences de diffusion publique, mais avec un recul insuffisant pour juger de leur impact. On peut repérer des points communs toutefois entre ces différentes expériences, en dehors des aspects spécifiques propres au contexte de chaque pays : la stratégie de diffusion publique s'inscrit dans un programme plus large de mesure et d'amélioration de la performance (guides de bonnes pratiques, changements organisationnels, audits) ; la participation des établissements est obligatoire ; les professionnels sont associés à la conception du système de diffusion.
On peut remarquer que la stratégie française de tableau de bord sur les IN dont nous allons parler répond à ces trois conditions.
On peut toutefois à ce stade noter les limites de ces stratégies de diffusion publique :
o l'impact sur la demande de soins n'est pas observable, et est sans doute nul ; du point de vue du public, l'information délivrée n'est très souvent pas très utile (absence de choix), pas très lisible, et ce n'est pas forcément cette information qui est souhaitée (les patients s'intéressent plus aux résultats qu'aux procédures...) ; il faut prendre garde aussi à ne pas laisser penser, en visant un objectif d'excellence sur toutes les procédures de soins, que le risque zéro est accessible ;
o l'impact sur les fournisseurs de soins est par contre plus net, essentiellement par volonté de défendre leur réputation ; en outre, les informations diffusées sont de nature à les inciter à améliorer les dysfonctionnements observés sur les procédures internes ; la pression ressentie paraît plus forte que celle issue de résultats d'audits internes par exemple ;
o mais il existe un risque fort, notamment quand ces données sont utilisées par la tutelle, de dégradation de la qualité des données. Paradoxalement, plus les indicateurs seront pertinents et plus il paraîtra possible d'y associer des mesures de récompenses/sanctions, plus le risque est fort de voir la crédibilité des données s'effondrer ;
o des mécanismes d'incitations financières, d'intéressement existent, pour accompagner l'effort réalisé en faveur de la qualité des soins, mais il est impossible à ce jour d'en évaluer l'impact. Tout au plus peut on signaler que les différents pays vont dans cette direction avec beaucoup de précautions...
Il faut par ailleurs observer que les diffusions d'informations sur les performances des établissements de santé par des initiatives privées, la presse en général, en France (Le Point) comme dans d'autres pays, rencontre toujours un fort succès dans le public. Il existe donc bien une demande d'informations, à des fins de connaissance (mais il est peu probable que les patients utilisent ce type de classement pour un choix d'hospitalisation), mais aussi d'incitation, afin que les établissements les plus mal classés s'améliorent.
A noter enfin que dans les pays étudiés, le principe même de diffusion publique d'informations sur la qualité des soins n'est pas remis en cause ; les critiques portent sur les modalités de mise en oeuvre, notamment sur la fiabilité des données et le rôle néfaste des incitatifs.
L'état de la question en France en 2006
Pour revenir à la France, une politique de publication d'indicateurs de qualité liés à la prévention et aux résultats obtenus en matière d'IN a été engagée depuis 2003, sous l'impulsion d'abord de J.F. Mattei, puis de P. Douste-Blazy et de X. Bertrand.
Cette politique a abouti, début 2006, à la publication comparative d'un premier indicateur, l'ICALIN (Indice composite des activités de lutte contre les infections nosocomiales), sur lequel nous allons revenir, qui sera suivi en principe de 4 autres indicateurs, en cours de généralisation :
o le volume annuel de produits hydro-alcooliques par journée-patients (SHA) ;
o le taux de staphylococcus aureus résistant à la méticilline (SARM) pour 1000 journées-patient ;
o le taux d'infections du site opératoire (ISO), par type d'acte opératoire ;
o le volume d'antibiotiques consommés pour 1000 journées-patient.
Le dernier indicateur est un peu particulier, il ne constitue pas à proprement parler un indicateur de qualité, mais cherche à mettre l'accent sur la nécessaire maîtrise de la consommation d'antibiotiques, pour freiner le développement des résistances.
On ne peut cependant pas dire que la consommation d'antibiotiques est en elle-même un indicateur de moindre qualité des soins ; les antibiotiques guérissent les infections quand ils sont bien utilisés (en termes d'indication, de posologie, de durée).
Il existe certes un lien entre consommation d'antibiotiques et développement des résistances, mais c'est davantage en termes de mauvais usage qu'il faut raisonner qu'en termes quantitatifs.
Pour chacun de ces indicateurs, la démarche suivante a été retenue :
o en mars 2003, saisine de l'Institut de Veille sanitaire par J.F. Mattei, et constitution d'un groupe d'experts
o février-mars 2004 : remise du rapport, choix des indicateurs ;
o courant 2004 : description, définition des modalités de recueil, de calcul, de traitement des données dans le cadre du projet COMPAQH (Coordination pour la Mesure de la Performance et l'Amélioration de la Qualité Hospitalière) ; définition et rédaction des cahiers des charges avec les experts du domaine ;
o octobre 2004-avril 2005 : test de faisabilité des cinq indicateurs retenus par l'équipe COMPAQH sur 36 établissements ;
o 2005 : le CTINILS constitue le groupe de travail sur les indicateurs, qui, avec l'appui de la cellule infections nosocomiales DGS/DHOS au Ministère de la Santé, organise la généralisation du recueil et définit les modalités de publication, en commençant par l'ICALIN.
Revenons sur chacun de ces indicateurs.
L'ICALIN est un indicateur de structure et de procédure. Il ne donne pas d'informations sur les résultats en matière d'IN.
Il est construit à partir des bilans standardisés des activités de lutte contre les IN dans les établissements. Comme il a été indiqué dans les éléments juridiques ci-dessus, chaque établissement doit chaque année remplir ce bilan, qui aborde toutes les questions relatives au fonctionnement des CLIN, aux ressources mises en oeuvre par les établissements en matière de lutte contre les IN, à la stratégie de lutte contre les IN et l'intégration de cette stratégie dans la politique générale de l'établissement, à la mise en oeuvre d'un programme de prévention de la diffusion des bactéries multi-résistantes, d'un programme de bon usage des antibiotiques, à la prévention des risques infectieux liés à l'environnement, à l'existence de protocoles de prévention des risques infectieux (hygiène des mains, sondage urinaire, ventilation artificielle, soins préventifs d'escarres, désinfectants, etc.), à la surveillance épidémiologique, au signalement des IN, à la formation en hygiène hospitalière, à l'évaluation (audits de pratiques).
Tous ces paramètres sont classés en trois catégories : Organisation, Moyens et Actions, chaque catégorie comptant pour 1/3 dans la note globale établie sur 100 points (un système de pondération de chacun des 31 items du bilan standardisé déterminés par un groupe d'experts a été mis en place pour donner du poids aux items les plus discriminants) (voir annexe 8).
Cet indice est calculé tous les ans et sert à mesurer les efforts entrepris par chaque établissement dans la lutte contre les infections nosocomiales. Ce n'est pas le taux d'infections nosocomiales de chaque établissement.
A titre d'exemple, les moyens en personnel hospitalier sont pris en compte à hauteur de 16 points dans le score total, ce qui représente moins de points que par exemple l'existence de l'ensemble des protocoles d'hygiène : se laver les mains régulièrement et longuement, stériliser le matériel... (17 points).
Il a été retenu le principe de publier les résultats par établissement en définissant 5 classes, de A à E, sur la base des percentiles de distribution, par catégorie d'établissements (13 catégories d'établissements ont été définies : CHU, CH de moins de 300 lits, CH de plus de 300 lits, établissements psychiatriques, etc. pour permettre la comparaison la plus fine possible), pour les établissements qui ont fourni la totalité des données.
Ainsi, pour une catégorie donnée, les établissements classés en A sont les 10% les mieux placés pour leur note sur 100 ; les établissements classés en B sont les 20% suivants, les établissements classés en C sont les 40% suivants, les établissements classés en D les 20% suivants, et les établissements classés en E sont donc les 10% ayant obtenu les plus mauvaises notes.
Les bornes définissant chaque classe sont donc différentes d'une catégorie d'établissements à l'autre : par exemple, dans la catégorie des CH de moins de 300 lits, il faut avoir une note supérieure ou égale à 88,5 pour être en A ; les établissements ayant une note entre 79,5 et 88,5 sont en B, etc. jusqu'à la catégorie E regroupant les établissements ayant une note inférieure à 44,5.
A noter qu'il existe une 6 ème classe constituée par les non répondants, qui d'une certaine manière, sont « pires » que les E puisqu'ils ne donnent même pas les informations du bilan standardisé. Dans la prochaine version, ces établissements seront intégrés dans la classe F.
Les bornes définissant les classes sont gelées aux valeurs calculées pour l'année 2003, si bien que les progrès réalisés pourront être observés d'année en année ; l'objectif est de ne plus avoir d'établissements en classe E d'ici 2008. Il a déjà été noté que le nombre d'établissements en E a diminué de 34% entre 2003 et 2004.
En 2004, sur 2 832 établissements de santé sollicités, 11,1 % des établissements sont classés en catégorie A, 22,2 % en catégorie B, 33,4 % en catégorie C, 13,2 % en catégorie D et 5,8 % en classe E.
ICALIN est accessible, sur demande auprès de l'établissement de santé (qui est fortement incité à le mettre dans son livret d'accueil) et sur le site Internet du Ministère www.sante.gouv.fr .
Les établissements classés E doivent établir avec tous les acteurs, direction, CME, CLIN, personnels d'hygiène le diagnostic de leurs faiblesses au regard des différents items d'ICALIN. Le programme d'actions établi sur la base de ce diagnostic doit comporter des actions en termes d'application des protocoles, notamment pour la surveillance microbiologique du réseau d'eau chaude, le protocole de sondage urinaire et les protocoles standards concernant le risque biologique, mais aussi des actions de formation à l'hygiène et à la qualité.
Ce programme est transmis aux ARH, ainsi qu'aux centres de coordination interrégionaux (C.CLIN).
Au vu des efforts des établissements, et au vu de leurs diagnostics, des actions d'accompagnement seront alors initiées par les tutelles avec l'appui technique et l'expertise des C.CLIN telles que :
o la mise en oeuvre de programmes inter établissements de formation à l'hygiène hospitalière,
o l'organisation de séminaires sur la définition d'un programme d'action,
o un audit ciblé sur la surveillance du réseau d'eau chaude sanitaire dans les établissements,
o un séminaire de formation sur les protocoles prioritaires,
o une aide à la constitution d'Equipes Opérationnelles d'Hygiène inter-hospitalières permettant aux établissements de petite taille de partager du personnel qualifié.
Quelles ont été les réactions à la publication de ce premier indicateur ?
Les citations dans la presse ont été nombreuses, et plusieurs commentaires ont émané des établissements classés en E, soit pour justifier leur positionnement, soit pour critiquer la méthode !
« Il n'y a pas eu une seule infection nosocomiale dans cet établissement depuis 2000 » !
« Ces documents ont été mal renseignés par nos équipes et mal interprétés par le ministère »
« Ce classement n'est absolument pas cohérent. Il faut rappeler que cette étude est basée sur des données datant de 2004 et que la situation actuelle est bien loin de mériter une telle note car de nombreux efforts ont été réalisés en terme de prévention des IN ».
« L'étude est fondée sur un indicateur de moyens et non de résultats. Nous avons eu le maximum des points sur les actions engagées dans la lutte contre les infections, mais nous avons été pénalisés par rapport à notre organisation, qui a évolué depuis... C'est le problème d'une évaluation à retardement ».
De fait, la confusion entre l'ICALIN et un indicateur de résultats est exploitée par plusieurs commentaires ; l'autre obstacle soulevé est celui du décalage temporel, qui est un problème inhérent à ce type de procédure, mais la publication des chiffres 2005 permettra de répondre à cette remarque !
Une dernière critique sur cet indicateur porte sur son aspect déclaratif. Les établissements remplissent leur bilan standardisé sans contrôle externe de leurs déclarations. Mais ce problème est mineur si on se place sur plusieurs années : les déclarations biaisées sont difficiles à maintenir dans le temps.
Le test de faisabilité et de fiabilité effectué par COMPAQH fin 2005, qui s'est attaché à vérifier la concordance entre les déclarations et la réalité, par contrôles sur pièces, dans 36 établissements, indique un taux de concordance des scores de 84%. Aucune pratique de surévaluation systématique des données n'a été observée. Précisément, 14 items sur les 31 ont une concordance stricte inférieure à 75% dont 6 ont un impact sur le score, souvent par défaut de production des pièces justificatives. Au total, il s'avère que les déclarations ont un bon niveau de fiabilité. Au demeurant, un contrôle de qualité des données doit être organisé au niveau régional (soit par tirage au sort, soit en cas de « saut » de 2 classes en une année). D'autres établissements font valoir de mauvais arguments, comme un des CHU mal classé argumentant qu'en tant que CHU, il prend en charge les pathologies les plus graves... oubliant qu'il est comparé uniquement aux autres CHU.
La crainte des acteurs est évidemment de voir jeter l'opprobre sur les établissements classés E qui peuvent l'être pour des raisons purement logistiques de mauvais remplissage du bilan ou de réorganisation en cours. L'esprit doit rester une incitation à l'amélioration, tel est en tout cas le discours officiel, et non une stigmatisation de « mauvais » établissements.
L'arrêté du 8 mars 2006 qui abroge l'arrêté du 11 juin 2002 et la circulaire du 9 mars 2006 définissent le modèle et les modalités de recueil et transmission du bilan annuel des activités de lutte contre les infections nosocomiales dans les établissements de santé pour 2005.
Ce bilan 2005 servira à établir l'ICALIN 2005, en précisant que les établissements qui n'auront pas répondu seront affectés dans la classe F (le rang de classement ira alors, par ordre décroissant de performance, de A à F).
Le prochain indicateur prévu d'ici décembre 2006 porte sur le volume de solutions ou gels hydro-alcooliques, en litres, commandé par la pharmacie ou les services communs en 2005 pour 1000 journées d'hospitalisation. Le recueil est effectué via le bilan standardisé dont il était question plus haut (annexe 8).
L'objet de cet indicateur est d'apprécier l'état d'avancement de la politique en matière d'hygiène des mains dans les établissements. L'hygiène des mains est la mesure de prévention la plus simple et la plus efficace pour réduire la transmission d'agents infectieux lors des soins. Le lavage hygiénique des mains se différencie du lavage simple des mains, en opérant par frictions en utilisant un produit désinfectant.
Le problème potentiel de cet indicateur, et d'ailleurs mis en évidence lors du test de faisabilité de COMPAQH, est sa possible manipulation, ou disons ses variations possibles en raison de choix de stockage, de coulage, de possibilités de recevoir des échantillons gratuits, etc. Sa fiabilité a cependant été jugée satisfaisante dans ce test de faisabilité. Certains acteurs rencontrés s'attendent malgré tout à voir augmenter les commandes de ces produits sans forcément en voir augmenter l'utilisation, simplement pour être mieux positionné sur cet indicateur !
Dans ce cas précis, les classes d'établissement ne seront pas définies de manière relative comme pour l'ICALIN mais de manière absolue, par rapport à l'objectif d'au moins 20 litres pour 1000 journées d'hospitalisation (définissant la classe A), correspondant à 6-7 frictions par patient et par jour.
A ce jour, il semble que la majorité des établissements soit assez éloignée de cet objectif. Lors de la construction de cet indicateur, les résultats obtenus au sein des établissements participant au projet COMPAQH indiquaient une variation entre 0 et 16 avec une médiane à 4 ! Cet indicateur risque d'être beaucoup plus discriminant que l'ICALIN.
Comme pour l'ICALIN, les établissements qui ne fourniront pas les données demandées dans les temps ou sous un mauvais format seront considérés comme non-répondants et apparaîtront dans la catégorie F du classement.
La circulaire du 13 mars 2006 relative aux modalités de calcul de cet indicateur demande enfin aux établissements d'organiser leur contrôle interne des données (saisie et cohérence) et de tenir à la disposition des services déconcentrés les éléments de preuve des données déclarées à des fins de contrôles aléatoires.
Pour pallier les difficultés à évaluer le taux d'ISO (difficultés de définition, de recueil, de redressement des données...), il n'est prévu pour le moment que de publier un indicateur de réalisation d'une surveillance des ISO dans l'établissement , sans, à ce stade, en donner le résultat. Cet indicateur doit aussi être publié fin 2006.
Il peut paraître étonnant de différer la publication d'un indicateur de résultats aussi important, mais les problèmes de méthode sont extrêmement nombreux :
o nécessité, pour l'interpréter, de redresser les résultats par la sévérité des cas (dans RAISIN et dans les études internationales, l'index de gravité NNIS est utilisé), ce qui complique le recueil ;
o nécessité d'un recueil spécifique au lit du patient, voire dans les semaines qui suivent l'hospitalisation (et même des mois pour les poses de prothèses) ; à noter que ce recueil est effectué par les établissements participant au RAISIN ;
o ce recueil doit être exhaustif sous peine de biaiser l'indicateur ;
o si, comme c'est le cas dans le projet français de tableau de bord, on ne cherche à comptabiliser le taux d'ISO que pour les interventions non à risque d'ISO pour éviter d'avoir à opérer de redressement complexe, on se heurte par construction à la difficulté de devoir analyser de faibles effectifs, rendant l'analyse statistique difficile. Si en effet, on analyse un acte réalisé 100 fois dans l'établissement, et que le taux d'ISO est en moyenne inférieur à 1% pour cet acte, on voit que le fait de passer de 0 à 1 événement d'une année sur l'autre peut faire basculer de catégorie cet établissement !
Lors de l'étude de faisabilité réalisée par COMPAQH, il est apparu que l'ISO était l'indicateur présentant le plus de problèmes : difficultés pour s'assurer de l'exhaustivité de l'analyse (précisément pour s'assurer qu'on avait bien analysé 100 actes consécutifs sans en omettre un seul), difficultés pour recueillir les données 30 jours après la sortie du patient, problème déjà soulevé des faibles effectifs d'actes et a fortiori d'ISO par acte.
C'est pourquoi pour le moment, il n'est prévu dans le tableau de bord que l'indication de la réalisation de la surveillance des ISO par les établissements, sur une liste d'actes opératoires cibles.
En 2007, outre la mise à jour des indicateurs précédents, seront publiés les deux derniers indicateurs.
Le nombre de patients chez lesquels au moins une souche de SARM a été isolée dans l'année au sein d'un prélèvement à visée diagnostique pour 1000 journées d'hospitalisation constitue un réel indicateur de résultat, et à ce titre, est sans doute le plus intéressant. Cette donnée sera aussi recueillie via le bilan standardisé des CLIN (cf. annexe 8). Les laboratoires de bactériologie ont la charge du recueil dans les établissements. Seule une souche de SARM par patient doit être comptabilisée dans le cas où il y a plusieurs prélèvements au cours de l'année (dédoublonnage). En sont exclus les prélèvements à visée de dépistage et les prélèvements dans l'environnement. Cette confusion possible entre les prélèvements à visée de diagnostic et les prélèvements à visée de dépistage constituait le principal problème soulevé lors du test de faisabilité.
Le taux de SARM est le type même du bon indicateur pour les raisons suivantes :
o il est considéré comme l'indicateur principal permettant d'apprécier l'évolution des taux de bactéries multi-résistantes aux antibiotiques ;
o le SARM est essentiellement acquis par transmission croisée manuportée et des mesures de prévention simples (hygiène des mains) ont prouvé leur efficacité ;
o la France reste à un niveau élevé de SARM (28% en 2004), et une action résolue est susceptible d'en faire baisser significativement la valeur ; ce taux est donc très discriminant pour apprécier l'efficacité des actions des établissements ;
o le parallélisme entre les taux de prévalence des IN et de SARM dans les pays européens permet d'envisager cet indicateur de résultat comme un indicateur global de l'hygiène dans les établissements de santé.
Cet indicateur présente cependant des inconvénients : le recueil ne permet pas de discriminer le caractère acquis ou importé des souches, en l'absence de dépistage systématique des patients à l'entrée, irréaliste. Il n'est pas ajusté selon la gravité des patients ou selon la charge en soins. Il faut donc prendre garde à l'interprétation des comparaisons entre établissements. Il est par contre très utile pour suivre dans le temps l'évolution du taux au sein d'un établissement donné.
Sur la consommation d'antibiotiques , nous avons dit en quoi le suivi quantitatif simple (qui rencontre en outre des problèmes de faisabilité pour apprécier la consommation par service) présente des limites conceptuelles pour mesurer la qualité. Il doit y être ajouté un indicateur composite mesurant la politique de bon usage des antibiotiques, à construire.
Quels sont les objectifs poursuivis en France en publiant ces tableaux de bord ?
Les objectifs mis en avant par le ministère de la Santé sont doubles :
o répondre « à une demande légitime d'information et de transparence de la part des usagers » ;
o « inciter tous les établissements de santé à mesurer leurs actions et leurs résultats dans le domaine de la lutte contre les IN... Il vise à améliorer la qualité des soins en permettant un suivi dans le temps et des comparaisons entre les établissements ».
Mais ces objectifs ne sont-ils pas contradictoires ? A vouloir diffuser une information le plus largement possible, n'existe-t-il pas un risque que les établissements masquent une partie des informations faisant l'objet du recueil ? Rappelons ce commentaire fait par un établissement, mal classé dans le tableau ICALIN, qui assure ne pas avoir eu d'IN depuis 2000 ! Si cet établissement pratique réellement des prestations d'hospitalisation de court séjour, c'est malheureusement impossible. Sans doute cette remarque est-elle faite de bonne foi, avec justement absence de modalités internes de recueil de ces événements, mais cela illustre avec quelle facilité les informations pourraient être biaisées.
Lors des entretiens réalisés au cours de cette étude, nous avons noté une forte crainte des experts du domaine face à la baisse de qualité des informations qui suivrait une trop vaste diffusion des données de résultats de soins.
A cet égard, l'indicateur sur les ISO, dont nous avons par ailleurs évoqué les difficultés méthodologiques, pourrait être rapidement perverti : étant le plus sensible, il sera aussi certainement le plus faux en cas de diffusion publique !
Par contre, les indicateurs en place ou prévus sur les efforts réalisés par les établissements dans la lutte contre les IN (ICALIN, et même consommation de produits hydro-alcooliques) rencontrent davantage de conditions de robustesse.
Le taux de SARM, qui a un grand intérêt dans le suivi des résistances et de la politique interne des établissements pour lutter contre ces résistances, est dans une situation intermédiaire, surtout que les modalités de recueil laissent une grande place, par construction, à la qualité de l'organisation des établissements pour opérer ce recueil.
Un bon indicateur, dans l'absolu, se doit d'être pertinent (au sens où il doit bien viser l'objectif poursuivi), fiable, simple à lire et à comprendre, aisé à recueillir, non manipulable, contrôlable. Il faut admettre que la combinaison de ces conditions rend l'exercice difficile.
A noter que l'UFC Que Choisir ? n'est pas forcément favorable à un tel classement des établissements pour le grand public, car souvent confus et mêlant plusieurs dimensions (gestion, qualité, résultats de soins...). Par contre, l'aspect pédagogique de telles données auprès des professionnels de santé paraît plus intéressant. Des mesures ponctuelles comme la fermeture momentanée de la clinique du Sport ont eu plus d'impact que la publication d'indicateurs déclaratifs globaux. L'important est d'éviter que se pérennisent des situations dangereuses pour les patients.
L'évolution récente de la législation américaine
Les USA ont fait évoluer en 2005 leur législation sur la publication des données en matière de sécurité des patients, évolution qu'il est intéressant de noter dans cette discussion.
Auparavant, était en vigueur la loi du 20 mars 1997 (`Patient Safety Act') qui stipulait que les institutions de soins devaient rendre publiques certaines informations sur les effectifs des personnels de soins et les résultats. Au minimum, devaient être rendus publics les éléments suivants :
o Le nombre d'infirmières dans les services de soins ;
o Le nombre des autres personnels délivrant des soins aux patients ;
o Le nombre moyen de patients par IDE délivrant des soins ;
o Le taux de mortalité ;
o L'incidence des accidents médicaux ;
o Les méthodes utilisées pour determiner et adjuster les effectifs et les besoins des patients.
De plus, les établissements devaient rendre publics les résultats des enquêtes engagées suite à des dépôts de plaintes.
Cette loi vient très récemment d'être modifiée et complétée par `The Patient Safety and Quality Improvement Act' (29 juillet 2005). L'objectif de ce nouveau texte est de permettre aux offreurs de soins de contracter de manière volontaire avec des PSOs (`Patient Safety Organizations') pour les aider à :
o Identifier et analyser les risques en matière de sécurité des patients et autres problèmes de qualité des soins ;
o Modifier leurs structures et procédures afin d'améliorer les résultats de santé sans crainte que les données soient diffusées publiquement ou utilisées contre eux dans le cadre d'une assignation judiciaire ou d'une procédure disciplinaire. Cette protection, qui assure donc une confidentialité complète pour l'offreur de soins comme pour les patients et les professionnels, n'est acquise que dans le cadre de ce contrat, pour les données, rapports, enregistrements... déclarés au PSO (la levée de cette confidentialité conduit à des pénalités financières).
Ces PSOs sont des nouvelles entités, dont la liste est établie par le Secrétariat à la Santé, qui peuvent être de statut public ou privé ; ils doivent être financés dans le cadre des contrats passés avec les offreurs de soins et/ou par cotisations des adhérents. La certification du PSO par le Secrétariat à la Santé est conditionnée à un certain nombre de clauses restrictives (notamment sur la nature des relations avec les offreurs de soins avec lesquels le PSO contracte) et peut être révoquée.
Ces nouvelles dispositions n'affectent pas les précédents droits et obligations. Ainsi, les protections apportées par cette Loi n'empêchent pas les demandes d'accès aux informations dans le cadre de plaintes pour mauvaise pratique avant le vote de cette Loi. Les offreurs de soins ne peuvent pas masquer (shield) ces informations vis-à-vis de futures plaintes, ni aux organismes de régulation et d'accréditation. Pour ces organismes, les offreurs de soins peuvent mettre en place des procédures distinctes pour recueillir l'information qui leur est nécessaire. Les offreurs de soins doivent aussi continuer à adresser à la FDA les données obligatoires.
Le Secrétariat à la Santé HHS apporte une assistance technique aux PSOs, et doit maintenir un réseau de bases de données sur la sécurité des patients afin de recueillir et analyser les données anonymisées sur la sécurité des patients recueillies par les PSOs et les fournisseurs de soins. Ces informations serviront pour des analyses régionales et nationales, et donneront les tendances (disponibles pour le public).
En bref, cette loi établit une relation contractuelle garantissant la confidentialité des données de tous ordres concernant la sécurité et la qualité des soins, où les médecins, les hôpitaux et les autres institutions de soins peuvent de façon volontaire donner des informations sur les erreurs médicales aux `PSOs'. Ces PSO, listées par le Secrétariat à la Santé, analyseront les données afin de développer des stratégies pour améliorer la sécurité du patient.
Le corps médical américain a salué cette avancée : « Cette loi établit un système pour déclarer et analyser les erreurs lors de soins de santé, dans le but d'améliorer la sécurité des patients et la qualité des soins. Les erreurs lors des soins seront prévenus en transformant l'actuelle culture du `blame', qui conduit à cacher les informations sur les erreurs, et une culture de la sécurité, qui met l'accent sur le partage de l'information...dans le but de prévenir le renouvellement des erreurs...Quand les médecins peuvent signaler les erreurs d'une façon volontaire et confidentielle, cela est bénéfique pour tout le monde...Cette loi a cherché l'équilibre entre la confidentialité et le besoin de renforcer la notion de responsabilité dans le système de santé. Les PSOs analyseront les problèmes, identifieront les solutions et les mettront en place pour éviter de nouvelles erreurs. » (cité dans Hygiènes, 2005, vol XIII).
Cette Loi trouve donc le compromis entre la recherche d'amélioration de la sécurité des patients, la surveillance et le signalement des problèmes de qualité, la fiabilité des données. J. Fabry (HCL) note dans son éditorial : « De plus, elle rend plus difficile la pratique de diffusion publique des taux d'IN et autres indicateurs censé refléter la qualité des établissements de santé. Cette publicité des performances a été expérimentée par certains états américains et de façon peu concluante à ce jour. Plusieurs états ont fait marche arrière. »
Un dernier élément intéressant concernant la situation aux Etats-Unis est la publication récente de recommandations par le Comité consultatif des pratiques pour la maîtrise des infections liées aux soins (HICPAC) 16 ( * ) . Ce Comité, après avoir constaté que plusieurs états avaient édicté des législations obligeant les établissements de santé à publier leurs taux d'infections liées aux soins, a fait le point sur l'état de la question :
Un premier enseignement important est le constat qu'il n'existe pas de preuve de l'intérêt de telles publications, ni d'ailleurs la preuve qu'elles soient néfastes. Le comité ne prend ainsi pas position sur l'opportunité de ces procédures.
Par contre, il émet de nombreuses recommandations sur les modalités et le contenu de ces tableaux de bord.
Cinq indicateurs en particulier semblent répondre à l'ensemble des contraintes de fiabilité, de pertinence, de faisabilité, de fréquence :
o Indicateurs de procédures (qui ne nécessitent pas d'ajustement selon le risque du patient) :
Pratiques de pose d'une voie centrale
Antibioprophylaxie avant chirurgie
Vaccination antigrippale du personnel
o Indicateurs de résultats :
Bactériémie primaire confirmée biologiquement associée à une voie centrale (stratification par type d'unité)
Infection du site opératoire, par acte (stratification selon l'index NNIS), en tenant compte toutefois de la difficulté à disposer de l'information après l'hospitalisation (50% des ISO se déclarent après la sortie) et de la difficulté à traiter de petits effectifs d'événements
Aucun indicateur n'est proposé par exemple sur les infections urinaires, pourtant très fréquentes, puisque la morbidité induite est faible et les mesures de prévention auront un impact plus limité.
Les pneumonies liées à la ventilation artificielle ont été écartées en raison des difficultés de recueil précis de ces événements.
o Les données publiées doivent être utiles pour le public, mais surtout pour les établissements, pour accompagner leurs efforts d'amélioration de la qualité. Il a été démontré que le retour d'informations vers les professionnels sur les taux d'ISO par exemple constituait un incitatif fort à s'améliorer. Cela a pu être observé dans les systèmes privés de recueil et de restitution dans des établissements volontaires.
o Il faut cependant éviter le biais d'observation qui conduirait à ce que les établissements assurant le meilleur recueil soient pénalisés du fait même qu'ils comptabilisent correctement les IN ! Des incitations pour le recueil seraient utiles.
o Le système doit être conçu au sein d'un groupe multidisciplinaire associant des professionnels de l'infection liée aux soins, des institutionnels, des usagers, des fournisseurs de soins.
o Un système de validation des données doit être mis en place.
o Le Comité remarque en outre qu'il ne faut pas arriver à une situation où trop d'énergie et de temps sont mis dans le recueil et l'exploitation des données, au détriment du temps passé à la prévention et aux soins...
|
Synthèse La diffusion publique de données de résultats de soins poursuit deux objectifs : la transparence vis-à-vis des usagers, et l'incitation des établissements à s'améliorer, via un effet de réputation. En pratique, ces démarches ne produisent pas d'effets favorables évidents dans les pays qui se sont lancés dans cette démarche. Elles présentent par contre le risque de pervertir la qualité des données si les établissements se trouvent pénalisés par un mauvais classement. Pour contourner cet inconvénient, les Etats-Unis ont par exemple mis en place des structures neutres indépendantes qui collectent les données d'accidents médicaux par établissement de manière anonyme, dans un esprit d'amélioration de la qualité de soins. L'intérêt de ces procédures est surtout de produire un nouvel incitatif en faveur de mesures de prévention au sein des établissements de santé. La diffusion de données comparatives aux établissements eux-mêmes a un intérêt démontré pour les inciter à s'améliorer. Il pourrait être ainsi conçu deux modèles de tableau de bord : un pour le grand public, donnant une information robuste et claire, un pour les établissements, plus détaillé, plus complet, plus opérationnel. La France a engagé en matière d'IN une politique de publication d'indicateurs, les établissements étant répartis en catégories homogènes pour produire des comparaisons valides. Le premier de ces indicateurs, l'ICALIN, indicateur de moyens, a été publié début 2006. Doivent suivre l'indicateur sur la consommation de produits hydro-alcooliques et celui sur le taux de Staphylocoques dorées résistants à la méticilline. |
G. ETUDE JURIDIQUE
Le rappel du régime actuel d'indemnisation de l'infection nosocomiale
Il convient, pour connaître le régime actuel d'indemnisation de l'infection nosocomiale, de rappeler le droit commun applicable à l'indemnisation des risques sanitaires (A), puis d'examiner le mécanisme spécifique de responsabilité et de réparation concernant les infections nosocomiales (B).
A) LE RÉGIME DE DROIT COMMUN APPLICABLE À L'INDEMNISATION DES RISQUES SANITAIRES RÉSULTANT DU FONCTIONNEMENT DU SYSTÈME DE SANTÉ
Le nouveau régime légal de responsabilité applicable à l'indemnisation des risques sanitaires, issu de la loi n° 2002-303 du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé , est énoncé aux articles L 1142-1 et s. du code de la santé publique .
o Il est étroitement lié à l'institution d'une procédure de règlement amiable des conséquences des risques sanitaires gérée par les commissions régionales de conciliation et d'indemnisation des accidents médicaux, des affections iatrogènes et des infections nosocomiales (CRCI), la Commission nationale des accidents médicaux (CNAM) et l'Office national d'indemnisation des accidents médicaux, des affections iatrogènes et des infections nosocomiales (ONIAM). Cette nouvelle procédure a pour objectif d'éviter pour le patient victime d'un dommage le recours à la justice.
o Il comporte sept volets majeurs.
1 - L'information du patient ou de sa famille, en cas de dommage
L'article L. 1142-4 du Code de la santé publique, dans sa rédaction issue de la loi du 4 mars 2002 sur les droits des malades et la qualité du système de santé, indique que toute personne victime ou s'estimant victime d'un dommage imputable à une activité de prévention, de diagnostic ou de soins doit être informée des causes et des circonstances de ce dommage . L'information doit être assurée par le professionnel, l'établissement de santé ou l'organisme concerné. Un entretien a lieu dans les quinze jours suivant la découverte du dommage ou la demande expresse du patient, qui peut se faire assister d'un médecin ou d'une personne de son choix.
L'information est délivrée le cas échéant au représentant légal de l'intéressé et, en cas de décès, aux ayants droit.
L'article L. 1142-4 est complété par deux dispositions, la première prévoyant une mise en demeure éventuelle de la part de l'autorité de tutelle (art. L. 1413-13), la seconde imposant la déclaration du dommage à l'autorité administrative compétente (art. L. 1413-14).
2 - La mise en oeuvre de la responsabilité uniquement en cas de faute (art. L 1142-1 I du code de la santé publique)
Désormais, hors le cas où leur responsabilité est encourue en raison d'un défaut d'un produit de santé, les professionnels de santé, les établissements, services ou organismes dans lesquels sont réalisés des actes individuels de prévention, de diagnostic ou de soins ne sont responsables des conséquences dommageables d'actes de prévention, de diagnostic ou de soins qu ' en cas de faute .
Ce principe exclut toute décision de justice condamnant un acteur de santé en l'absence de faute. La position consistant pour le juge administratif, à des conditions très strictes et dans les domaines spécifiques qui sont la thérapeutique nouvelle, l'acte à risque et la transfusion de produits sanguins, à prononcer la responsabilité des hôpitaux publics, alors même qu'aucune faute ne pouvait être relevée à leur encontre, ne peut à présent plus être retenue .
Cette solution est donc rassurante pour les établissements et professionnels de santé.
3 - La mise en oeuvre d'un disposititf de solidarité nationale en l'absence de faute
(art. L 1142-1 II du code de la santé publique)
En l'absence de faute, la solidarité nationale se substitue à la responsabilité. Elle ne joue cependant qu'à certaines conditions .
o L'acte en cause est directement imputable à des actes de prévention, de diagnostic ou de soins.
o Il a eu pour le patient des conséquences anormales au regard de son état de santé comme de l'évolution prévisible de celui-ci.
o Il présente un caractère de gravité apprécié au regard de la perte de capacités fonctionnelles et des conséquences sur la vie privée et professionnelle mesurées en tenant notamment compte du taux d'incapacité permanente ou de la durée de l'incapacité temporaire de travail.
L'article D 1142-1 du code de la santé publique précise cette notion de gravité. Le taux d'incapacité permanente ouvrant droit à réparation au titre de la solidarité nationale doit être supérieur à 24 %. Le caractère de gravité est également constitué lorsque la durée de l'incapacité temporaire de travail est au moins égale à six mois consécutifs ou à six mois non consécutifs sur une période de douze mois. A titre exceptionnel, le caractère de gravité peut également être reconnu lorsque la victime est déclarée définitivement inapte à exercer l'activité professionnelle qu'elle exerçait antérieurement ou lorsque l'acte en cause entraîne des troubles particulièrement graves , y compris d'ordre économique, dans ses conditions d'existence.
L'indemnisation, au titre de la solidarité nationale, des risques survenus en l'absence de faute est de la compétence de l'ONIAM La saisine directe de cette instance par le patient est impossible ; seule une CRCI ou le juge peut y procéder.
Attention, il est important de bien noter que la solidarité ne joue que si le dommage dépasse le seuil ou correspond aux critères énoncés à l'article D 1142-1 du code de la santé publique. S'il n'en est pas ainsi, il n'existe aucun recours possible pour la victime, sauf assurance volontaire et personnelle.
4 - La mise en place d'une procédure de règlement amiable
Les instances nouvelles sont les suivantes :
o Au niveau régional, les CRCI
o Au niveau national, l'ONIAM
En vue d'un règlement amiable, les CRCI ne peuvent être saisies qu'au-delà d'un certain seuil de préjudice .
Ce seuil est le même que celui qui vient d'être énoncé pour la solidarité nationale. La procédure, y compris l'expertise, est gratuite. Les délais sont limités (onze mois pour aboutir).
5 - Le délai de prescription de l'action en responsabilité (art. L 1142-28 du code de la santé publique)
Les actions tendant à mettre en cause la responsabilité des professionnels de santé ou des établissements de santé publics ou privés à l'occasion d'actes de prévention, de diagnostic ou de soins se prescrivent par dix ans à compter de la consolidation du dommage.
Un délai unique de prescription de l'action en responsabilité est aujourd'hui utilisé (auparavant prescription quadriennale pour les établissements publics de santé ; prescription trentenaire pour les établissements privés et les professionnels de santé).
6 - L'assurance obligatoire des professionnels et établissements de santé (art. L 1142-2 du code de la santé publique)
Les professionnels de santé exerçant à titre libéral, les établissements de santé, services de santé et organismes, et toute autre personne morale, autre que l'Etat, exerçant des activités de prévention, de diagnostic ou de soins ainsi que les producteurs, exploitants et fournisseurs de produits de santé, sont tenus de souscrire une assurance destinée à les garantir pour leur responsabilité civile ou administrative susceptible d'être engagée en raison des dommages subis par des tiers et résultant d'atteintes à la personne, survenant dans le cadre de l'ensemble de cette activité.
Une dérogation à l'obligation d'assurance peut être accordée par arrêté du ministre chargé de la santé aux établissements publics de santé disposant de ressources financières leur permettant d'indemniser les dommages dans des conditions équivalentes à celles qui résulteraient d'un contrat d'assurance. L'Assistance Publique-Hôpitaux de Paris a bénéficié d'une telle exonération par un arrêté du 3 janvier 2003.
7 - L'entrée en vigueur du mécanisme de réparation issu de la loi du 4 mars 2002
Le nouveau mécanisme de réparation s'applique aux accidents médicaux, aux affections iatrogènes et aux infections nosocomiales consécutifs à des actes de prévention, de diagnostic ou de soins réalisés à compter du 5 septembre 2001 .
Ce mécanisme s'applique à partir de cette date même si des instances sont en cours, à moins qu'une décision de justice irrévocable n'ait été prononcée.
B) LE MÉCANISME SPÉCIFIQUE DE RESPONSABILITÉ ET DE RÉPARATION CONCERNANT LES INFECTIONS NOSOCOMIALES
La même loi n° 2002-303 du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé a mis en place, pour les infections nosocomiales, un régime spécifique de responsabilité.
Ce régime légal d'indemnisation de l'infection nosocomiale intéresse uniquement les infections contractées à compter du 5 septembre 2001. Un rappel du régime antérieur au 5 septembre 2001 reste nécessaire.
1 - Le régime applicable aux infections nosocomiales contractées antérieurement au 5 septembre 2001
Les solutions sont entièrement jurisprudentielles.
Elles varient selon le secteur de soins.
o L'infection nosocomiale est contractée dans un établissement de santé privé ou consécutivement à l'intervention de médecins libéraux.
o Le juge suprême fait peser sur les cliniques privées, les établissements participant au service public hospitalier, les médecins libéraux, une obligation de sécurité de résultat dont ils ne peuvent se dégager qu'en prouvant la cause étrangère (C. Cass. 29 juin 1999, Gaz. Pal., Rec. 1999, somm. p. 436).
o L'infection nosocomiale est contractée dans un établissement public de santé.
Les hôpitaux publics, pour échapper à leur responsabilité en cas d'infections nosocomiales, ont l'obligation de prouver l'absence de faute ou encore le respect de toutes les normes d'asepsie (CE 9 déc. 1988, Cohen, D. 1990, p. 487 ; TA Rouen, 17 août 2001, Petites Affiches 2002, n° 50, p. 14).
2 - Le régime applicable aux infections nosocomiales contractées postérieurement au 5 septembre 2001
o Désormais, un régime particulier d'indemnisation est prévu aux articles L 1142-1 et L 1142-1-1 du code de la santé publique pour les infections nosocomiales.
o o Dans le cas où un établissement de santé est en cause, de quelque nature qu'il soit, la victime est placée dans une situation privilégiée . La responsabilité est automatique sauf preuve d'une cause étrangère , c'est-à-dire faute de la victime (patient porteur d'un germe infectieux), fait d'un tiers (fournisseur de l'établissement dont la prestation entraîne l'infection), force majeure (cyclone entraînant la destruction des mécanismes de vigilance) ou cas fortuit (inhérent aux installations sanitaires).
o Ce régime de responsabilité automatique est limité aux établissements de santé. Si l'infection nosocomiale a son origine dans un cabinet de ville d'un professionnel de santé , la victime doit prouver la faute selon le régime de droit commun.
Enfin, lorsque la responsabilité d'un professionnel ou d'un établissement de santé n'est pas engagée 17 ( * ) , une infection nosocomiale ouvre droit à la réparation des préjudices du patient et, en cas de décès, de ses ayants droit au titre de la solidarité nationale selon les conditions strictes précédemment définies à l'article L 1142. 1 II et D 1142-1 du code de la santé publique.
Il est indispensable de rappeler que lors de l'entrée en vigueur de la loi n° 2002-303 du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé, la charge financière de toutes les infections nosocomiales pesait sur les établissements de santé (via leurs compagnies d'assurances). Or, il était (et il demeure) difficile de s'exonérer de sa responsabilité à cause du nouveau régime institué. Aussi, les assureurs ont fait connaître leur mécontentement en menaçant de se retirer du marché de l'assurance responsabilité civile obligatoire. La loi n° 2002-1577 du 30 décembre 2002 relative à la responsabilité civile médicale adoptée très rapidement a atténué la portée des dispositions de la loi précitée du 4 mars 2002 en introduisant différentes modifications :
Les dommages résultant d'infections nosocomiales graves dans les établissements, services ou organismes dans lesquels sont réalisés des actes individuels de prévention, de diagnostic ou de soins entraînant soit un taux d'incapacité permanente partielle (IPP) supérieure à 25 %, soit le décès de la victime, sont pris en charge par la solidarité nationale (via l'ONIAM).
o L'ONIAM dispose d'une action subrogatoire possible en cas de faute établie de l'établissement, notamment dans l'hypothèse d'un manquement caractérisé aux obligations posées par la réglementation en matière de lutte contre les infections nosocomiales.
Une large information sur les établissements de santé concernés par des cas d'infections nosocomiales à l'origine soit d'une IPP supérieure à 25%, soit d'un décès, est réalisée.
o o La CRCI compétente doit signaler sans délai cette infection au directeur de l'agence régionale de l'hospitalisation (ARH) et à l'ONIAM (art. L 1142-8 du code de la santé publique).
o o Lorsque l'ONIAM doit indemniser des victimes d'infections nosocomiales à la suite d'une décision de justice, il doit signaler sans délai l'infection nosocomiale au directeur de l'ARH (art. L 1142-21 du code de la santé publique).
o o L'ONIAM doit adresser au Gouvernement, au Parlement et à la Commission nationale des accidents médicaux un rapport d'activité semestriel. Ce rapport comporte notamment une partie spécifique sur les infections nosocomiales dont l'office a eu connaissance en application des articles L 1142-8 et L 1142-21 du code de la santé publique. Il est rendu public (art. L 1142-22-1 du code de la santé publique).
o Dans les autres cas d'infections nosocomiales (celles qui sont à l'origine d'une IPP inférieure à 25%), lorsque l'établissement de santé n'établit pas la cause étrangère, l'établissement (via son assureur) assure l'indemnisation financière du patient victime d'une infection nosocomiale.
Dans les cas d'aggravation des dommages résultant d'une infection nosocomiale, qui entraînent ultérieurement une IPP supérieure à 25% ou le décès du patient, la solidarité nationale indemnise le patient et rembourse à l'assureur les indemnités initialement versées à la victime.
Les mêmes règles que pour le droit commun (seuils de gravité du préjudice) s'appliquent pour l'accès aux CRCI (règlement amiable).
o N.B.
La mise en oeuvre de la loi n° 2002-1577 du 30 décembre 2002 a posé le problème de la rétroactivité des modifications insérées qui aboutissent au transfert de la charge financière des infections nosocomiales les plus graves à la solidarité nationale. Lors de sa réunion du 22 octobre 2003, le Conseil d'administration de l'ONIAM a considéré à l'unanimité (avec une abstention) que la loi du 30 décembre 2002 n'a pas de portée rétroactive et s'applique aux infections nosocomiales survenues après le 1 er janvier 2003. A ce jour, plusieurs contentieux relatifs à la question de l'application dans le temps de ces dispositions sont en cours. Deux décisions ont été prises en faveur de l'application rétroactive de ces dispositions à compter du 5 septembre 2001. Quatre décisions ont été prises en sens inverse (rapport de l'ONIAM, 2 ème semestre 2005, en cours de publication).
o Régime légal de réparation des risques sanitaires
depuis la loi du 4 mars 2002
|
DROIT COMMUN |
INFECTIONS NOSOCOMIALES |
|
Principes Hypothèse de la faute - Victime prouve la faute Hypothèse de l'absence de faute - Si absence de faute et conditions réunies : solidarité nationale par Oniam - Conditions (3) : o Lien direct o Conséquences anormales au regard état antérieur o Gravité § Soit IPP supérieure à 24% § Soit ITT 6 mois § Soit inaptitude professionnelle § Soit troubles conditions d'existence |
Principe s Hypothèse de la faute Etablissements de santé - Etablissement responsable sauf preuve cause étrangère Médecin libéral - Victime prouve la faute Si IPP supérieure à 25% ou décès, l'Oniam paie et peut se retourner contre le responsable (loi About) Hypothèse de l'absence de faute L'établissement prouve la cause étrangère. Ou encore le professionnel libéral prouve qu'il n'a pas commis de faute. La victime a droit à la solidarité nationale aux mêmes conditions que dans le droit commun. o Soit IPP supérieure à 24% o Soit ITT 6 mois o Soit inaptitude professionnelle o Soit troubles conditions d'existence |
|
Procédure (règlement amiable) Accès à CRCI (et si besoin Oniam pour solidarité nationale) - Soit IPP supérieure 24% - Soit ITT 6 mois - Soit inaptitude professionnelle - Soit troubles dans conditions d'existence (mêmes seuils de gravité que pour la solidarité nationale) |
|
|
o o o Synthèse des points essentiels du régime juridique applicable aux infections nosocomiales depuis l'entrée en vigueur de la loi n° 2002-303du 4 mars 2002 o o Le texte confirme la jurisprudence de la Cour de cassation et retient un régime favorable au patient hospitalisé dans un établissement de santé. o o En conséquence, il est difficile pour un établissement de santé de s'exonérer de sa responsabilité. La preuve du respect des règles d'hygiène et d'asepsie n'est plus suffisante. o o Une différence existe entre les patients victimes selon que l'infection nosocomiale est consécutive à une prise en charge par un établissement de santé ou un professionnel de santé. Dans la première hypothèse, il y a renversement de la charge de la preuve et il incombe à l'établissement de s'exonérer de sa responsabilité par la preuve de la cause étrangère ; dans la seconde, il incombe au patient de prouver la faute du professionnel de santé. o o La solidarité nationale assure la prise en charge financière des infections nosocomiales les plus importantes (décès ou IPP supérieure à 25%) avec une possibilité d'action subrogatoire ; les autres sont indemnisées par les compagnies d'assurance. o o Des interrogations subsistent sur la rétroactivité de la loi du 30 décembre 2002 relative à la responsabilité civile médicale, dans l'attente de décisions de justice irrévocables. La charge financière des dommages générés par les infections nosocomiales les plus graves survenues entre le 5 septembre 2001 et le 30 décembre 2002 pèse-t-elle sur les compagnies d'assurance ou sur l'ONIAM ? |
o L'enquête réalisée auprès des organismes et professionnels de sante
A) LA MÉTHODOLOGIE UTILISÉE
Afin d'analyser les effets et le coût des indemnisations accordées aux patients victimes d'infections nosocomiales, une enquête a été menée auprès des acteurs directement concernés par le mécanisme spécifique de responsabilité applicable aux infections nosocomiales :
o L'Office national d'indemnisation des accidents médicaux, des affections iatrogènes et des infections nosocomiales (ONIAM).
o Les assureurs et l'Assistance Publique - Hôpitaux de Paris :
La S.H.A.M. qui assure 915 établissements de santé et un peu moins de 1000 professionnels ayant une activité libérale.
La M.A.C.S.F qui assure 280 000 professionnels de santé et une dizaine de cliniques privées.
La direction des affaires juridiques de l'Assistance publique-Hôpitaux de Paris (qui est son propre assureur pour 39 établissements, 18 000 médecins et 52 000 personnels soignants non médicaux).
o Les professionnels de santé :
Professeur Alain LORTAT-JACOB, Chirurgie orthopédique, Hôpital Ambroise Paré, Assistance Publique-Hôpitaux de Paris
Docteur Jean-Pierre SOLLET, Réanimation polyvalente, Centre hospitalier Victor Dupouy, Argenteuil
Professeur Alain VAILLANT, Chirurgie cardiaque, Clinique Clairval, Marseille
Les résultats de l'enquête reposent essentiellement sur les réponses apportées aux questionnaires communiqués à ces différents acteurs, croisées avec les rapports semestriels de l'ONIAM et les rapports annuels de la Commission nationale des accidents médicaux.
B) LA SYNTHÈSE DES RÉSULTATS
Un premier constat s'impose . Il porte sur la difficulté à obtenir la communication de chiffres précis concernant les demandes d'indemnisation des victimes d'infections nosocomiales. Certains des acteurs interrogés ont été dans l'impossibilité de nous transmettre le nombre exact des indemnisations financières octroyées en la matière.
L'article L 1142-29 du code de la santé publique a institué une commission rattachée à l'ONIAM à laquelle doivent être communiquées les données relatives aux accidents médicaux, affections iatrogènes et infections nosocomiales et à leur indemnisation par les assureurs des professionnels et organismes de santé, par les établissements chargés de leur propre assurance, par la CNAM ainsi que les CRCI. Le recueil et l'analyse des données qui lui sont transmises peuvent être délégués et font l'objet, sous son contrôle, d'une publication périodique. Cette commission prend toutes dispositions pour garantir la confidentialité des informations recueillies.
Au jour de la rédaction du présent rapport, cette commission ne dispose pas encore des données concernant les infections nosocomiales.
1 - Les indemnisations accordées par l'ONIAM
L'ONIAM est au coeur du dispositif d'indemnisation des patients victimes d'infection nosocomiale. Il assure la prise en charge financière des infections les plus lourdes (IPP supérieure à 25% ou décès).
Les chiffres cités ci-dessous sont extraits pour l'essentiel des rapports d'activité successifs de l'ONIAM des années 2003, 2004 et 2005.
LES CAS D'INDEMNISATION DANS LE CADRE DE LA SAISINE DE LA CRCI
o En 2003 , 1 907 dossiers de demande d'indemnisation ont été déposés auprès des CRCI Sur les 87 avis rendus au fond, 26 constituaient des avis de rejet, après expertise, 6 comportaient des demandes de nouvelle expertise ou d'expertise complémentaire. Sur les 55 avis restants, 13 étaient relatifs à des infections nosocomiales. 11 avis portaient sur des faits antérieurs au 1er janvier 2003. 2 avis concernaient des faits postérieurs au 1er janvier 2003 mais n'étaient pas indemnisables par l'ONIAM car les conditions prévues par la loi (décès ou IPP supérieure à 25%) n'étaient pas remplies. Ces deux avis ont été transmis aux assureurs des établissements de santé concernés pour faire l'objet d'une indemnisation dans les conditions de droit commun.
o Au cours de cette année, l'ONIAM n'a pas été amené à indemniser des victimes d'infection nosocomiale.
o En 2004 , 3 553 dossiers de demande d'indemnisation ont été déposés auprès des CRCI. Sur les 1 226 avis rendus au fond, l'ONIAM a été destinataire pour indemnisation de 19 avis d'infections nosocomiales entrant dans le champ d'application de l'article L 1142-1-1 du code de la santé publique (décès ou taux d'IPP >25%) et ouvrant droit à la prise en charge par la solidarité nationale.
o En 2005 , 2 939 dossiers de demande d'indemnisation ont été déposés auprès des CRCI. Sur les 2 113 avis rendus au fond, l'ONIAM a été destinataire pour indemnisation de 48 avis d'infections nosocomiales entrant dans le champ d'application de l'article L 1142-1-1 du code de la santé publique (décès ou taux d'IPP >25%) et ouvrant droit à la prise en charge par la solidarité nationale.
LES CAS D'INDEMNISATION DANS LE CADRE D'UNE PROCÉDURE JUDICIAIRE
Il s'agit des hypothèses où la juridiction compétente a été saisie d'une demande d'indemnisation des conséquences dommageables d'un acte et estime que les dommages subis en raison d'une infection nosocomiale sont indemnisables au titre de la solidarité nationale ; l'ONIAM est appelé en la cause s'il ne l'avait pas été initialement. Il devient défendeur en la procédure.
Au jour de la rédaction du présent rapport, l'ONIAM a été appelé dans 14 contentieux supposant une infection à l'origine d'une IPP>25% :
o Dans 4 cas, l'ONIAM a été mis hors de cause pour non atteinte des seuils.
o Dans 4 cas, l'ONIAM a été mis hors de cause pour accident antérieur à la loi du 30 décembre 2002.
o Dans 2 cas, l'ONIAM a été condamné, bien que l'accident soit antérieur à la loi du 30 décembre 2002.
o Le reste est en cours d'instance.
LES MONTANTS D'INDEMNISATION ACCORDÉS
Aucune réponse n'a été apportée sur le montant exact et le coût total des indemnisations accordées par l'ONIAM dans le cadre des infections nosocomiales.
Il a été précisé que l'appréciation du préjudice est strictement identique à ce qui se fait pour l'ensemble des dossiers traités par l'ONIAM.
En particulier, l'ONIAM suit, en matière d'infections nosocomiales, son barème comme pour les autres cas (cf. barème indicatif diffusé sur le site internet : http://www.oniam.fr).
|
Synthèse des points essentiels des indemnisations accordées par l'ONIAM o o Le coût total des infections nosocomiales à la charge de la solidarité nationale n'est pas connu dans le détail. Il obéit au barème général applicable à tous les dossiers traités par l'ONIAM. o o Le nombre d'avis portant sur les infections nosocomiales les plus graves et justifiant une saisine de l'ONIAM a plus que doublé en deux ans. o o Pour autant, le nombre d'avis rendu paraît peu important au regard du nombre de décès imputables, chaque année, à des infections nosocomiales (nombre estimé entre 2 000 et 4 000 décès par an). |
2 - Les conséquences judiciaires des infections nosocomiales
Il est difficile dans le pays de connaître avec précision la nature des poursuites judiciaires et leurs conséquences au plan médical. Nul observatoire n'existe en ce domaine ; nul recensement en provenance du Ministère de la justice n'est réalisé.
Les assureurs eux-mêmes ne sont pas tous en mesure de fournir des chiffres exacts en matière d'infections nosocomiales résultant pourtant de la gestion de leur propre portefeuille de clients. Les observations suivantes peuvent être formulées.
SUR LES DÉCLARATIONS DE SINISTRE
D'après les statistiques élaborées par la S.H.A.M. (cf. graphique ci-après), les déclarations de sinistres 18 ( * ) concernant des infections nosocomiales ont presque triplé de 2002 à 2004 . Il en est de même du coût des sinistres. En 2004, 721 déclarations de sinistres portaient sur des infections nosocomiales et représentaient un coût total de 16,3 millions d'euros ; le poids des sinistres d'infections nosocomiales dans le coût total des sinistres était de 17%.
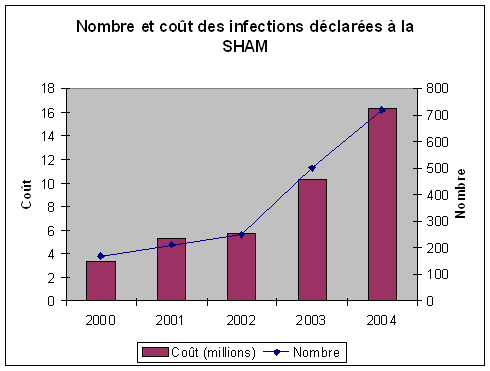
SUR LES INDEMNISATIONS RÉSULTANT DES RÉCLAMATIONS ISSUES DES CRCI
En 2004, selon le panorama du risque médical des établissements de santé édité par la S.H.A.M., parmi les 15% d'avis émis par les CRCI mettant l'indemnisation de la victime à la charge de l'assureur, près de la moitié étaient consécutifs à des infections nosocomiales pour lesquelles les établissements de santé étaient automatiquement responsables.
Il est précisé que l'analyse des prochains exercices permettra d'apprécier les effets de la loi du 30 décembre 2002 qui a mis à la charge de l'ONIAM les conséquences des infections nosocomiales entraînant une incapacité permanente partielle supérieure à 25% ou le décès du patient.
SUR LES INDEMNISATIONS RESULTANT DES PROCÉDURES JUDICIAIRES
Aucun des assureurs interrogés n'est à ce jour capable de déterminer ni le nombre de contentieux en cours portant sur les infections nosocomiales, ni le nombre des affaires jugées ayant donné lieu à des condamnations au cours des trois années précédentes.
De même, l'Assistance Publique - Hôpitaux de Paris n'a pas pu fournir, au jour de la rédaction du présent rapport, d'éléments de réponse.
Il est donc impossible de définir la nature des contentieux (civil, administratif ou pénal) ainsi que le montant des indemnités attribuées aux patients ayant subi une infection nosocomiale.
Par contre, il apparaît clairement que les disciplines médicales les plus touchées par les infections nosocomiales dans les contentieux sont la chirurgie orthopédique, la chirurgie cardiaque et thoracique, la neurochirurgie et la chirurgie urologique.
|
Synthèse des points essentiels des conséquences judiciaires des infections nosocomiales o o Le coût exact des indemnisations financières octroyées dans le cadre des procédures contentieuses reste inconnu. C'est là un constat important. o o L'essentiel des contentieux est lié à un acte chirurgical. La chirurgie orthopédique est particulièrement concernée. o o Selon les chiffres de la S.H.A.M., le coût des sinistres portant sur des infections nosocomiales a triplé en l'espace de trois ans du fait de la multiplication par trois du nombre de réclamations formulées en ce domaine. o o Selon la S.H.A.M., en 2004, la moitié des avis émis par les CRCI mettant à la charge de l'assureur des indemnisations concernait des infections nosocomiales. |
o 3 - L'impact des infections nosocomiales sur les professionnels et les établissements de santé
Il convient à présent de mesurer et d'analyser l'impact des infections nosocomiales sur les professionnels et établissements de santé sous deux angles :
o L'assurabilité
o Le ressenti psychologique.
SUR LA DÉTERMINATION DE LA POLICE D'ASSURANCE ET LE MONTANT DES PRIMES D'ASSURANCE
Seule la S.H.A.M. parmi les assureurs interrogés a depuis 2004 introduit une franchise dans les contrats nouveaux ou renouvelés pour les sinistres dus à une infection nosocomiale, équivalente à 20% des dommages avec un minimum de 10 000 euros et un maximum égal au montant de la cotisation d'assurance annuelle.
Les polices d'assurances n'intègrent pas de plafond de garantie propre aux infections nosocomiales.
L'IMPACT DU TAUX D'INFECTION NOSOCOMIALE SUR LA PRIME D'ASSURANCE
La S.H.A.M. exige de tout établissement souhaitant s'assurer en responsabilité civile médicale et hospitalière la production de sa statistique « sinistres » sur 10 ans si possible. Les réclamations résultant d'infections nosocomiales sont ainsi connues par la société.
A l'inverse, la M.A.C.S.F. n'a pas cette exigence.
L'IMPACT DE LA GESTION DU RISQUE NOSOCOMIAL SUR LA PRIME D'ASSURANCE
La S.H.A.M. effectue depuis 2005 une visite des zones à risques, comme le bloc opératoire dans les établissements de court séjour candidats à l'assurance. Cette visite est effectuée à partir d'un référentiel incluant les questions relatives à la prévention des infections nosocomiales. La cotisation est fixée en fonction de l'exposition au risque, et des rabais sont consentis si l'établissement assuré met en oeuvre les recommandations de la compagnie.
Les compagnies d'assurances recommandent toutes bien évidemment la mise en place d'une politique de gestion des risques propre aux infections nosocomiales, notamment le respect de la réglementation et des normes applicables ainsi que des préconisations élaborées par elles. Pour autant, le non respect des règles de prévention ne peut conduire à un refus de prise en charge du sinistre, lorsqu'il survient.
Les assureurs acceptent de baisser la prime d'assurance quand le professionnel ou l'établissement de santé assuré ne connaît pas de sinistre et déploie une politique active de gestion du risque nosocomial. La mise en oeuvre d'une minoration (ou à l'inverse d'une majoration) du tarif concerne toutes les activités à risque, et pas uniquement la lutte contre les infections nosocomiales. En ce qui concerne la S.H.A.M., pour les établissements ayant choisi un tarif modulable, le cumul des boni successifs peut atteindre 15%.
L'IMPACT DES NOUVELLES RÈGLES LÉGALES APPLICABLES À LA PRISE EN CHARGE DES INFECTIONS NOSOCOMIALES
Selon la S.H.A.M., de multiples facteurs ont conduit à la majoration des tarifs des assurances souscrites par les établissements de santé sur la période 2002-2005. Pour autant, la loi du 30 décembre 2002 a restauré « l'assurabilité » des établissements de santé d'une part en aménageant le fonctionnement dans le temps des contrats d'assurance responsabilité civile, d'autre part en transférant une partie de la charge de l'indemnisation des infections nosocomiales sur l'ONIAM (celles correspondant à une IPP supérieure à 25% ou à un décès).
Selon la M.A.C.S.F., les nouvelles règles d'indemnisation du risque nosocomial n'ont pas eu à ce jour d'effet sur le montant des primes.
SUR LE RESSENTI PSYCHOLOGIQUE DES PROFESSIONNELS DE SANTÉ LIÉ À LA JUDICIARISATION DE LEUR ACTIVITÉ
Il est important de noter que le nombre de professionnels de santé interrogés (3) n'est en rien représentatif de l'ensemble des pratiques mises en oeuvre en matière d'infections nosocomiales. Les réponses appellent toutefois quelques commentaires.
Le dispositif juridique global à respecter lors de la survenue d'infection nosocomiale est connu des trois professionnels de santé (signalement aux autorités sanitaires, protocoles à appliquer, information des professionnels, etc.). En particulier, les nouvelles dispositions introduites par la loi du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé imposant une information des patients sont bien appliquées même si le terme « nosocomial » n'est pas toujours utilisé. Cette information est délivrée dès la confirmation du diagnostic. D'ailleurs, les professionnels de santé savent tous que le fait de ne pas informer un patient de la survenue d'une infection nosocomiale peut engager leur responsabilité.
Les trois professionnels interrogés procèdent à des bilans et des prélèvements systématiques des patients lors de leur admission à l'hôpital, notamment lorsque ceux-ci viennent d'autres structures de soins (ex : centres de long et de moyen séjour). Certains vont même jusqu'à réaliser des prélèvements hebdomadaires jusqu'à la sortie du patient.
Deux professionnels sur les trois interrogés ont déjà connu (eux-mêmes ou les services dans lesquels ils exercent) une mise en cause en raison de dommages subis par le patient victime d'une infection nosocomiale. Certains craignent un engagement de leur responsabilité, mais connaissent le dispositif de prise en charge des infections nosocomiales introduit par la loi du 4 mars 2002 qu'ils trouvent adapté. C'est surtout la responsabilité pénale qui est redoutée.
|
Synthèse de l'impact des infections nosocomiales sur les professionnels et les établissements de santé o o Une attention est portée à la sinistralité attachée aux infections nosocomiales. Pour autant, la majoration ou la minoration des primes n'est pas spécifique aux infections nosocomiales et s'intègre aux activités dites à « risque ». o o Les assureurs sont de plus en plus vigilants quant aux démarches initiées en matière de lutte contre les infections nosocomiales et les prennent, le cas échéant, en considération. o o Les professionnels connaissent bien le régime juridique applicable aux infections nosocomiales et à leur indemnisation. Ils redoutent une éventuelle mise en cause. |
Les voies de réflexion
Après quatre années de mise en oeuvre, il est encore difficile d'établir un bilan au plan du droit. Le nouveau mécanisme de réparation des infections nosocomiales est utile et intéressant. Il n'est probablement pas encore parfait et pourrait être amélioré.
Trois voies de réflexion se présentent.
A) PREMIÈRE VOIE DE REFLEXION : QUELLE VALEUR POUR LE RÉGIME ACTUEL D'INDEMNISATION DES INFECTIONS NOSOCOMIALES ?
1 - Le régime actuel est complexe
o L'indemnisation est tantôt supportée par la solidarité nationale pour les infections nosocomiales les plus graves (IPP supérieure à 25% ou décès) contractées dans un établissement, service ou organisme dans lesquels sont réalisés des actes individuels de prévention, de diagnostic ou de soins, tantôt par les assureurs dans les autres cas. Cette distinction n'existait pas lors de l'entrée en vigueur de la loi n° 2002-303 du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé19 ( * ). Elle a été introduite par la loi n° 2002-1577 du 30 décembre 2002 relative à la responsabilité civile médicale.
o Il existe des incertitudes quant à la date d'entrée en application de la loi précitée du 30 décembre 2002. La règle du transfert de la charge financière des infections nosocomiales les plus graves à la solidarité nationale a-t-elle ou non une portée rétroactive ? En d'autres termes, s'applique-t-elle aux infections nosocomiales contractées après le 5 septembre 2001 ou de manière plus restrictive aux seules infections nosocomiales survenues après le 1er janvier 2003 ? A ce jour, aucune réponse certaine n'a été apportée ; la jurisprudence est d'ailleurs partagée.
o Lorsque la responsabilité de l'établissement ou du professionnel de santé n'est pas engagée, le patient peut saisir la CRCI qui renvoie l'affaire sur l'ONIAM. Attention, seuls les dommages présentant un certain caractère de gravité sont indemnisés (IPP supérieure à 24%, décès, incapacité temporaire de travail d'au moins 6 mois consécutifs,...) à ce titre. Ce seuil correspond à ce qui vient d'être dit pour la solidarité nationale.
o Ainsi, du point de vue de la victime , la procédure d'indemnisation est difficile à appréhender . Trois situations au minimum sont à distinguer.
§ La responsabilité de l'établissement de santé est engagée : le patient aura pour son indemnisation comme référent soit l'ONIAM (après saisine préalable de la CRCI) pour les infections nosocomiales les plus graves, soit l'assureur de l'établissement de santé dans les autres cas. Il peut également saisir le juge.
§ La responsabilité d'un professionnel de santé est engagée : le patient devra solliciter l'assureur du professionnel de santé. Il peut aussi saisir le juge.
Lorsque la responsabilité de l'établissement ou du professionnel de santé n'est pas engagée et que l'ONIAM refuse la prise en charge financière du préjudice consécutif à l'infection nosocomiale, le patient peut saisir la juridiction compétente. Mais, si celle-ci confirme la décision de l'ONIAM, aucune indemnisation ne sera versée à la victime, sauf si celle-ci avait souscrit une assurance personnelle couvrant ce risque.
2 - Le régime actuel est source d'inégalité
Le mécanisme de responsabilité applicable à l'infection nosocomiale n'est pas commun à toutes les formes de prise en charge. Des différences de traitement subsistent pour les professionnels et établissements de santé ainsi que pour les patients.
o Du point de vue des établissements et des professionnels de santé
La responsabilité des établissements de santé , qu'ils soient publics ou privés, est automatique, sauf preuve de la cause étrangère. Il y a un renversement de la charge de la preuve. Il incombe à la structure concernée d'apporter cette preuve pour s'exonérer de sa responsabilité.
En pratique, la cause étrangère est très difficile à démontrer. Il faut par exemple parvenir à soutenir avec succès que le patient était déjà porteur d'un germe lors de son arrivée dans l'établissement. C'est d'ailleurs pour cette raison que les établissements réalisent de plus en plus de prélèvements systématiques à l'admission du patient dans la structure.
Dans ces conditions, les assureurs et les établissements qu'ils représentent sont confrontés à une impossibilité presque absolue de s'exonérer de leur responsabilité . D'ailleurs, le triplement du coût des infections nosocomiales pour la S.H.A.M. depuis 2002 (date de mise en oeuvre du nouveau régime) ainsi que l'accroissement important du nombre d'indemnisations accordées par l'ONIAM illustrent certainement ce point.
Ce dispositif est d'autant plus pénalisant que la S.H.A.M. considère que 50% des infections nosocomiales contractées à l'hôpital sont inévitables, quelles que soient les mesures préventives déployées. Beaucoup d'infections survenant lors ou à la suite d'un séjour dans un établissement de santé ont pour origine, non pas l'hospitalisation, mais l'état de santé du patient ou les germes présents dans son organisme mais habituellement inoffensifs (cas spécifique des infections endogènes).
Quant aux professionnels de santé libéraux exerçant en cabinet, le régime de droit commun de la responsabilité est retenu. La responsabilité est engagée uniquement en cas de faute du professionnel concerné.
o Du point de vue du patient
Le patient victime d'une infection nosocomiale contractée dans un établissement de santé est dans une situation privilégiée , puisqu'il n'a pas à apporter la preuve de la faute.
A l'inverse, lorsque le dommage résulte d'une prise en charge libéral e dans un cabinet de ville, le patient doit prouver la faute du professionnel concerné.
B) DEUXIÈME VOIE DE REFLEXION : PEUT-ON ENVISAGER DE RENFORCER LE RÉGIME PRÉFÉRENTIEL ?
La protection du patient victime d'une infection nosocomiale pourrait-elle être accentuée ? Le champ de la solidarité nationale devrait alors être étendu.
Dans cette hypothèse, il serait nécessaire d'une part d'élargir le champ de la responsabilité automatique aux prises en charge libérales dans les cabinets de ville ; d'autre part d'abaisser le seuil d'indemnisation de l'infection nosocomiale par l'ONIAM.
Plusieurs questions se posent alors :
o Quels seuils pourraient être utilisés ?
o Quelles pourraient être les sources de financement d'une solidarité nationale qui serait une nouvelle fois élargie ?
o Doit-on transférer l'intégralité du risque nosocomial à la solidarité nationale ? Dans ce cas, quelle en est justification ?
Mais, l'extension de la solidarité nationale ne serait pas sans soulever certaines objections :
o Elle pourrait conduire à une déresponsabilisation progressive des établissements et professionnels de santé dans la lutte contre les infections nosocomiales. Afin de garantir un certain équilibre, il conviendrait de faciliter les voies de recours de l'ONIAM .
o Elle placerait la victime d'une infection nosocomiale dans une situation « privilégiée ». Le patient bénéficierait d'un régime plus favorable que la personne victime d'un autre risque médical. Une telle solution se justifierait t-elle ?
C) TROISIÈME VOIE DE RÉFLEXION : LE RÉGIME PRÉFÉRENTIEL POURRAIT-IL ÊTRE ALLÉGÉ SI CE N'EST SUPPRIMÉ ?
Le patient victime d'une infection nosocomiale ne disposerait plus alors du régime préférentiel d'indemnisation de l'infection nosocomiale.
Le mécanisme de responsabilité automatique de l'établissement de santé serait supprimé. La notion de faute serait réintroduite . Il serait alors clairement opportun de définir avec précision cette notion dans le cadre particulier de l'infection nosocomiale.
Dès lors, deux solutions seraient envisageables :
o Le régime de responsabilité pour faute de droit commun serait rétabli pour les infections nosocomiales. Dans ce cas, l'assureur n'assumerait que la responsabilité financière des infections nosocomiales fautives, par exemple celles liées à un non respect de la réglementation applicable en matière de lutte contre les infections nosocomiales, et cela quel que soit le degré de gravité du dommage.
o Les infections nosocomiales obéiraient à un régime de présomption de faute . Le professionnel ou l'établissement de santé pourrait s'exonérer de sa responsabilité par la preuve de l'absence de faute, en démontrant le respect des règles d'hygiène et d'asepsie. Il s'agit là de la solution jurisprudentielle retenue par la juridiction administrative antérieurement à la loi du 4 mars 2002.
Cette solution présenterait un inconvénient majeur, à savoir la non indemnisation de l'infection nosocomiale non fautive. Pour préserver une certaine cohérence, il faudrait maintenir une prise en charge de l'infection nosocomiale non fautive par la solidarité nationale .
D) AU VU DE CES TROIS VOIES DE RÉFLEXION, QUELLES CONSIDÉRATIONS PEUT-ON FAIRE EN TERMES DE RÉPARATION DES RISQUES SANITAIRES LIÉS AUX INFECTIONS NOSOCOMIALES ?
A ce jour, il est certainement trop tôt pour opter pour une voie plutôt qu'une autre. Les textes sont récents. Les premières applications en sont faites. Avant que d'envisager leur modification, mieux vaut approfondir les premiers bilans et les premiers effets.
L'accord doit être mis sur l' information des patients et des familles :
o En terme de risques d'infections nosocomiales, tout d'abord, lors d'actes de prévention, de diagnostic et de soins, quelque soit le mode de traitement : public, privé, en libéral ou en hospitalisation.
o En termes de dommage ensuite. La nécessité d'informer sur l'infection nosocomiale, lorsque le risque s'est réalisé, est encore mal connue dans les établissements. Sa pratique n'a rien de facile, mêlant transparence et nécessité de ne pas placer l'acteur de santé dans une situation difficile notamment vis-à-vis de sa compagnie d'assurances.
La rétroactivité ou l'absence de rétroactivité des dispositions de la loi du 30 décembre 2002 sur la responsabilité civile médicale pose question. Le texte attribue compétence à l'ONIAM pour réparer les conséquences des infections nosocomiales entraînant un lourd préjudice. S'applique-t-il pour les infections survenues à compter du 5 septembre 2001, ou seulement à compter du 1 er janvier 2003 ? Il y a là une question méritant d'être clarifiée .
Le risque lié aux infections nosocomiales en médecine de ville est mal connu 20 ( * ) . Le régime juridique de la réparation - cela a été exposé - n'est pas le même qu'en hospitalisation. Une telle différence en droit se justifie-t-elle par des éléments de fait qui seraient encore mal identifiés ?
Il conviendrait d'approfondir ce domaine de l'activité libérale placée face aux risques d'infections nosocomiales.
Les compagnies d'assurances peuvent mener, semble-t-il, des politiques de contrats d'assurances liés à la prévention des risques d'infections nosocomiales.
On ne peut qu'encourager de telles actions et conforter les organismes assurantiels qui agissent ainsi. L'ajustement primes-politique de gestion des risques nosocomiaux est à conforter et à renforcer.
Des organismes tels que la Fédération Française des Assurances ou encore le BCT (Bureau Commun de Tarification) pourraient être pilotes ou associés dans une telle démarche. Des actions de sensibilisation - formation pourraient être systématiquement proposées par les compagnies assurant le risque médical à leurs adhérents, portant sur la bonne gestion et la prévention des infections nosocomiales. Des abattements de primes ou au contraire des surcotes devraient être systématiquement pratiquées. Les compagnies ou mutuelles assurant le risque médical sont en fréquents contacts avec les autorités ministérielles chargées de la santé. Ce thème de la liaison primes-politique de gestion des risques nosocomiaux serait à intégrer dans les négociations.
|
Conclusion générale o Les effets et les coûts des réparations des risques sanitaires liées aux infections nosocomiales sont mal connus dans le pays. Ce constat n'est pas spécifique aux infections nosocomiales. Dans l'attente du fonctionnement de la commission mise en place auprès de l'ONIAM, les informations sont éparses sur le coût général des sinistres sanitaires. L'accent doit être mis sur la nécessité de disposer enfin de tous les éléments chiffrés nécessaires. o o Le régime de réparation des risques liés aux infections nosocomiales est spécifique. o o Ce régime est complexe. o o Ce régime est inégal pour les patients et les acteurs de santé, dépendant du mode de soins. o o Plusieurs voies de réflexion sont possibles : maintenir le régime juridique actuel ; renforcer encore la solidarité nationale dans le domaine des infections nosocomiales ; ou à l'inverse aligner la réparation du risque lié aux infections nosocomiales sur le régime juridique applicable à tous les accidents médicaux. o o Il est prématuré, peu de temps après la mise en oeuvre des dispositions liées à la loi du 4 mars 2002, de prétendre déjà à une modification de textes. o o Mais des travaux doivent se poursuivre dans les domaines suivants : Information des patients et de leurs familles Approfondissement des connaissances sur les risques nosocomiaux dans l'activité de ville Clarification de la rétroactivité ou de l'absence de rétroactivité de la loi du 30 décembre 2002 Incitation pour les organismes assurantiels à accentuer et renforcer la liaison primes-politique de prévention des risques d'infections nosocomiales |
H. ENQUETE IPSOS : SYNTHÈSE DES RÉSULTATS
Note méthodologique :
Cette enquête a été réalisée par téléphone auprès d'un échantillon national représentatif de 502 français âgés de 15 ans et plus les 6 et 7 janvier 2006 et de 200 professionnels de santé (50 médecins généralistes libéraux, 75 médecins spécialistes hospitaliers et 75 infirmiers(ères) hospitaliers) du 10 au 13 janvier 2006.
Pour le grand public, un échantillon de 500 individus, pour un intervalle de confiance à 95%, induit une marge d'erreur variant de 1,91 à 4,38 selon le pourcentage observé.
Pour les professionnels de santé, une taille d'échantillon de 200 individus pour un intervalle de confiance à 95%, induit une marge d'erreur variant de 3,02 à 6,93 selon le pourcentage observé.
Chacun de ces échantillons sont parfaitement représentatifs de l'univers étudié (la population française d'une part, les professionnels de santé d'autre part) selon la méthode des quotas.
Les résultats détaillés sont donnés en annexe 11.
Les inquiétudes face à une hospitalisation
Les risques d'infections constituent l'élément qui inquiète le plus les français dans le cadre d'une hospitalisation (73%). Viennent ensuite les erreurs médicales (67%) et la découverte d'une autre maladie à l'occasion de cette hospitalisation (62%). L'isolement (49%) et l'anesthésie (48%) et beaucoup plus en retrait les examens médicaux (28%) et les piqûres (14%) constituent des inquiétudes plus secondaires.
Les femmes craignent plus souvent l'anesthésie (56% vs 39% pour les hommes) et les examens médicaux (36% vs 20% pour les hommes). Les publics les plus jeunes (moins de 35 ans) se déclarent plus souvent inquiétés par les erreurs médicales (73% vs 63% pour les 35 ans ou plus).
Lorsqu'on demande aux professionnels de santé ce qui inquiète le plus les patients selon eux, l'anesthésie arrive en tête (75%), devant le risque d'infection (59%), le fait que l'on découvre une autre maladie (57%) et les erreurs médicales (55%). Il existe donc un décalage entre le grand public et les professionnels de santé dans la hiérarchie des inquiétudes des français, avec des professionnels de santé qui surestiment l'inquiétude liée à l'anesthésie.
Connaissance des infections nosocomiales
42% des français associent spontanément le mot `nosocomiales' aux infections que l'on peut contracter à l'hôpital. Ce sont plus souvent :
o les femmes que les hommes (46% vs 38%),
o les publics plus âgés (45% pour les 35 ans et plus vs 35% pour les moins de 35 ans),
o les individus appartenant aux foyers aisés (30% pour un foyer dans la tranche de revenus la plus faible vs 57% dans la tranche la plus élevée),
o et ceux dont le niveau d'études est élevé (16% auprès de ceux qui n'ont pas diplôme vs 68% pour les individus au moins bac +2).
Les personnes interrogées sont au total 83% à avoir déjà entendu parler des infections nosocomiales (plus souvent les 35 ans et plus : 90% vs 71%, les foyers aisés : 94% vs 77%, les individus dont le niveau d'études est élevé : 93% vs 70%).
Les professionnels de santé interrogés sous-estiment largement la connaissance du grand public, puisque selon eux, seulement 48% des français en moyenne ont déjà entendu parlé de ce type d'infection.
Les grands médias (télévision, presse, radio) et le bouche-à-oreille constituent de loin le principal mode de connaissance (respectivement 78% et 67%).
Les risques et le niveau d'information
Pour la majorité des français (58%), les infections nosocomiales représentent un risque important lié à l'hospitalisation. Cette crainte est plus forte chez les femmes (62% vs 55% hommes), dans les foyers à faibles revenus (61% vs 49%) ou auprès des individus dont le niveau d'étude est faible (65% vs 48%). Du côté des professionnels de santé, ils sont 51% à penser que c'est un risque important s'ils devaient eux-mêmes être hospitalisés.
Il existe un déficit net d'information : les ¾ des français se sentent mal informés sur ces infections (23% très mal informés, 50% mal informés).
Ce déficit d'information s'avère plus marqué :
o en province (76% vs 68% en Ile-de-France) ;
o dans les agglomérations rurales (75% vs 65% en agglomération parisienne) ;
o dans les foyers à faibles revenus (84% vs 60% dans les foyers à revenus élevés) ;
o auprès des individus dont le niveau d'étude est faible (89% vs 60% pour un niveau d'étude élevé).
Les professionnels de santé quant à eux minimisent légèrement ce déficit d'information puisqu'ils estiment que 68% des français sont mal informés.
Sur un plan personnel, 88% des professionnels de santé s'estiment bien informés sur les infections nosocomiales.
Le niveau d'information exprimé le plus élevé est celui des infirmières hospitalières (95%), suivi des médecins spécialistes (89%), les médecins généralistes étant un peu plus en retrait (78%).
Les français comme les professionnels de santé ont une relativement bonne estimation de la proportion de patients hospitalisés touchés par les infections nosocomiales (respectivement 11% et 12% en moyenne). A noter que les infirmiers(ères) évaluent une incidence plus forte (16%).
Les facteurs de risques et les conséquences de la prescription d'antibiotiques
Selon les professionnels de santé interrogés :
o c'est lors d'un séjour en réanimation (64%) que le risque d'infection nosocomiale est le plus fréquent. On constate que les réponses données par les infirmiers(ères) hospitaliers sont plus éclatées (48% réanimation, 27% hospitalisation prolongée, 23% intervention chirurgicale) que celles des médecins qui citent davantage la réanimation (respectivement 72% pour les MG et 75% pour les spécialistes hospitaliers) ;
o les germes impliqués le plus fréquemment sont présents avant tout dans les locaux hospitaliers (42%) et dans une moindre mesure chez les autres malades (23%) ou le malade lui-même (19%), mais peu chez le personnel hospitalier (11%).
La quasi-totalité des professionnels de santé interrogés (93%) pensent que la prescription inappropriée d'antibiotiques accroît la difficulté de traiter les infections nosocomiales et 70% qu'elle accroît leur l'incidence.
Image des infections nosocomiales
Pour près des ¾ des français (73%), les patients sont informés lorsqu'une infection nosocomiale est déclarée mais pas dans tous les cas (oui systématiquement : 24%, oui parfois : 49%). Les professionnels de santé sont plus nombreux à le penser (91% au total : 24% : systématiquement, 67% : parfois).
S'agissant de l'évolution de la fréquence des infections nosocomiales, 36% des français pensent qu'il y en a moins en France qu'il y a une dizaine d'années (25% autant, 30% davantage, 9% ne savent pas) et 37% qu'il y en a moins en France que dans les autres pays européens (40% autant, 7% davantage, 16% ne savent pas).
Les professionnels de santé sur ce point, se montrent plutôt en phase avec le grand public sauf pour le comparatif avec les autres pays européens où ils sont plus nombreux à penser qu'il y en a autant (57% vs 40%) et moins nombreux qu'il y en a moins (19% vs 37%).
L'ensemble des français (96%) s'accordent sur le fait que l'hygiène est le principal moyen de diminuer le risque d'infections nosocomiales ; pour 73%, `on peut mourir d'une infection nosocomiale' ; pour 61%, plus on reste longtemps à l'hôpital plus on a de risque d'avoir une infection nosocomiale ; pour 58%, les infections nosocomiales constituent le principal danger lié à la fréquentation des hôpitaux.
En revanche, les français sont partagés (50% d'accord - 48% pas d'accord) sur l'affirmation selon laquelle `ce n'est pas parce qu'on est malade qu'on a plus de risque de contracter une infection nosocomiale'.
Ils ne pensent pas que les infections nosocomiales se soignent facilement ou que les personnes qui rendent visite à leurs proches peuvent aussi avoir une infection nosocomiale.
La loi Kouchner de mars 2002
Un professionnel de santé sur deux (51%) déclare connaître le nouveau mécanisme de réparation des infections nosocomiales introduit par la loi Kouchner du 4 mars 2002 (56% des généralistes, 64% des spécialistes hospitaliers et 33% des infirmiers(ères) hospitaliers).
Leurs attentes dans ce domaine s'avèrent relativement élevées puisque près des ¾ des professionnels de santé interrogés souhaiteraient disposer d'une information sur les taux d'infection par établissement.
Le recours à la justice
Enfin, 61% des français seraient prêts à aller devant un juge pour être dédommagés s'ils étaient eux-mêmes directement concernés par une infection nosocomiale (plus souvent les jeunes, ceux qui craignent les risques d'infections, ceux qui se sentent mal informés, ceux qui pensent que ces infections constituent un risque important).
Du côté des professionnels de santé, 62% déclarent craindre qu'un patient engage leur responsabilité ou celle d'un autre médecin devant le juge pour obtenir réparation des conséquences dommageables d'une infection nosocomiale (46% pour les MG, 65% pour les médecins hospitaliers et 68% pour les infirmier(ères) hospitaliers). Ce sont logiquement les personnels hospitaliers qui redoutent le plus le recours à la justice.
I. SYNTHÈSE DE LA PROBLEMATIQUE
1 - Les infections nosocomiales constituent un problème sérieux de santé publique, mais ne représentent qu'une partie des accidents médicaux, précisément 22% d'après l'enquête ENEIS.
On peut ainsi défendre que la priorité en termes de résorption de non qualité dans le système de soins serait à porter plutôt sur les accidents médicamenteux, en particulier les anticoagulants, et qu'à tout le moins, il conviendrait d'avoir une vue d'ensemble et une gestion d'ensemble des risques médicaux.
2 - Les résultats des études épidémiologiques indiquent que la France se situe dans une position favorable par rapport à ses voisins européens sur de nombreux indicateurs.
D'après les résultats Helics déjà mentionnés dans le chapitre sur l'épidémiologie, la France se situe toutes strates confondues 2 ème sur 8 pour les cholécystectomies, 4 ème sur 14 pour les prothèses de hanche, 5 ème sur 8 pour les césariennes, 6 ème sur 9 pour les colectomies, 3 ème sur 4 pour les laminectomies, et 6 ème sur 7 pour les pontages coronaires.
Pour les interventions "propres", en strate 0 du NNIS, les résultats sont les suivants : 1/8 pour les interventions sur la vésicule (0.39), 4/9 pour les colectomies (5.90), 5/8 pour les césariennes (2.74), 8/14 pour les prothèses de hanche (1.88), 6/6 pour les laminectomies.
Ainsi, les résultats sont contrastés et des efforts particuliers sont à faire dans trois spécialités : la césarienne, où certains pays sont en dessous de 1%, la chirurgie cardiaque, les laminectomies. Les résultats sont très bons en chirurgie abdominale et digestive, et corrects en orthopédie.
A noter que dans les pays les plus en pointe dans la lutte contre les BMR, notamment la Hollande, les résultats en taux d'IN pour la plupart des interventions (en orthopédie par exemple) sont moins bons que les chiffres français. L'accent n'est pas mis apparemment sur le même type de mesures préventives.
Ainsi, tout en rappelant les bonnes positions acquises, des progrès sont encore possibles.
3 - Le thème des IN constitue en outre un « moteur » intéressant dans les programmes d'amélioration continue de la qualité,
au même titre que des thèmes comme l'accueil du malade ou la prévention des escarres (même si le lien entre qualité des soins et incidence des IN n'est pas forcément direct en raison des problèmes d'imputabilité).
Il s'agit d'actions qui engagent l'ensemble des services d'un établissement, de façon concertée, avec la rédaction et la diffusion de protocoles, la mise en place de programmes de formation, etc. Quand un établissement présente des indicateurs favorables sur la prévention des IN, il est probable que la qualité de soins dans son ensemble soit satisfaisante. En d'autres termes, les IN ne constituent pas le seul ni peut-être même le principal thème à étudier en matière de qualité des soins, mais elles représentent un des meilleurs « marqueurs » pour apprécier le niveau de qualité d'un établissement (à pondérer en fonction du case-mix et des facteurs de risque présents dans la population recrutée).
4 - De multiples actions sont d'ores et déjà engagées, en matière de veille, de diffusion de recommandations, de mise en place d'équipe d'hygiène dans les établissements...
Revenons sur les principaux acquis.
o Les recommandations existent au niveau national, rédigées par des sociétés savantes comme les référentiels rédigés par la Société Française d'Anesthésie et Réanimation sur les conduites à tenir en pré-opératoire, la conférence de consensus organisée par la Société Française d'Hygiène Hospitalière (Gestion pré-opératoire du risque infectieux, conférence 5 mars 2004), les recommandations du CTIN sur la désinfection en anesthésie-réanimation (ministère de la Santé, juin 2002), etc. Au niveau européen de même, des recommandations existent ou, pour certaines, sont en cours de préparation.
o Le dispositif de surveillance et d'alerte devient de plus en plus efficace (Institut de Veille Sanitaire, RAISIN, CCLIN) ; les données recueillies sont de bonne qualité et permettent à la France de participer activement au projet de surveillance des IN en Europe.
o Les équipes opérationnelles d'hygiène se mettent en place dans l'ensemble des établissements. Le dernier bilan effectué par la DHOS début 2006 indiquait que 69% des établissements disposaient d'une telle équipe, dont 46% en outre respectaient les normes édictées (1 médecin ou pharmacien hygiéniste pour 800 lits, 1 IDE pour 400 lits).
o Le grand public connaît les infections nosocomiales, en estime à peu près justement le taux, même si les ¾ se considèrent encore insuffisamment informés.
o Le dispositif juridique est très protecteur, depuis 2002, pour les victimes des IN en secteur hospitalier, la solidarité nationale étant activée pour tous les accidents majeurs (décès ou IPP>24%).
o Et surtout, Le ministère de la Santé a engagé un Programme National de lutte contre les IN 2005-2008, qui développe de nombreuses mesures, avec cinq axes majeurs que nous pouvons rappeler :
adapter les structures et faire évoluer le dispositif de lutte contre les IN
améliorer l'organisation des soins et les pratiques des professionnels, en prévoyant notamment un renforcement de la formation initiale et continue dans le domaine de l'hygiène
optimiser le recueil et l'utilisation des données de surveillance et de signalement des infections nosocomiales
mieux informer les patients et communiquer sur le risque infectieux lié aux soins
promouvoir la recherche sur les mécanismes, l'impact, la prévention et la perception des IN.
o De même, le plan national pour préserver l'efficacité des antibiotiques a énoncé des mesures importantes en cours d'application (plan 2001-2005).
5 - Pour poursuivre les progrès engagés, les voies de changement passent maintenant avant tout par des changements de comportement,
ce qui est évidemment l'objectif le plus difficile à atteindre. Ces changements de comportements attendus concernent tous les acteurs.
Les professionnels de santé en premier lieu, qui doivent adopter des comportements d'hygiène en phase avec les recommandations diffusées. Le thème du lavage (ou plutôt désinfection) des mains est lancinant, devenue si banal qu'on en avait sans doute un peu oublié l'importance. Ce n'est pas la seule mesure à faire adopter de manière généralisée, pour tous les professionnels et tous les actes, mais elle est exemplaire des changements à poursuivre. L'autre thème majeur est l'hygiène au bloc opératoire.
L'orthopédie est la spécialité la plus délicate sur ce plan, car la mise en place d'un corps étranger induit localement une situation d'immunodépression qui se traduit par une forte réduction de la dose infectante de bactéries. Les bactéries responsables des ISO proviennent soit de l'air de la salle d'opération, soit plus fréquemment de la peau du patient, avec fréquence importante du portage nasal. Les règles d'hygiène sont donc impératives, sachant que tous les efforts sont faits pour adapter la structure et l'organisation du bloc à ces contraintes : surfaces adaptées, traitement de l'air, circuits multiples, procédures qualité, antibioprophylaxie... Une architecture adaptée, les flux laminaires en chirurgie osseuse aseptique (prothèse) sont indispensables.
Reste à adapter les comportements à la rigueur requise, car il restera toujours inutile d'avoir des locaux superbes si les comportements ne sont pas contrôlés ! Les mesures de prévention sont connues : discipline de fermeture des portes, limitation du nombre et des mouvements de personnes dans les salles d'intervention, garantie d'un temps de repos de la salle entre chaque intervention, port de tenue correcte...
Une étude spécifique a été réalisée au CTO de Strasbourg sur ce thème des comportements (Muriel Ledoux, Jeannot Gaudias), sur la base de la rédaction d'un protocole des comportements et d'une formation de l'ensemble des personnels. L'évaluation du personnel (à son insu) a été menée avant la mise en place du protocole, lors de la mise en place de celui-ci et six semaines après ; les résultats sont édifiants 21 ( * ) .
« Les résultats furent pour le moins troublants...
§ Au vestiaire, à peine la moitié des personnes se lavaient les mains après avoir quitté la tenue civile et avant de prendre le pyjama de bloc opératoire, les hommes se lavant plus souvent les mains que les femmes !
§ Les portes automatiques verrouillant l'accès aux salles d'urgence ou au bloc réglé, sensées marquer le passage d'une `douane' nécessitant le lavage des mains et un mécanisme d'autocontrôle sur l'adéquation de sa tenue et de son comportement étaient bloquées en position ouverte dans environ 40% des cas sur la période de mesure.
§ Les mains des soignants portaient des bijoux ou une montre dans 57% des cas.
§ Le masque n'était pas porté dans 15% des cas en salle d'induction anesthésique juste à côté de la salle d'opération.
Les constatations faites déclenchèrent la rédaction d'un règlement de comportement au bloc opératoire et sa diffusion individualisée par courrier assortie d'une lettre du CLIN dont l'objectif était la sensibilisation et l'incitation à une amélioration des pratiques individuelles. Un deuxième audit réalisé quelques semaines après cet effort de sensibilisation montra une amélioration relativement modeste mais néanmoins évidente des comportements des personnes travaillant au bloc opératoire. A quelques mois de distance de ces efforts de formation et de sensibilisation, un troisième audit voulut vérifier la pérennisation des progrès observés et conclut à un retour à la situation initiale. »
L'intérêt et l'usage du lavage antiseptique (une minute) ne semblent pas compris. Le seul geste correctement effectué est le lavage chirurgical des mains.
Les difficultés proviennent semble-t-il de la sous-estimation du risque infectieux, de la difficulté de faire le lien entre des comportements non conformes sur des détails et l'accroissement du risque, de la pérennisation des comportements adéquats si notamment les chirurgiens et les anesthésistes ne « donnent pas l'exemple ».
MC Pouchelle, sociologue, note ironiquement après une analyse de type ethnologique dans des blocs opératoires 22 ( * ) : « Médecins et chirurgiens se comportent donc parfois comme si, naturellement propres en raison de leur fonction, ils ne sauraient être eux-mêmes des vecteurs d'infection. » La formation et l'audit ne suffisent pas à opérer cette transformation, il faut trouver d'autres leviers, axés sur les comportements. Un règlement plus contraignant, dont l'application serait confiée à un chef de bloc, aura toujours du mal à être mis en oeuvre, interagissant trop directement avec l'organisation des pouvoirs au sein d'un bloc. Des mesures incitatives seraient à rechercher.
L'exemple de la sécurité en aéronautique est souvent cité en exemple et pourrait en effet inspirer certaines mesures. Le principe de base est qu'il n'y a pas de détail, et que toute la chaîne d'événements est importante.
Il faut aussi que tous, patients, professionnels, pouvoirs publics, changent une certaine vision des choses qui peut se résumer dans le discours simpliste : « surveillons de près toutes les IN, et sanctionnons les établissements les plus fautifs ». Nous avons vu déjà que de nombreuses IN ne sont pas évitables et ne sont pas liées à des erreurs médicales, et surtout, dans un esprit d'amélioration continue de la qualité, il s'agit de délivrer un message positif, de trouver des méthodes pour promouvoir les établissements les mieux positionnés sur les indicateurs de prévention des IN, d'engager des procédures d'audit interne, etc. afin de placer les établissements dans une dynamique positive. En outre, si des sanctions, quelle qu'en soit la nature, étaient mises en place à l'encontre des établissements moins bien positionnés, il est probable que le recueil d'informations servant à alimenter le diagnostic serait rapidement perverti. En d'autres termes, il vaut mieux mettre l'accent sur la qualité que sur la non qualité !
Il faut enfin que la loi soit appliquée en matière d'information des patients atteints d'une IN. Certes, de nombreuses IN ne sont pas évitables et ne constituent qu'un des risques à courir lorsqu'on engage telle ou telle procédure thérapeutique, mais si une IN se déclare, il faut que le patient en soit informé, connaisse les conséquences possibles, comprenne ce qui est arrivé, etc. Cette information est souvent déficiente, et là aussi entrent en jeu des problèmes de comportement, de difficultés pour le corps médical à partager l'information avec le patient, alors même que le patient est le premier concerné !
La mise en place récente d'un site internet et d'une ligne téléphonique d'information spécifique sur les IN à l'HAS (Mission nationale d'information et de développement de la médiation sur les infections nosocomiales, présidée par A.M. Ceretti) va dans le sens de la diffusion de l'information sur les IN en général.
J. RECOMMANDATIONS
Cette réflexion sur les IN dans les établissements de santé français se situe dans un contexte d'amélioration continue des procédures et des résultats dans le domaine des IN. De nombreuses recherches sur les IN sont réalisées, de nombreuses recommandations sont produites et appliquées, des tableaux de bord par établissement sont publiés, des plans nationaux d'envergure sont engagés, les résultats sont dans une tendance d'amélioration et la France est plutôt bien située par rapport à ses voisins européens.
Dès lors, que proposer pour améliorer encore les choses dans ce domaine ?
Nous proposons 10 axes de recommandations ; ceux-ci ne constituent pas des nouveautés en la matière, mais plutôt des priorités, des accents particuliers mis sur ces actions qui apparaissent indispensables.
De fait, tous les éléments contenus dans les plans nationaux sont importants, certains sont déjà bien avancés dans leur réalisation, mais il n'est sans doute pas inutile d'insister sur quelques points particulièrement importants.
Il en est un sur lequel nous ne faisons pas de recommandation ici, car ce thème sort de notre champ d'étude, mais il est incontestable que les modifications du comportement des personnels de santé passent par l'éducation de ces personnes au cours de leurs études ; le volet `formation initiale' du programme national est fondamental.
Renforcer les politiques de bon usage des antibiotiques
Les politiques sur le bon usage des antibiotiques sont essentielles, certes pour contrecarrer l'évolution néfaste des IN à bactéries multirésistantes mais aussi et avant tout pour préserver l'efficacité des antibiotiques dans la durée.
Lors des entretiens menés dans le cadre de cette étude, le thème de la résistance aux antibiotiques a constitué le premier point d'amélioration souhaité.
Devant l'ampleur du taux de résistance des bactéries aux antibiotiques, la communauté européenne a rédigé des recommandations sur la base des rapports des états membres concernant l'application de la recommandation (2002/77/CE) du conseil relative à l'utilisation prudente des agents antimicrobiens en médecine humaine (publication décembre 2005). Cette dernière publication souligne entre autres les effets néfastes de l'auto-médication (certains antibiotiques dans certains pays sont en vente sans ordonnance) ou des prescriptions abusives d'antibiotiques, et recommande des contrôles appropriés ou du moins la mise en oeuvre de meilleures pratiques (avec campagne auprès du grand public...).
Outre ces grandes lignes couplant recommandations auprès du grand public et auprès des personnels de santé, des recherches sont réalisées sur la manière dont les antibiotiques sont utilisés dans les établissements de santé. Deux points peuvent être mentionnés :
o les antibiotiques ne devraient pas être donnés systématiquement dans les établissements dès qu'une fièvre est notée, mais seulement après avoir acquis la conviction forte de la présence d'une infection bactérienne justifiant un traitement ;
o une approche qui semble prometteuse est celle qui consiste à utiliser des antibiotiques en rotation, ou encore mieux en rotation très rapide, au jour le jour pour éviter la monotonie antibiotique (mixing).
De nombreuses mesures ont déjà été mises en application en France, notamment les campagnes de communication auprès du grand public de l'assurance-maladie ( « Les antibiotiques, c'est pas automatique » , avec un fort score de mémorisation) et l'inscription dans la convention entre l'assurance-maladie et les médecins de ville d'objectifs en matière de baisse de prescription d'antibiotiques.
Ces actions ont porté leurs fruits puisque le nombre de prescription des antibiotiques en ville a chuté de 13% en 3 ans entre l'hiver 2001-2002 et l'hiver 2003-2004 (en baisse cumulée, à épidémies constantes, données CNAMTS/INSERM/Institut Pasteur), avec même -26% chez les 6-15 ans, et à l'hôpital, le taux de SARM a baissé (28% en 2004 contre 33% en 2002, EARSS). Mais ces résultats doivent être consolidés. L'objectif de baisse en médecine de ville est de -25% en 2007 pour se rapprocher de la moyenne européenne.
Le bilan effectué par la CNAMTS avec l'IPSOS en octobre 2005 indique une évolution lente mais réelle des mentalités : seulement 39% des Français pensent que les antibiotiques permettent de guérir plus vite contre 64% en 2002. Ils ne sont plus que 25% à croire que les antibiotiques font baisser la fièvre contre 39% en 2002. 41% indiquent que les antibiotiques ne sont pas efficaces contre la grippe contre 26% en 2002. Mais des progrès restent à faire : quand on demande si les antibiotiques sont actifs sur les bactéries ou les virus, 36% seulement indiquent qu'ils ne sont actifs que contre les bactéries (contre 30% en 2002), 9% pensent qu'ils ne sont actifs que contre les virus (contre 14% en 2002), 14% pensent qu'ils sont actifs contre les deux (contre 23% en 2002), et 41% ne se prononcent pas !
Une enquête sur le même mode réalisée en janvier 2006 indiquait que 93% des patients comprenaient la décision médicale lorsque la première consultation ne se concluait pas par la prescription d'antibiotiques.
Dans le domaine hospitalier, un accord-cadre relatif au bon usage des antibiotiques dans les établissements de santé a été signé en janvier 2006 entre le Ministère de la Santé, l'assurance-maladie et les fédérations représentatives du monde hospitalier. Le postulat est qu'une amélioration des pratiques en matière de prescription d'antibiotiques devrait se traduire par une réduction de l'utilisation inappropriée des antibiotiques, et donc une réduction de leur utilisation. A ce titre, ce contrat-cadre prévoit une baisse de 10% des consommations sur 3 ans. Les actions envisagées passent par des actions de formation et d'information, la diffusion des référentiels, la mise en place des protocoles de bon usage des antibiotiques, le suivi des consommations. Cet accord prévoit un dispositif d'intéressement des établissements à la réalisation de l'objectif : reversement à l'établissement de 50% des dépenses évitées mesurables. Cet accord-cadre national doit être décliné au plan local.
Peut-on aller plus loin et contraindre davantage les personnels de santé afin de non seulement conserver les améliorations effectuées mais les renforcer ? Les mesures possibles seraient :
o En médecine de ville : la formation au bon usage des antibiotiques doit devenir une priorité (parmi d'autres) dans le cadre de la formation médicale continue (rappelons que les médecins en ville prescrivent des antibiotiques, notamment dans les infections respiratoires, sans diagnostic bactériologique comme les céphalosporines orales de 1ère génération en générique, ce qui devient un vrai problème médical car elles sont devenues inefficaces) ; la formation initiale devrait d'ailleurs aussi être renforcée dans ce domaine ;
o A l'hôpital : la politique à poursuivre en matière de bon usage des antibiotiques reviendrait à créer une organisation dans les établissements de santé similaire à celle qui existe pour l'hygiène ; donc il faudrait donner un support réglementaire à la commission antibiotique qui se met en place dans chaque établissement, et créer une équipe opérationnelle (médecin référent, un bactériologiste, un pharmacien, chacun disposant du temps pour cela). Cette équipe permettrait de remettre la politique des antibiotiques à plat (contrôle de la prescription, listes à prescription restreinte, évaluation du bon usage, protocoles périodiquement révisés...). Notons que pour le traitement curatif par antibiotique, il n'existe pas de protocole institutionnel dans la majorité des établissements en France ; la même remarque que pour les médecins de ville est à faire pour la formation continue ;
o Le suivi de l'usage des antibiotiques (Assurance-Maladie/Institut Pasteur) doit se poursuivre, ce qui devrait être le cas dans le cadre de l'accord-cadre cité ci-dessus.
Renforcer l'application des recommandations en matière d'hygiène dans les établissements de santé et les mesures de prévention
En premier, vient à l'esprit le respect absolu des règles d'hygiène , au bloc opératoire, en USI comme dans les autres services cliniques : se désinfecter les mains, éviter de porter des bagues, etc. En matière d'hygiène des mains, notamment importante pour lutter contre les bactéries multi-résistantes, l'indicateur mis en place sur la consommation des produits hydro-alcooliques va permettre de clarifier la situation et d'identifier les marges de progression.
Par ailleurs, tout moyen évitant de passer par l'observance humaine serait le bienvenu : par exemple sonde urinaire en système clos et scellé, limitation de la durée de sondage, etc. D'une manière générale, les bonnes pratiques d'utilisation des dispositifs invasifs à demeure (sondes, cathéters) doivent être établies et diffusées.
Les deux lieux privilégiés de déclenchement des IN ont fait l'objet de nombreux travaux dans le domaine de la prévention :
o Les unités de soins intensifs
Face aux facteurs de risque comme la présence de dispositifs invasifs tels que cathéters, intubation endotrachéale, la ventilation artificielle (sa durée), les micro-aspirations des sécrétions oropharyngées, différentes recommandations ont été émises, comme :
mise en position demi-assise chaque fois que possible
décontamination sélective locale dans l'oropharynx et par un tube dans l'estomac (cette décontamination n'est pas effectuée en routine à cause de son coût et du risque d'augmenter les résistances aux antibiotiques) ;
quand cela est possible, éviter la pose d'un cathéter urinaire, ou, au moins, diminuer la durée de cette pose ; la pose de cathéter traité par antibiotique n'a pas encore été étudiée chez l'homme quant à son effet sur la diminution de l'incidence des IN urinaires ;
pour la pose des cathéters centraux veineux, la bonne pratique et la formation sont connues pour diminuer le taux d'IN : il faut souligner l'importance de l'application des règles d'hygiène, la surveillance régulière du site du cathéter, leur maintenance. Des cathéters imprégnés d'antiseptiques sont également utilisés mais ces cathéters exposent au risque de développement des résistances aux anti-infectieux.
o Lors des interventions chirurgicales
Selon le rapport HELICS, la surveillance des ISO sera d'autant plus pertinente qu'elle utilisera des protocoles communs entre pays ; dans ces protocoles de surveillance des ISO, seront inclus, entre autres, l'information de sortie des patients, la détermination des niveaux de risque des patients, et l'information sur les micro-organismes impliqués.
La conférence sur la prévention des risques infectieux a proposé certaines recommandations (conférence 5 mars 2004). Par exemple, il n'est pas recommandé de faire un dépistage systématique à la recherche du portage de Staphylococcus aureus sensible à la méticilline, quel que soit le type de chirurgie ; par contre le dépistage nasal du SARM est recommandé chez les patients devant bénéficier d'une chirurgie cardiaque ou orthopédique programmée, et venant de réanimation, de structure de long et moyen séjour ou en cas de lésions cutanées chroniques.
La prophylaxie antibiotique en pré-opératoire fait par ailleurs l'objet de nombreuses publications (SFAR,...), qui précisent les règles strictes en termes de fenêtre d'administration, de produits et de dosages recommandés, et dont le respect est associé à une réduction très sensible du risque infectieux.
Toutes ces recommandations de bonnes pratiques sont connues, diffusées ; elles doivent être appliquées. Il faut à cet égard mettre en oeuvre le tryptique de tout programme de ce type :
o Mesures de prévention, application des recommandations, formation, mise en place des structures de lutte contre les IN
o Audits de pratiques (hygiène des mains, consommations d'antibiotiques, antibioprophylaxie en chirurgie...), revues de morbi-mortalité
o Surveillance des taux
Le deuxième aspect devrait être davantage développé dans les établissements français pour compléter les dispositifs en place. C'est à travers ces audits, ces revues de morbi-mortalité que les pratiques peuvent évoluer. La démarche entreprise par exemple au CHU de Besançon sur les cas de mortalité attribuable aux IN ou au CTO de Strasbourg sur les comportements au bloc opératoire illustrent cela (voir chapitres 3.5 et 9). Ces démarches doivent être encouragées, à travers par exemple l'EPP (évaluation des pratiques professionnelles) , en cours de diffusion en milieu hospitalier.
Vers un statut d'infirmière hygiéniste ?
L'équipe d'hygiène par établissement de santé doit être encore mieux structurée et doit être reconnue.
Une mesure serait de faire reconnaître le statut d'infirmière hygiéniste . Actuellement, l'infirmière hygiéniste n'a pas de statut particulier, et donc pas de grille salariale particulière alors qu'elle a bénéficié de formations complémentaires (sur le modèle des IBODE ou des puéricultrices).
Cette proposition se heurte à des obstacles statutaires divers, à la définition de la formation adaptée, etc. mais pourrait permettre de donner une meilleure visibilité dans les établissements à cette activité et une meilleure reconnaissance aux professionnels qui y travaillent.
Vers la reconnaissance plus officielle du rôle et des responsabilités des médecins hygiénistes dans les hôpitaux.
Les médecins hygiénistes sont souvent trop « seuls » dans les hôpitaux, et les organisations, en particulier structurelles et hiérarchiques, trop mal précisées, ainsi que les missions diverses qui leur sont souvent attribuées. De même, la formation des médecins hygiénistes doit être harmonisée.
Par ailleurs, la répartition sur le territoire des professionnels de l'hygiène n'est pas encore parfaite. Le programme national prévoit la mise en place d'une EOH dans 100% des établissements, mais l'objectif n'est pas encore atteint. Des problèmes de recrutement se posent. La filière « hygiène » doit pouvoir être rendue plus attractive, par exemple en constituant un véritable pôle « sécurité des patients » au sein des établissements (cf. proposition 10), et en mutualisant les moyens sur plusieurs établissements pour les établissements de taille modeste.
Mettre en place des unités de référence pour la prise en charge des infections ostéo-articulaires
Il s'agit d'une mesure du programme national de lutte contre les IN 2005 - 2008. Cette proposition, soutenue au départ par les associations d'usagers et en particulier le LIEN, cherche à offrir la possibilité d'une prise en charge adaptée et spécialisée des patients atteints d'infection ostéo-articulaire, en particulier sur matériel prothétique (mais aussi sur matériel d'ostéosynthèse ou après traumatisme : fractures ouvertes). Elle a pour but d'éviter les complications tardives graves liées à une prise en charge inadaptée de ces infections nécessitant une expertise très spécialisée infectiologique et chirurgicale, et permettre incidemment d'apaiser la relation avec l'équipe médicale initiale.
Ces centres de référence seront constitués d'équipes multidisciplinaires : une équipe chirurgicale orthopédique expérimentée, avec possibilité de bénéficier de compétences en chirurgie plastique, une équipe de microbiologistes, une équipe infectiologique, une équipe d'anesthésistes, un service d'imagerie, un service d'hygiène, un service de rhumatologie, un service de rééducation, une organisation permettant une prise en charge psychologique et sociale. La qualité de la prise en charge qui en résultera comprendra un accès rapide au diagnostic et aux soins les plus appropriés, un diagnostic bactériologique, une stratégie de traitement définie sur la base d'un avis pluri-disciplinaire (réunions de concertations pluridisciplinaires, sur le modèle de la cancérologie) et des référentiels validés et régulièrement actualisés, une prise en charge globale et continue jusqu'au domicile (par exemple hospitalisation à domicile pour poursuivre l'antibiothérapie...). Si un centre ne dispose pas de l'ensemble des compétences, une organisation et un fonctionnement en réseau peuvent être mis en place.
Ce type de proposition est à mettre en oeuvre sans tarder. Les sociétés savantes ont rédigé de façon consensuelle le cahier des charges précisant les missions et modalités de fonctionnement de telles structures. Il revient aux instances de planification de procéder à une sorte d'appel à projets pour recueillir les candidatures des établissements souhaitant constituer un tel pôle de référence.
Le financement de tels centres de référence trouverait sa place naturelle dans l'enveloppe MIGAC (Missions d'intérêt général et d'aide à la contractualisation), les surcoûts du service de la Croix Saint-Simon étant par exemple déjà financés ainsi.
Combien de tels pôles seraient nécessaires en France ?
Heureusement, les infections du site opératoire en orthopédie sont rares, et il n'est pas utile de multiplier ces structures qui auraient par construction un recrutement régional. Si on prend le chiffre de 188 000 interventions orthopédiques avec pose de prothèse ou particulièrement lourdes par an 23 ( * ) (ce qui ne résume pas le risque d'infection en orthopédie, mais le rend particulièrement grave) et que l'on admet que 0,5% de ces interventions donnent lieu à infection profonde ou intermédiaire, on aurait 940 séjours sur le territoire à prendre en charge, soit, pour des durées moyennes de séjour de l'ordre de 30 jours au vu de la lourdeur de ces cas, une occupation de 91 lits. Sur la base d'unités de 15 lits, il faudrait mettre en place de l'ordre de 6 unités au minimum. Comme la pose de prothèses n'est pas la seule source d'infection du site opératoire, et qu'il faut aussi prendre en charge les infections ostéo-articulaires non nosocomiales (ostéomyélites...), mais qu'à l'inverse certains patients ne seront pas orientés vers ces structures pour des raisons diverses, le chiffre de 7 à 8 unités paraît réaliste. Des évaluations plus précises devraient bien sûr être menées mais tel est l'ordre de grandeur.
Constituer un registre des patients porteurs de prothèses orthopédiques
Ce projet de registre concernant les prothèses orthopédiques est ancien, et ne se justifie d'ailleurs pas seulement par le suivi souhaitable des patients susceptibles (pour une faible proportion d'entre eux) de développer une infection acquise lors de l'intervention. Mais ce registre, qui consisterait à avoir un suivi précis des patients porteurs de prothèses, permettrait d'évaluer dans le temps l'ensemble des complications liées à la prothèse. La SOFCOT avait proposé de promouvoir un tel projet afin d'optimiser la traçabilité des implants. Ce projet pourrait faire l'objet d'une expérimentation dans 2 ou 3 régions pour démarrer, à titre de test de faisabilité.
Seul un tel observatoire permettrait de mieux connaître quantitativement et qualitativement les conséquences des IN en termes de handicap.
Ce projet devrait aussi s'étendre aux autres types de prothèses : valves cardiaques, pacemakers, etc.
Promouvoir la recherche en matière d'infections nosocomiales
Plusieurs thèmes nécessitent des recherches plus importantes :
a) La physiopathologie des infections du site opératoire, et leur prévention.
Paradoxalement, l'état des connaissances est encore insuffisant, et ce paradoxe en fait un thème urgent, puisque le grand public pense qu'il s'agit d'un sujet bien connu.
En particulier :
o par où les bactéries parviennent-elles dans la plaie opératoire ? (en per opératoire : par l'air, les mains, les instruments, ou en post opératoire : par voie sanguine, par voie lymphatique, ou via des lymphatiques colonisés sectionnés en per opératoire...) ; et quand sont-elles mises en suspension si l'air est le mécanisme essentiel ? Les facteurs organisationnels sont importants (anesthésie, allées et venues intempestives dans le bloc...), mais on ne connaît pas la fréquence respective des différentes causes ;
o quelle est la relation entre le portage de bactéries en pré opératoire (y compris dans le nez, ou sur la peau chez des sujets parfaitement sains) et l'infection post opératoire ? Les méthodes préventives éventuelles pourraient être une décolonisation du nez avec des pommades antibiotiques ou antiseptiques (à l'étude), ou une antibioprophylaxie intraveineuse, mais différente des patients non porteurs.
b) L'évitabilité des infections nosocomiales.
On sait que des programmes de grande ampleur peuvent réduire les taux (le taux habituellement évoqué de 30% d'évitabilité date de 25 ans !!), mais on ne sait pas déterminer au cas par cas quelle infection était évitable. Il est toujours possible d'identifier des faiblesses dans les protocoles, mais cela ne démontre en rien que cette faiblesse constatée était bien responsable de l'infection chez un patient donné.
Les travaux sur les estimations de morbidité et mortalité attribuables doivent se poursuivre pour déterminer sur quels facteurs il convient d'agir en priorité et quelles mesures de prévention seraient à renforcer : procédures d'isolement, dépistage des BMR, programmes d'amélioration de l'hygiène des mains, port de masques, nouvelles stratégies prophylactiques, préparation de l'opéré... Il s'agit d'augmenter le niveau de preuve de l'efficacité de ces mesures.
c) Comment modifier les comportements des soignants ?
Le soignant est-il différent du citoyen ? Pourquoi le serait-il ? Faut-il en fait commencer à l'école, et augmenter le niveau moyen de connaissances et de motivation de la population en matière d'hygiène et de santé publique, comme dans certains pays ? Ce thème nécessite de travailler avec des sociologues et ethnologues.
d) L'étude de la fréquence, les conditions de survenue, les conséquences des IN, les stratégies de prévention spécifiques dans les secteurs d'hébergement des personnes âgées .
Un regard particulier doit en effet être porté sur les structures de SSR et SLD qui, en étant éloignées parfois des structures de court séjour, sont aussi souvent éloignées des bonnes pratiques en matière d'hygiène. La grippe y pose un problème particulier.
e) Les séquelles des IN
f) Les risques liés à certains actes, qui ont fait à ce jour d'un nombre limité d'études et devraient faire l'objet de recommandations : extractions dentaires, endoscopies, coloscopies, échographies trans-oesophagiennes, etc.
Propositions d'évolution du dispositif juridique
Différentes options ont été évoquées dans le chapitre juridique, au regard des différents problèmes posés par le régime en vigueur et les inégalités de traitement selon les situations. Rappelons-en les conclusions.
Le dispositif actuel est complexe et source d'inégalités, mais il est certainement prématuré, peu de temps après la mise en oeuvre des dispositions liées à la loi du 4 mars 2002, de prétendre déjà à une modification de textes.
Mais des travaux doivent se poursuivre dans les domaines suivants :
o Information des patients et de leurs familles
o Approfondissement des connaissances sur les risques nosocomiaux dans l'activité de ville
o Clarification de la rétroactivité ou de l'absence de rétroactivité de la loi du 30 décembre 2002
o Incitation pour les organismes assurantiels à accentuer et renforcer la liaison primes-politique de prévention des risques d'infections nosocomiales
La diffusion publique des tableaux de bord par établissement
Cette diffusion, rassemblant quelques indicateurs relatifs aux IN, est une procédure engagée, nous l'avons vu.
Elle présente des avantages, si par ce biais, les établissements se voient incités à s'améliorer et à résorber leurs dysfonctionnements internes ; elle peut receler des inconvénients si les établissements, face à ce risque porté à leur réputation, manipulent les données transmises utilisées pour établir ces tableaux de bord.
De fait, cette diffusion publique de données de résultats de soins, et de taux d'IN en particulier, doit être engagée avec les plus extrêmes précautions. L'objectif d'information du public n'est pas toujours valablement poursuivi par ces procédures, mais à l'inverse, la qualité des données et le cercle vertueux recherché en faveur de l'amélioration de la qualité des soins risquent de se dégrader.
Au demeurant, la demande du public ne réside pas tant dans la publication de tels tableaux de bord, assez complexes à déchiffrer, que dans l'information délivrée au cours de l'hospitalisation dans le cas où une IN survient, comme nous venons de le souligner. L'enquête IPSOS a montré que le public était déjà mieux informé que ne le pensent les professionnels.
Par contre, il existe un intérêt évident à établir de tels tableaux de bord comparatifs et les diffuser aux établissements pour les inciter à s'améliorer ; ces tableaux de bord opérationnels seraient éventuellement plus précis et plus complets que les données destinées au grand public. Une diffusion large s'accommode mal de la complexité du sujet.
Il pourrait être ainsi conçu deux modèles de tableau de bord : un pour le grand public, donnant une information robuste et claire, un pour les établissements, plus détaillé, plus complet, plus opérationnel.
Ainsi, plus que des tableaux de bord nationaux, dont nous avons vu les limites, il s'agit de promouvoir (ce qui est prévu dans le programme) les tableaux de bord de suivi des IN au sein des établissements , indépendamment (et peut-être même à la place s'il y a conflit) des outils de comparaison nationaux. Il est en outre plus instructif, sur certains indicateurs où les comparaisons inter-établissements sont difficiles, d'étudier l'évolution dans le temps des taux au sein d'un établissement.
A noter que la HAS elle-même lance une réflexion sur cette question de la publication d'indicateurs de qualité. Etienne Caniard, prenant acte du bilan mitigé des expériences étrangères, indique : « Il nous paraît essentiel de ne pas se tromper, de ne pas nous lancer dans une série de publications qui répondraient davantage à la disponibilité actuelle de tel ou tel type d'indicateurs plutôt qu'à une stratégie d'amélioration de la qualité » .
Compte tenu des expériences américaines et dans cet esprit de délivrer des indicateurs utiles pour les établissements, pourraient être ajoutés au tableau de bord actuel :
o Indicateurs de procédures :
Antibioprophylaxie avant chirurgie
Vaccination antigrippale du personnel (notamment dans les structures de SSR et les EHPAD)
o Indicateurs de résultats :
Bactériémie primaire confirmée biologiquement associée à une voie centrale (stratification par type d'unité)
Par contre, deux indicateurs prévus dans l'actuel tableau de bord ne paraissent pas adaptés en l'état à une diffusion grand public, dans une optique de comparaison inter-établissements : le taux d'infection du site opératoire par acte, en raison des faibles nombres de cas et de l'absence de redressement selon la sévérité ; et la consommation d'antibiotiques, en raison de sa moindre pertinence comme indicateur de qualité ; cet indicateur devrait évoluer vers un indicateur composite de bon usage.
Proposition de mise en place d'une structure hospitalière transversale dédiée à la sécurité des patients et la gestion de tous les risques
L'infection nosocomiale a été mise sous les feux de l'actualité depuis une dizaine d'années. La France dispose actuellement d'un système de prévention et de surveillance de l'IN très performant. On sait, depuis certaines études récentes (enquête de prévalence sur les événements indésirables (ENEIS de la DREES) que les infections nosocomiales ne représentent que 20% environ de ces événements indésirables ; une assez grosse partie de ces derniers recouvre des accidents liés aux médicaments ou aux actes diagnostiques et thérapeutiques. Les accidents dus aux anticoagulants sont en particulier très fréquents, et souvent sévères.
Les structures hospitalières actuelles sont mal organisées pour prendre en charge ces événements indésirables non infectieux et les programmes qualité donnent rarement une vision réellement transversale de la problématique.
La déclaration des événements indésirables, mise en place dans certains hôpitaux, sous-estime considérablement les accidents médicaux. Ceci est en partie lié à une réticence des médecins à déclarer les accidents médicaux, et à un « saucissonnage » des structures de vigilance avec un émiettement des horaires des professionnels impliqués (vigilants, gestionnaires de risque, qualiticiens...).
De plus, la lisibilité de certaines structures, telle les unités de gestion des risques, est faible, car les usagers, voire les professionnels, comprennent mal ce terme, et parce que les ressources accordées à ces spécialistes sont insuffisantes.
Par ailleurs, les stratégies de lutte contre l'infection nosocomiale nécessitent impérativement des connaissances cliniques et microbiologiques, et imposent un fort ancrage sur le terrain.
Il existe donc un vrai challenge pour mettre en place les structures permettant d'atteindre ces différents objectifs, en partie contradictoires.
Il pourrait être proposé de créer dans les hôpitaux une structure responsable de la sécurité des patients. Cette structure ferait partie des « pôles », « départements », ou « directions » « qualité » en place (l'organisation est variable suivant les hôpitaux), et regrouperait les unités opérationnelles d'hygiène et les différentes vigilances, et bien entendu les responsables de la gestion des risques.
Les informations sur les événements indésirables devront être centralisées par cette unité, en particulier à partir de systèmes de déclarations volontaires, à développer, mais aussi à partir d'autres sources d'informations (EOH, revues de mortalité/morbidité, plaintes et lettres de patients...).
Un bilan annuel des événements indésirables serait réalisé, avec définition précise des cas à prendre en compte, en fonction de leur criticité (des recommandations nationales seraient souhaitables). Cette unité serait également responsable du signalement de certains événements aux organismes extérieurs (InVS, DDASS...), sur le mode des déclarations d'infections nosocomiales.
Ce bilan serait présenté aux structures hospitalières (conseil d'administration, CME, CHSCT...).
Il serait utile que ces structures puissent disposer d'un interne de santé publique dans les hôpitaux de taille suffisante.
L'unité opérationnelle d'hygiène doit faire partie par ailleurs, au plan fonctionnel, d'un ensemble regroupant les professionnels impliqués dans la prévention du risque infectieux (bactériologie, service d'infectiologie s'il existe, référent antibiotique, CLIN, Commission des antibiotiques, Médecine du Travail...).
Cette activité peut prendre différentes formes, dont celle d'une fédération dans les grands centres hospitaliers. Cette coopération et cet ancrage clinique sont indispensables au bon fonctionnement des EOH, et à la formation continue de ses membres.
|
Synthèse des recommandations o Renforcer les politiques de bon usage des antibiotiques : inscrire le bon usage des antibiotiques dans les programmes de formation médicale continue des médecins de ville et médecins hospitaliers, et en formation initiale donner un support réglementaire à la commission antibiotique et mettre en place des équipes opérationnelles sur l'antibiothérapie dans les établissements, sur le même mode que les EOH o o Renforcer l'application des recommandations en matière d'hygiène dans les établissements de santé et les mesures de prévention : développer les audits de pratiques, les revues de morbi-mortalité dans les établissements (en lien avec l'EPP) o o Mettre en place un statut d'infirmière hygiéniste o o Revaloriser la fonction et le rôle des médecins hygiénistes o o Mettre en place des unités de référence pour la prise en charge des infections ostéo-articulaires o o Constituer un registre des patients porteurs de prothèses orthopédiques o o Promouvoir la recherche en matière d'infections nosocomiales : physiopathologie des ISO et leur prévention, évitabilité des IN comportement des professionnels de santé IN dans les établissements d'hébergement des personnes âgées (EHPAD) séquelles des IN o o Faire évoluer le dispositif juridique : rendre rétroactive la loi de décembre 2002 inciter les organismes assurantiels à accentuer et renforcer la liaison primes-politique de prévention des risques d'infections nosocomiales o o Faire évoluer la politique de publication d'indicateurs de qualité : distinguer des tableaux de bord « grand public » et des tableaux de bord opérationnels pour les établissements dans le cadre de leur politique interne d'amélioration continue de la qualité travailler sur d'autres indicateurs, comme la vaccination anti-grippale du personnel (notamment dans les EHPAD) o o Mettre en place dans les établissements une structure hospitalière transversale dédiée à la sécurité des patients et la gestion de l'ensemble des risques |
Quelques repères bibliographiques
Adrie C, Chaix Couturier C, de Lassence A, Meshaka P, Thuong M, Garrouste-Orgeas M, Timsit JF. Epidemiology and economic evaluation of severe sepsis in France: age, severity, infection site, and place of acquisition (community, hospital, or intensive care unit) as determinants of workload and cost. Journal of critical care 2005, 20(1): 46-58
Aho LS, et al. Epidemiology of viral nosocomial infections in pediatrics, Pathol Biol. (Paris) 2000, 48(10) : 885-92
Bailly P, Haore, HG, Crenn D, Talon D, Mortalité hospitalière imputable aux infections nosocomiales : mise en place d'un observatoire dans un centre hospitalier universitaire, Méd Mal Inf, 2004
Bootsma MCJ. et al. Controlling methicillin-resistant Staphylococcus aureus : quantifying the effects of interventions and rapid diagnostic testing. Proceed. Nat. Acad. Sciences, 2006, édition avancée en ligne
Branger B, Durand C, Jarno P, Chaperon J, Delattre-Maillot I, Mortalité hospitalière imputable aux infections nosocomiales, Méd Mal Inf. 2002, 32 :98-106
Brücker Gilles, éditorial du Bulletin épidémiologique hebdomadaire, 2006, n°1, 1
Brun-Buisson C, Roudot-Thoraval F, Girou E, Grenier-Sennelier C, Durand-Zaleski I. The costs of septic syndromes in the intensive care unit and influence of hospital acquired sepsis. Intensive care med. 2003, 29(9), 1464-1471
Brun-Buisson et le groupe de travail SRLF/SFAR. Risques et maîtrise des infections nosocomiales en réanimation : texte d'orientation SRLF/SFAR. Hygiènes, 2006, vol XIV, n°2, pp. 91-99
CCECQA, ANAES. Les coûts de la qualité et de la non-qualité des soins dans les établissements de santé : états des lieux et propositions. ANAES, Juillet 2004
Céline, Semmelweis, thèse de médecine, suivi de « Les derniers jours de Semmelweis », 1924, L'imaginaire/Gallimard
Chaix C, Durand-Zaleski I, Alberti C, Brun Buisson C. Cost of Endemic Methicillin-Resistant Staphylococcus Aureus : A Cost Benefit Analysis in an Intensive Care Unit. JAMA 1999, 282(18), 1745-1751
Classen et al., N Eng J Med 1992, vol 326, 281-286
Coello R, Charlett A, Wilson J, Ward V, Pearson A, Borriello P. Adverse impact of surgical site infections in english hospitals, Journal of Hospital Infection, 2005, 60, 93-103
Dietrich ES, Demmler M, Schulgen G, Fekec K, Mast O, Pelz K, Daschner FD. Nosocomial pneumonia: a cost of illness analysis. Infection 2002, 30(2), 61-67
DiGiovine B, Chenoweth C, Watts C, Higgins M. The attributable mortality and costs of primary nosocomial bloodstream infections in the intensive care unit. American Journal Respir Crit Care Med 1999, 160, 976-981
Dominguez TE, Chalom R, Costarino Jr AT. The impact of adverse patient occurrences on hospital costs in the pediatric intensive care unit. Critical Care Medicine 2001, 29(1), 169-174
Elward AM, Hollenbeak CS, Warren DK, Fraser VJ. Attributable cost of nosocomial primary bloodstream infection in pediatric intensive care unit patients. Pediatrics 2005, 115(4), 868-872
Fabbro-Peray P et al. Estimation de la mortalité attribuable aux IN, enquête exposé-non-exposé au sein de la cohorte des patients hospitalisés au CHU de Nîmes, octobre 2004
Fermon B, Levy P. La diffusion publique de données relatives à l'activité, la performance, les résultats des établissements de santé, Etude bibliographique réalisée pour la HAS, novembre 2005
Hollenbeack CS, Murphy D, Dunnagan WC, Fraser VJ. Nonrandom selection and the attributable cost of surgical-site infections. Infection control and hospital epidemiology 2002, 23(4), 177-182
Kaoutar B et al. Nosocomial infections and hospital mortality : a multicentre epidemiology study. J Hosp Infect, 2004 ; 58 (4), 268-75
Lauria FN, Angeletti C. The impact of nosocomial infections on hospital care costs. Infection 2003; 31(Suppl2):35-43
Ledoux M. Hygiène au bloc opératoire : Evaluation d'un protocole de comportement en chirurgie orthopédique et traumatologique, Mémoire de DES de pharmacie hospitalière, Strasbourg, 1999
Lopman BA, Reacher MH, Vipond IB, Hill D, Perry C, Halladay T, Brown DW, Edmunds WJ, Sarangi J. Epidemiology and cost of nosocomial gastroenteritis Avon, England, 2002-2003. Emerging Infectious Diseases 2004, 10(10), 1827-1834
Maugein J. et al, Observatoires régionaux du pneumocoque : surveillance des sérotypes et de la résistance aux antibiotiques des souches de S. pneumoniae en France, 2003. Bulletin épidémiologique hebdomadaire n°1, 2006, 6-8
McGarry SA, Engemann JJ, Schmader K, Sexton SJ, Kaye KS. Surgical-site infection due to staphylococcus aureus among elderly patients : mortality, duration of hospitalization, and cost. Infection control and hospital epidemiology, 2004, 25 (6), 461-467
Orsi GB, Di Stefano L, Noah N. Hospital-acquired, laboratory-confirmed bloodstream infection: increased hospital stay and direct costs. Infection control and hospital epidemiology 2002, 23(4), 190-197
Payne NR, Carpenter JH, badger GJ, Horbar JD, Rogowski J. Marginal increase in cost and excess length of stay associated with nosocomial bloodstream infections in surviving very low birth weight infants. Pediatrics 2004, 114(2), 348-355
Piednoir E, Bessaci K, Bureau-Chalot F, Sabouraud P, Brodard V, Andréoletti L, Bajolet O. economic impact of healthcare associated rotavirus infection in a pediatric hospital. The journal of hospital infection 2003, 55(3), 190-195
Pirson M, Dramaix M, Struelens M, Riley TV, Leclercq P. Costs associated with hospital-acquired bacteraemia in a Belgian hospital. The Journal of Hospital Infection 2005, 59(1): 33-40
Plowman R, Graves N, Griffin MAS, Roberts JA, Swan AV, Cookson B, Taylor L. The rate and cost of hospital-acquired infections occurring in patients admitted to selected specialties of a district general hospital in England and the national burden imposed. The Journal of Hospital infection 2001, 47(3), 198-209
Raymond DP et al. Impact of rotating empiric antibiotic schedule on infectious mortality in a intensive care unit. Crit Care Med, 2001, vol 29, 1101-1108
Roberts RR, Scott RD, Cordell R, Solomon SL, Steele L, Kampe LM, Trick WE, Weinstein RA. The use of economic modelling to determine the hospital costs associated with nosocomial infections. Clin Infect Dis 2003, 36, 1424-1432
Saint S, Veenstra DL, Lipsky BA. The clinical and economics consequences of nosocomial central venous catheter-related infection: are antimicrobial catheters useful ? Infection control and hospital epidemiology 2000, 21(6), 375-380
Slonim AD, Kurtines HC, Sprague BM, Singh N. The costs associated with nosocomial bloodstream infections in the pediatric intensive care unit. Pediatric Crit Care Med. 2001; 2: 170-174
Tambyah PA, Knasinski V, Maki DG. The direct costs of nosocomial catheter-associated urinary tract infection in the era of managed care. Infection control and hospital epidemiology 2002, 23(1), 27-31
Tirésias, volume III, Prévention des infections en chirurgie orthopédique
Trystram D et al. Réseau européen de surveillance de la résistance bactérienne aux antibiotiques (EARSS) : résultats 2002, place de la France, BEH, n°32-33/2004, 141-164
Vincent JL et al., JAMA, 1995, vol 274, 639-644
Vincent JL, Nosocomial infections in adult intensive-care units, Lancet, 2003, 361, 2068-2077
Whitehouse JD, Friedman ND, Kirkland KB, Richardson WJ, Sexton DJ. The impact of surgical-site infections following orthopedic surgery at a community hospital and a university hospital : adverse quality of life, excess length of stay, and extra cost. Infection control and hospital epidemiology, 2002, 23 (4), 183-189
Wilcox MH, Health-care-associated infection : morbidity, mortality and costs, Hospital Medecine, 2004, vol 65, 88-91
Rapports consultés (publications sur les sites internet correspondants)
o Programme national de lutte contre les infections nosocomiales 2005-2008, Ministère de la Santé
o Réseau BMR-Raisin, surveillance des bactéries multirésistantes dans les établissements de santé en France, résultats 2002 ; Vincent Jarlier (coordonnateur national BMR-Raisin), 31 p.
o EARSS, European Microbial Resistance Surveillance System, rapports 2001, 2002, 2003, 2004.
o Rapport de la communauté européenne : on the basis of member states' reports on the implementation of the council recommendation (2002/77/EC) on the prudent use of antimicrobial agents in human medecine, le 22/12/05.
o Surveillances des IN en réanimation (RAISIN), 2004
o Surveillances des ISO (RAISIN), 2004
o Rapport statistique ICU Helics (hospital in Europe Link for Infection Control through Surveillance) 2005
o Rapport statistique SSI Helics, 2005
o Conférence de consensus. Organisée par la Société Française d'Hygiène Hospitalière. Gestion pré-opératoire du risque infectieux. Conférence 5 mars 2004
o Plan National d'action pour préserver l'efficacité des antibiotiques 2001 - 2005, Ministère de la Santé
o Accord - cadre national relatif au bon usage des antibiotiques dans les établissements de santé
Abréviations
ANAES : Agence nationale d'accréditation et d'évaluation en santé
ARH : Agence régionale d'hospitalisation
BMR : Bactérie multi-résistante
BPCO : Broncho-pneumopathie chronique obstructive
CCLIN : Centre de coordination de la lutte contre les infections nosocomiales
CDC : Center for Disease Control and Prevention
CH : Centre hospitalier
CHSCT : Comité d'hygiène, de sécurité et des conditions de travail
CHU : Centre hospitalier universitaire
CLIN : Comité de lutte contre les infections nosocomiales
CME : Commission médicale d'établissement
CNAM : Commission nationale des accidents médicaux
CNAMTS : Caisse Nationale d'assurance-maladie des travailleurs salariés
COMPAQH (projet) : Coordination pour la mesure de la performance et l'amélioration de la qualité hospitalière
CRCI : Commissions régionales de conciliation et d'indemnisation des accidents médicaux, des affections iatrogènes et des infections nosocomiales
CRU : Commission de relation avec l'usager
CSHPF : Conseil supérieur d'hygiène publique de France
CTIN : Comité technique national des infections nosocomiales
CTINILS : Comité technique national des infections nosocomiales et des infections liées aux soins
CVC : Cathéter veineux central
DDASS : Direction départementale des affaires sanitaires et sociales
DRASS : Direction régionale des affaires sanitaires et sociales
DGS : Direction générale de la santé
DHOS : Direction de l'hospitalisation et de l'organisation des soins
DREES : Direction de la recherche, des études, de l'évaluation et des statistiques
EARSS : Réseau européen de surveillance de la résistance bactérienne aux antibiotiques
EBLSE : Entérobactéries productrices de ?-lactamases à spectre étendu
ECBU : Examen cytobactériologique des urines
EHPAD : Etablissement d'hébergement des personnes âgées dépendantes
EIG : Evénements indésirables graves liés aux soins
ENEIS : Etude nationale sur les événements indésirables liés aux soins
ENP : Enquête nationale de prévalence
EOH : Equipe opérationnelle d'hygiène
EOHH : Equipe opérationnelle d'hygiène hospitalière
EPP : Evaluation des pratiques professionnelles
ETP : Equivalent temps plein
HAD : Hospitalisation à domicile
HAS : Haute autorité de santé
HELICS : Hospital In Europe Link for Infection Control through Surveillance
IAS : Infection associée aux soins
ICALIN : Indice composite d'évaluation des activités de lutte contre les infections nosocomiales
IBODE : Infirmière de bloc opératoire diplômée d'état
IDE : Infirmière diplômée d'état
IDMIN : Mission nationale d'information et de développement de la médiation sur les infections nosocomiales
IGAS : Inspection générale des affaires sociales
ILS : Infection liée aux soins
IN : Infection nosocomiale
INSERM : Institut national de la santé et de la recherche médicale
INVS : Institut national de veille sanitaire
IPP : Incapacité permanente partielle
IPSE : Improving Patient Safety in Europe
ITT : Incapacité temporaire totale
ISO : Infection du site opératoire
IU : Infection urinaire
LIEN : Association de patients créée par Béatrice et Alain-Michel Ceretti suite à l'affaire de la clinique du Sport
MCO : Disciplines de court séjour Médecine-Chirurgie-Obstétrique
NNIS : National nosocomial infection survey
ONIAM : Office national d'indemnisation des accidents médicaux, des affections iatrogènes et des infections nosocomiales
PSPH : Participant au service public hospitalier
RAISIN : Réseau d'alerte, d'investigations et de surveillance des infections nosocomiales
SARM : Staphylococcus aureus résistant à la méticilline
SFAR : Société française d'anesthésie et de réanimation
SHA : Solution hydro-alcoolique
SLD : Soins de longue durée
SOFCOT : Société française de chirurgie orthopédique
SSR : Soins de suite et de réadaptation
TIRESIAS : Groupe d'experts issus de 4 sociétés savantes (SFAR, SOFCOT, Société de pathologie infectieuse de langue française, Société française de microbiologie)
UHLIN : Unité hospitalière de lutte contre les infections nosocomiales
USI : Unité de soins intensifs
USLD : Unité de soins de longue durée
VIH : Virus de l'immunodéficience humaine
VRS : Virus respiratoire syncitial
|
|
CNEH 3 RUE DANTON 92240 MALAKOFF DÉPARTEMENT 01 41 17 15 36 |
SENAT
OFFICE PARLEMENTAIRE D'EVALUATION
DES POLITIQUES DE SANTE
|
LA POLITIQUE DE LUTTE CONTRE LES INFECTIONS NOSOCOMIALES |
III. ANNEXES AU RAPPORT
|
JUIN 2006 |
ANNEXE 1 : CIRCULAIRE DU 19 AVRIL 1995 relative à la lutte contre les infections nosocomiales dans les établissements hospitaliers
Textes de référence : Décret N° 88-657- Circulaire N°263 du 13/10/1988 - Arrêté du 3 août 1992
Les infections nosocomiales ou infections acquises à l'hôpital, sont responsables d'une morbidité et d'une mortalité très importantes dans les établissements hospitaliers. Selon les différentes études menées en France 5% à 10% des malades hospitalisés acquièrent une infection nosocomiale. Chaque année 600 000 à 1 100 000 patients admis en court séjour développeront donc une de ces infections du fait de leur séjour à l'hôpital. Les établissements de moyen ou long séjour sont aussi concernés par ces infections. Enfin, celles ci seraient à l'origine d'environ 10 000 décès par an.
A cette réalité inacceptable pour les patients, s'ajoute un coût financier pour la collectivité; 2% à 5% des journées d'hospitalisation en court séjour seraient liées à l'existence de ces infections, et plus d'un tiers du budget des antibiotiques est dépensé pour leur traitement.
Selon les travaux réalisés dans différents pays européens la fréquence des résistances aux antibiotiques est particulièrement élevée en France. La fréquence moyenne de la résistance à la méthicilline des staphylocoques dorés est supérieure à 34% alors qu'elle n'est que de 1% dans les pays nordiques.
Si le risque d'infection nosocomiale a toujours existé, il s'est accru avec l'évolution des pratiques de soins et du recrutement des patients hospitalisés. Jusqu'aux années 50 les infections hospitalières étaient essentiellement liées à l'acquisition par les patients de germes apportés par l'environnement ou les autres patients. Le développement de pratiques de soins plus efficaces mais plus invasives s'est accompagné d'un risque de contamination "endogène", les patients développant des infections à partir de leurs propres germes à l'occasion de leur séjour à l'hôpital. Par ailleurs le recrutement des patients hospitalisés se modifie également avec la prise en charge de patients de plus en plus vulnérables à l'infection. Or ces infections ne sont pas une fatalité car elles sont en partie évitables. Leur fréquence peut être diminuée sensiblement et en particulier la fréquence des infections qui se développent sur un mode épidémique.
Une réduction de la fréquence des infections nosocomiales doit devenir un objectif institutionnel pour l'ensemble des hôpitaux français dans l'optique d'améliorer la qualité des soins à l'hôpital. Une réduction de l'ordre de 30% de la fréquence des infections nosocomiales dans l'ensemble des hôpitaux en cinq ans doit ainsi être visée. Ceci implique un investissement humain et financier, mais elle peut inversement permettre de dégager des ressources financières, notamment sur le plan de la consommation des antibiotiques. Ceci implique une prise de conscience de l'ensemble des professionnels hospitaliers et la mise en place d'un véritable plan de lutte propre à chaque établissement hospitalier. Un tel objectif fait partie d'un processus initié en 1988 par la création des Comités de Lutte contre les Infections Nosocomiales (CLIN).
La mobilisation des professionnels hospitaliers est un préalable indispensable à la mise en place d'un tel plan de lutte. Cette action ne peut être menée sans le soutien actif de toute la communauté hospitalière. Par ailleurs le CLIN doit pouvoir s'appuyer sur une unité opérationnelle en hygiène hospitalière afin de pouvoir exercer une action continue dans l'établissement hospitalier.
La prévention repose sur une vigilance quotidienne dans l'organisation des soins et le respect des bonnes pratiques d'hygiène. Le respect des bonnes pratiques doit être facilité par l'élaboration et la diffusion de recommandations ou de protocoles écrits portant sur les situations les plus fréquentes. Le respect des recommandations doit être évalué régulièrement. Des formations pratiques d'hygiène doivent être mises en place, en particulier pour les médecins et les infirmières, et ceci dès leurs premiers stages à l'hôpital.
La surveillance épidémiologique des infections nosocomiales est un complément indispensable aux efforts de prévention entrepris. Elle doit permettre de fixer des objectifs chiffrés et d'apprécier l'impact des mesures prises sur la fréquence des infections. Elle doit être conçue comme un moyen de contrôler et d'adapter les mesures de lutte et non comme une fin en soi.
L'action du ministère de la santé en matière d'infection nosocomiale s'est traduite jusqu'alors par :
ð Le décret n°88-657 du 6 mai 1988 relatif à l'institution des comités de lutte contre les infections nosocomiales qui fixait les grandes règles de leur mise en place, de leur rôle et de leur fonctionnement, et dont la circulaire n° 263 du 13 octobre 1988 précisait les modalités d'application,
ð La création de structures de coordination nationale et inter-régionales par arrêté du 3 août 1992 : un comité technique national des infections nosocomiales (CTIN), et cinq centres de coordination de la lutte contre les infections nosocomiales (CCLIN),
ð Une incitation à la création de postes en hygiène hospitalière en 1992 et 1993.
A la suite des forums des présidents de CLIN organisés en 1990 et 1991 et des réflexions du Conseil Supérieur d'Hygiène Publique de France, il est apparu nécessaire de faire évoluer le dispositif mis en place par le décret et la circulaire de 1988. Cette circulaire s'inscrit dans le cadre du plan gouvernemental de lutte contre les infections nosocomiales présenté le 3 novembre 1994.
1 - Objectifs des actions de prévention et de surveillance des infections nosocomiales
La prévention des infections nosocomiales s'inscrit dans une démarche globale de qualité des soins. La loi du 31 juillet 1991 fait obligation aux établissements de santé de développer des politiques d'évaluation de la qualité des soins.
L'établissement devra se fixer des objectifs à atteindre en terme d'actions (prévention, formation, surveillance) et en terme de résultats. Des objectifs chiffrés de diminution des infections nosocomiales seront fixés au sein de l'établissement et par service, en particulier pour les services à taux élevés d'infections.
Les actions seront menées en cohérence avec le projet d'établissement établi en concertation avec les instances qui concourent à sa réalisation et à son suivi (ce projet ayant été étudié par le CLIN en ce qui concerne le risque infectieux). Chaque année, le président du comité de lutte contre les infections nosocomiales préparera un document sur le bilan annuel des activités du comité ainsi que les projets d'actions pour l'année suivante. Ce document sera soumis à la commission médicale d'établissement, pour avis, et au conseil d'administration pour information.
2 - Modalités d'organisation de la prévention des infections nosocomiales dans les établissements
La loi du 31 juillet 1991 renforce le rôle des CLIN : structure de dialogue et de propositions, lieu d'élaboration d'une politique concertée d'hygiène et de qualité à l'hôpital.
Comité de lutte contre les infections nosocomiales
- Missions
Dans le cadre des orientations définies au niveau national et inter-régional, le CLIN est responsable de l'organisation, de la prévention et de la surveillance des infections nosocomiales dans l'établissement. Ces éléments sont indispensables à la recherche de qualité dans l'établissement. Le CLIN doit être soutenu par l'ensemble des professionnels hospitaliers pour la réalisation de sa mission.
En matière de prévention, les actions du CLIN concerneront en particulier :
ð l'hygiène de base (lavage des mains, tenue vestimentaire, équipement sanitaire...)
ð la sécurité des actes à haut risque d'infection (sondage urinaire, cathétérisme sanguin, intervention chirurgicale, ventilation assistée, endoscopie...)
ð la sécurité des zones à haut risque d'infection (blocs opératoires, unités de réanimation, salles d'examens complémentaires invasifs...)
ð la sécurité des produits à hauts risques d'infection (produits injectables, produits d'alimentation parentérale, eau et alimentation...)
ð les risques liés aux nouvelles techniques médico-chirurgicales
ð les techniques de désinfection et de stérilisation du matériel de soin
ð l'aménagement des locaux et les travaux, pour ce qui est de leurs conséquences en terme de risque infectieux.
Le CLIN veillera à ce que soient élaborés et diffusés des protocoles concernant les bonnes pratiques d'hygiène lors des soins. Le CLIN sera consulté pour tout projet d'aménagement des locaux, d'organisation des circuits, d'acquisition d'équipement ou de matériel, et lors du choix de produits désinfectants ou de nettoyage, dans le cas où ces projets et ces choix peuvent avoir des conséquences en termes d'hygiène. Dans la mesure où elles peuvent interférer avec le respect des règles d'hygiène, les modalités d'organisation du travail du personnel hospitalier doivent aussi faire l'objet d'une concertation avec le CLIN.
En matière de surveillance, le CLIN veillera à ce que soit mis en place un recueil d'indicateurs pertinents permettant de juger de l'évolution de la fréquence des infections nosocomiales dans l'établissement et donc de l'efficacité des actions entreprises. Il s'appuiera sur les recommandations élaborées par le comité technique national des infections nosocomiales (CTIN) pour la mise en place de ces indicateurs (méthodes de recueil et d'analyse). La surveillance dans les établissements reposera notamment sur :
ð une surveillance générale pour l'ensemble des services de l'établissement comportant au minimum l'organisation d'enquêtes de prévalence "un jour donné" et la surveillance des bactéries multi-résistantes, complétées par des indicateurs choisis pour leur pertinence, en fonction du recrutement et de l'activité des services.
ð une stratégie spécifique de surveillance dans les services présentant un risque élevé d'infections nosocomiales : incidence des infections nosocomiales en continu sur une période d'au moins trois mois par an pour les services de réanimation, et incidence en continu sur une période d'au moins trois mois par an, des infections des sites opératoires dans les services de chirurgie.
Les résultats de la surveillance seront diffusés auprès des services qui ont participé à cette surveillance selon les modalités qui auront été discutées en concertation avec ces services. Le croisement de données existantes dans l'hôpital (examens de laboratoires, prescriptions d'antibiotiques, résumés de sortie standardisés...) sera envisagé afin d'optimiser le travail de recueil. La coordination des activités de surveillance sera assurée par le CLIN avec le personnel d'hygiène hospitalière. Les établissements seront encouragés à participer à des réseaux de surveillance coordonnés par les CCLIN de leur inter-région.
De plus, le CLIN a un rôle primordial en matière de formation initiale et continue des personnels à l'hygiène hospitalière et à la prévention des infections nosocomiales: élaboration de la politique de formation du personnel, contribution à la préparation des plans de formation. Les modalités d'une formation pratique des étudiants des professions médicales et paramédicales avant les premiers stages hospitaliers seront examinées par le CLIN, en particulier dans le cadre du stage infirmier prévu par l'arrêté du 18 mars 1992. Il sera systématiquement consulté lorsque l'hôpital fait appel à des structures extérieures à l'établissement pour la formation du personnel en hygiène hospitalière.
Plus généralement, le CLIN peut se voir confier toute mission concernant les infections nosocomiales par la commission médicale d'établissement ou la direction de l'établissement.
à Composition
L'ensemble des catégories professionnelles hospitalières concernées devra être représenté dans le CLIN, et participer à ses travaux. En plus de la composition initialement prévue par les textes sus-cités, il est recommandé de faire appel à des membres invités permanents ou occasionnels. En particulier, doivent être mieux représentés au sein du CLIN :
ð L'équipe opérationnelle d'hygiène hospitalière, ou le personnel d'hygiène hospitalière,
ð Les personnes intéressées et motivées et principalement les infirmières (dont le directeur ou la directrice des soins infirmiers), un médecin spécialiste des maladies infectieuses, un ingénieur biomédical, le médecin du travail ...,
ð Les représentants des services administratifs, chaque fois que cela sera nécessaire (au minimum une fois par an) : services économiques, services techniques, service de la formation continue du personnel...
ð les responsables des écoles professionnelles relevant de l'établissement, chaque fois que cela sera nécessaire.
2.2 Equipe opérationnelle de lutte contre les infections nosocomiales
à Constitution et composition
Pour la réalisation de ses missions, le CLIN est assisté d'une équipe constituée de personnels médical et paramédical spécialisés en hygiène hospitalière. Selon la taille de l'établissement cette équipe peut être :
ð un service ou un département d'hygiène hospitalière,
ð une unité fonctionnelle rattachée à un service d'hygiène hospitalière ou à un autre service médical ou à un laboratoire de l'établissement,
ð une équipe inter-établissement,
ð dans les établissements de petite taille (moins de 400 lits), il peut s'agir de personnel mis à disposition du CLIN.
Le nombre de personnes constituant l'équipe opérationnelle dépend de la taille et de la nature de l'établissement. Tous les établissements de court, moyen ou long séjour de 400 lits ou plus devraient disposer d'au moins une infirmière hygiéniste à temps plein dans l'hôpital, et tous les établissements de plus de 800 lits devraient disposer d'au moins un praticien hospitalier à temps plein. Pour les établissements de plus petite taille, la création d'équipes inter-établissements en particulier départementales sera encouragée, notamment lorsqu'il existe déjà une collaboration entre les établissements concernés. Par ailleurs la création d'une structure "qualité des soins" peut permettre de créer une synergie entre l'activité de prévention des infections nosocomiales et l'évaluation des soins.
Le personnel de l'équipe opérationnelle est particulièrement chargé de la mise en oeuvre des actions de prévention et de surveillance des infections nosocomiales, sous le contrôle des membres du CLIN, et en collaboration avec la Direction des Soins Infirmiers. Il devra être formé en hygiène hospitalière, que ce soit lors de sa formation initiale ou au cours d'une formation continue, afin d'assumer les tâches décrites ci-dessous.
à Missions
Les membres de l'équipe opérationnelle en hygiène hospitalière assurent les fonctions suivantes dans le cadre des orientations définies par le CLIN :
ð la mise en oeuvre de la politique de prévention des risques infectieux, les techniques d'isolement, les contrôles d'environnement et l'hygiène générale de l'établissement,
ð l'élaboration, en collaboration avec les services concernés, de protocoles de soins et l'évaluation de leur application,
ð l'investigation d'épidémies,
ð la surveillance des infections nosocomiales et plus particulièrement la validation et l'analyse des informations collectées et leur restitution aux services concernés.
Les membres de l'équipe opérationnelle seront consultés par le CLIN pour :
ð la construction, l'aménagement et l'équipement des locaux hospitaliers,
ð la conduite d'études économiques et d'évaluation relatives à la qualité des soins dans le domaine des infections hospitalières,
ð l'étude et le choix des matériels et produits utilisés pour les soins et l'entretien,
ð la formation initiale dans les écoles professionnelles relevant de l'établissement,
la formation continue du personnel hospitalier.
Référents en hygiène hospitalière
Les actions du CLIN seraient largement facilitées par l'identification, au sein de chaque service hospitalier prenant en charge des soins ou des actes médico-chirurgicaux, de "référents en hygiène hospitalière". Ces référents devraient être un médecin et une infirmière motivés, tous deux travaillant dans leur service de façon régulière. Les référents en hygiène hospitalière seront les relais du CLIN dans les services de l'hôpital et constitueront un réseau de personnels motivés sur lequel le CLIN pourra s'appuyer pour relayer les actions de prévention et de surveillance.
Liens et collaboration du CLIN et de l'équipe opérationnelle en hygiène hospitalière avec les autres structures de l'hôpital
L'action du CLIN et de l'équipe opérationnelle en hygiène hospitalière ne peut être menée à bien qu'avec le soutien actif de toute la communauté hospitalière. Le directeur de l'établissement et le président de la CME ont pour mission de relayer ses efforts auprès des autres professionnels de l'hôpital. Par ailleurs certaines structures dans l'hôpital ont par leurs missions un lien naturel avec le CLIN.
La direction des soins infirmiers est associée aux travaux du CLIN, et les infirmières hygiénistes membres de l'équipe opérationnelle en hygiène hospitalière, travaillent en coordination avec la direction des soins infirmiers.
Le CLIN et l'équipe opérationnelle en hygiène hospitalière devront veiller à la concertation avec le département d'information médicale pour aider au suivi des infections nosocomiales.
Le laboratoire de microbiologie devra être associé aux travaux du CLIN et de l'équipe opérationnelle en hygiène hospitalière, notamment pour la surveillance de la fréquence des infections nosocomiales et pour l'aide à la détection des épisodes épidémiques.
Le service de médecine du travail participera aux actions du CLIN (relais des actions de prévention pour la sécurité du personnel hospitalier, enquêtes en cas de contamination...).
Le comité du médicament et le CLIN travailleront de façon concertée à la mise en place d'actions spécifiques concernant la prescription d'antibiotiques, et éventuellement à la création d'une commission des antibiotiques.
D'une manière générale, le CLIN et l'équipe opérationnelle en hygiène hospitalière établiront des liens avec toutes les instances qui participent à la mise en oeuvre de la politique d'évaluation et d'amélioration de la qualité des soins.
3 - Rôle des structures extra-hospitalières en lien avec le CLIN
Au niveau national
Le CTIN, propose les orientations prioritaires de la lutte contre les infections nosocomiales et élabore des outils méthodologiques destinés aux personnels hospitaliers et en particulier aux CLIN. Il examine chaque année les bilans présentés par les DRASS et les CCLIN. Il rédige un rapport annuel d'activité, destiné au ministre chargé de la santé, disponible sur demande.
Une cellule "Infections Nosocomiales" commune à la Direction des Hôpitaux et à la Direction Générale de la Santé, est chargée de coordonner l'ensemble de ce dispositif, de suivre au plan national, avec l'aide du Réseau National de Santé Publique et des CCLIN, l'évolution de la fréquence des infections nosocomiales, et d'élaborer avec l'aide du CTIN et des CCLIN, les recommandations et textes relatifs à la prévention des infections nosocomiales.
Au niveau inter-régional
Les CCLIN ont une mission de soutien et d'orientation de l'action des établissements. Notamment, ils peuvent apporter une aide en cas d'épisodes épidémiques, répondre aux besoins de documentation et de formation. Ils organisent des actions de coopération inter-hospitalières en matière de surveillance épidémiologique (réseaux) et de prévention des infections nosocomiales. Ils apportent leur soutien pour la valorisation des données de surveillance des infections nosocomiales de l'inter-région. Ils travaillent avec les DRASS de leur inter-région auxquelles ils transmettent leur rapport d'activité annuel.
Au niveau départemental et régional
Les services déconcentrés de l'état, au niveau départemental (DDASS) et régional (DRASS), peuvent participer à l'élaboration des projets d'activité des établissements en matière de lutte contre les infections nosocomiales. Ils travaillent en collaboration avec les CCLIN dans lesquels ils sont représentés. Les activités de prévention des infections nosocomiales doivent s'inscrire dans le cadre des schémas régionaux d'organisation sanitaire et faire l'objet d'un partenariat entre les services déconcentrés de l'état et les établissements hospitaliers. Chaque année, chaque CLIN rédigera un rapport d'activité détaillant les actions menées, et complétera un tableau synthétique selon le modèle transmis par la DDASS; ces deux documents seront transmis à la DDASS, une copie étant adressée au centre de coordination inter-régional. Le médecin inspecteur départemental de santé publique analysera ces documents avant de transmettre les tableaux d'activités des CLIN à la DRASS et à la cellule infection nosocomiale du ministère. La DRASS réalisera une synthèse régionale des actions de prévention des établissements.
4 - Evaluation des actions de lutte contre les infections nosocomiales au niveau national
L'efficacité des mesures de prévention mises en place seront évaluées au moyen d'indicateurs d'activité et de qualité; l'objectif de ces mesures étant de diminuer de 30% la fréquence des infections nosocomiales d'ici cinq ans.
L'activité des CLIN, des CCLIN et du CTIN feront l'objet d'une synthèse chaque année par la cellule "Infections nosocomiales" du Ministère de la Santé. Cette synthèse sera diffusée sous la forme de publication.
Pour cela, les indicateurs de fréquence des infections nosocomiales seront recueillis, d'une part lors d'enquêtes de prévalence nationale réalisées tous les deux ans sur un échantillon représentatif d'établissements hospitaliers, et d'autre part par la mise en place de réseaux de surveillance inter-établissements réalisant un recueil de l'incidence sur des thèmes donnés (réanimation, résistance des bactéries aux antibiotiques et infection de site opératoire...). Ces enquêtes seront coordonnées par les CCLIN dans chaque inter-région en recherchant une représentativité. Une synthèse des données de surveillance recueillies dans le cadre de ces réseaux sera effectuée en collaboration par le Comité Technique National des Infections Nosocomiales et la cellule "Infection Nosocomiale". Les méthodes de recueil de données et leur analyse feront l'objet de recommandations du Comité Technique National des Infections Nosocomiales, afin d'améliorer l'homogénéité des données recueillies.
ANNEXE 2 : CIRCULAIRE N° DGS/DHOS/E2/2000/645 du 29 décembre 2000 relative à l'organisation de la lutte contre les infections nosocomiales dans les établissements de santé
Résumé
Chaque établissement de santé organise la lutte contre les infections nosocomiales. Un Comité de lutte contre les infections nosocomiales (CLIN) définit le programme d'action de l'établissement dans le domaine de la lutte contre les infections nosocomiales. Ce programme comporte les objectifs à atteindre et les actions à mener en matière de prévention, surveillance, formation, information et évaluation. Une équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales est constituée afin de mettre en oeuvre et évaluer ce programme. Des correspondants en hygiène sont désignés au sein des établissements.
Textes de référence :
ð Article L. 6111-1 du Code de la santé publique (loi n°98-535 du 1er juillet 1998 relative au renforcement de la veille sanitaire et du contrôle de la sécurité sanitaire des produits de santé destinés à l'homme).
ð Articles R. 711-1-1 à R. 711-1-10 du Code de la santé publique (Décret n°99-1034 du 6 décembre 1999 relatif à l'organisation de la lutte contre les infections nosocomiales dans les établissements de santé).
ð Arrêtés du 3 août 1992 et du 19 octobre 1995 relatifs à l'organisation de la lutte contre les infections nosocomiales.
ð Arrêté du 17 octobre 2000 relatif au bilan annuel des activités de lutte contre les infections nosocomiales dans les établissements de santé
ð Textes abrogés ou modifiés : Circulaire N°263 du 13 octobre 1988 relative à l'organisation de la surveillance et de la prévention des infections nosocomiales - Circulaire DGS/VS/VS2 - DH/EO1 - N°17 du 19 avril 1995 relative à la lutte contre les infections nosocomiales dans les établissements de santé publics ou privés participant à l'exécution du service public
Elément fondamental de la politique d'amélioration de la sécurité et de la qualité des soins, la lutte contre les infections nosocomiales a connu depuis 10 ans d'importants développements. Elle est inscrite désormais, en vertu de l'article L. 6111-1 du code de santé publique, parmi les missions de tout établissement de santé. Le décret du 6 décembre 1999 relatif à l'organisation de la lutte contre les infections nosocomiales définit les conditions de cette nouvelle disposition. Ce décret prévoit que tout établissement de santé, qu'il soit public ou privé, détermine un programme d'action de lutte contre les infections nosocomiales, constitue un comité de lutte contre les infections nosocomiales (CLIN) et se dote d'une équipe opérationnelle d'hygiène hospitalière.
La présente circulaire a donc pour objet de préciser aux établissements de santé les modalités de mise en place de ces dispositions réglementaires. Ce texte après avoir exposé la politique menée en France dans le domaine de la lutte contre les infections nosocomiales, définit, dans une première partie, les composantes du programme d'action ainsi que les actions prioritaires à mettre en place. Dans une seconde partie, il précise le rôle et les modalités d'organisation des structures de lutte contre les infections nosocomiales.
Introduction
Les infections nosocomiales sont des infections contractées dans un établissement de santé. Elles peuvent toucher les personnes soignées ainsi que les professionnels de santé en raison de leur activité.
En France, les données en matière de surveillance des infections nosocomiales, issues de diverses enquêtes nationales [1] ou de réseaux inter-établissements, montrent que les infections nosocomiales les plus fréquentes sont les infections urinaires, suivies par les infections respiratoires et celles du site opératoire. La fréquence et la nature de ces infections sont influencées par l'état pathologique des patients. Certains services hospitaliers ont un taux plus élevé d'infections nosocomiales, car ils rassemblent une plus forte proportion de patients fragilisés ou dont l'état nécessite la pratique d'actes invasifs. C'est le cas des services de réanimation, de chirurgie et de soins de suite et de longue durée. Si la fréquence des infections nosocomiales est comparable en France à ce qui est observé dans d'autres pays, la résistance des bactéries aux antibiotiques est plus fréquente dans notre pays que dans d'autres pays européens, notamment parmi les pays d'Europe du Nord (Danemark, Pays-Bas, Allemagne).
Face à ce problème de santé publique, le ministre chargé de la santé développe, depuis plusieurs années, une politique active dans le domaine de la lutte contre les infections nosocomiales. Dès 1988, des comités de lutte contre les infections nosocomiales (CLIN) ont été institués dans les établissements de santé publics ou privés participant au service public hospitalier (PSPH). Ce dispositif a été complété en 1992 par la création de structures nationales et interrégionales. Le comité technique des infections nosocomiales (CTIN) est chargé de proposer les orientations de la politique nationale. A l'échelon interrégional, 5 centres de coordination de la lutte contre les infections nosocomiales (C.CLIN) ont une mission d'appui scientifique et technique aux établissements de santé en matière d'investigations, d'enquêtes épidémiologiques, d'informations et de formations. En 1995, " la cellule infections nosocomiales " rattachée à la direction générale de la santé et à la direction de l'hospitalisation et de l'organisation des soins a été créée afin de coordonner le dispositif mis en place.
L'ensemble des actions engagées s'inscrit depuis 1995 dans un programme national dont l'objectif est de réduire la fréquence des infections nosocomiales et la fréquence des bactéries multi-résistantes aux antibiotiques (BMR) dans les établissements de santé. Ce programme est fondé notamment sur la diffusion de recommandations de bonnes pratiques d'hygiène, l'amélioration de la formation en hygiène et le développement d'un système national de surveillance épidémiologique des infections nosocomiales.
Par ailleurs, la nécessité, pour tout établissement de santé, de développer des démarches d'amélioration de la qualité et de la sécurité des soins a été rappelée par les ordonnances du 24 avril 1996. Ces mesures législatives ont introduit le concept d'accréditation [2] et la démarche de contractualisation qui accordent, tous deux, une large place aux activités de lutte contre les infections nosocomiales. Enfin, la loi de sécurité sanitaire n°98-535 du 1er juillet 1998 est venue renforcer les obligations des établissements vis à vis du risque infectieux. Désormais, figurent, parmi les missions de tout établissement de santé, l'organisation de la lutte contre les infections nosocomiales et autres affections iatrogènes, l'organisation d'un système assurant la qualité de la stérilisation des dispositifs médicaux, le signalement et le recueil de certaines infections nosocomiales et affections iatrogènes4.
Ces évolutions répondent aux exigences légitimes du public en matière de sécurité sanitaire et d'information précise dans ce domaine, comme en témoignent les conclusions des Etats Généraux de la santé de 1999 et les décisions rendues par les deux ordres de juridiction administrative et civile. Désormais, la responsabilité des établissements de santé publics est engagée pour faute présumée. Pour s'exonérer de cette responsabilité, ces établissements doivent prouver qu'ils ont mis en oeuvre toutes les règles et recommandations en matière d'hygiène. En application du principe d'obligation de sécurité de résultat, la responsabilité des établissements privés est reconnue même en l'absence de faute. Ces établissements doivent, pour s'exonérer de cette responsabilité, apporter la preuve que l'infection nosocomiale est due à une cause étrangère.
1 - Le programme d'action de lutte contre les infections nosocomiales des établissements de santé [Article R. 711-1-1 du Code de la santé publique]
Chaque établissement de santé doit élaborer un programme d'action visant à prévenir les infections nosocomiales et réduire leur fréquence. Ce programme s'inscrit dans une démarche d'amélioration continue de la qualité des soins et met en oeuvre les objectifs généraux de la lutte contre les infections nosocomiales exposés, notamment dans le projet d'établissement. Ce programme s'intègre dans le volet " qualité et sécurité des soins " du contrat d'objectifs et de moyens conclu avec l'agence régionale de l'hospitalisation.
Ce programme annuel préparé par le CLIN en collaboration avec l'équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales, est proposé à l'avis de la commission médicale d'établissement et de la commission du service de soins infirmiers et, dans les établissements privés, à l'avis de la conférence médicale.
La réalisation de ce programme requiert l'adhésion de l'ensemble des professionnels, et nécessite le soutien actif de la direction de l'établissement, de l'encadrement médical, paramédical et technique. La mise en oeuvre de ce programme, qui implique une coopération entre l'équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales, les structures " qualité et gestion des risques " si elles existent, les services cliniques, le laboratoire de microbiologie et les autres services concernés (pharmacie, direction, médecine du travail, services techniques et de formation, ...), nécessite que le CLIN définisse le rôle de chacun des acteurs.
Ce programme annuel tient compte des spécificités de l'établissement et des priorités nationales définies par le CTIN. Ce programme définit les objectifs à atteindre et précise les mesures de prévention (cf. point I-1), le programme de surveillance (cf. point I-2) ainsi que les actions de formation (cf. point I-4) et d'information (cf. point I-5 et I-6) nécessaires à la réalisation des objectifs fixés. En outre, il mentionne les méthodes d'évaluation des actions entreprises permettant d'apprécier le niveau de réalisation du programme. Les résultats de cette évaluation figurent dans le rapport annuel d'activité de la lutte contre les infections nosocomiales établi par le CLIN (cf. point I-7).
1 - 1. Les mesures de prévention des infections nosocomiales
Des mesures de prévention et, notamment, des recommandations techniques de bonnes pratiques d'hygiène (fiches techniques ou protocoles), visant à garantir la sécurité vis à vis du risque infectieux des personnes soignées et des professionnels de santé, sont établies dans chaque établissement. Un état des lieux des pratiques, notamment à l'aide d'audits ou de tout autre outil approprié est une étape préalable à l'élaboration de ces protocoles ou fiches techniques. A cet effet, les établissements peuvent s'appuyer sur l'aide méthodologique et les ressources bibliographiques disponibles dans les C.CLIN.
Les principaux domaines qui pourront être abordés sont cités dans les " 100 recommandations pour la surveillance et la prévention des infections nosocomiales " [3]. Il s'agit de : l'hygiène de base, l'hygiène des actes à haut risque d'infection, les mesures d'hygiène spécifiques à certaines activités, patients ou risques, l'utilisation des produits, la sécurité de l'environnement (air, eau, surfaces, linge, alimentation, déchets).
Ces protocoles ou fiches techniques établis en collaboration avec les services et l'équipe opérationnelle de prévention des infections nosocomiales sont régulièrement mis à jour. Ils figurent dans le livret d'information destiné aux nouveaux membres du personnel et doivent être consultables, à tout moment, au niveau de chaque unité de soins par l'ensemble des professionnels de l'établissement. La mise en place de ces protocoles ou fiches techniques est accompagnée d'actions d'information et de formation du personnel concerné. L'observance des mesures préconisées dans ces protocoles ou fiches techniques est régulièrement évaluée, en particulier, par l'équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales
Dans chaque établissement, une attention particulière doit être portée :
ð à la maîtrise du risque infectieux lié à l'utilisation des dispositifs médicaux et équipements à usage multiple [4] ainsi qu'à la prévention du risque de transmission de l'agent des encéphalopathies subaiguës spongiformes transmissibles (ESST) ;
ð à la prévention de la dissémination des bactéries multi-résistantes aux antibiotiques (BMR) [5] ;
ð au bon usage des antibiotiques, en collaboration avec les services cliniques, la pharmacie, le laboratoire de microbiologie [6] et le Comité du médicament et des dispositifs médicaux stériles dès lors qu'un tel comité sera constitué.
1 - 2. La surveillance des infections nosocomiales
La surveillance des infections nosocomiales est un outil indispensable à la détermination et l'adaptation de la stratégie de prévention de chaque établissement. Son objectif est d'obtenir des informations épidémiologiques permettant de :
ð déterminer les priorités d'action,
ð mesurer les taux d'infection et leur tendance évolutive,
ð participer à l'évaluation des actions entreprises.
En fonction de la taille de l'établissement et de la nature des soins prodigués, la surveillance peut être sélective et concerner les services ou groupes de patients pour lesquels les risques sont les plus élevés ou ceux pour lesquels sont mises en place des actions de prévention [3]. La surveillance des infections nosocomiales s'exerce dans les règles de confidentialité. Les membres du CLIN et de l'équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales ont accès aux informations et données nécessaires à la surveillance. La gestion et l'exploitation des données de surveillance sont facilitées par l'outil informatique et peuvent être organisées en relation avec le département d'information médicale.
Chaque établissement, dans le cadre son programme d'action, met en oeuvre un programme de surveillance défini par le CLIN selon les spécificités de l'établissement et en s'appuyant sur les recommandations diffusées par le CTIN [3] :
ð outre la réalisation d'une enquête de prévalence initiale portant sur l'ensemble des patients hospitalisés, qui constitue une étape préliminaire, le CTIN considère comme absolument prioritaire la mesure de l'incidence des infections du site opératoire, ajustée aux facteurs de risque
ð la surveillance continue de la fréquence des bactéries multi-résistantes [4] et de la consommation de certains antibiotiques [5] doit être l'un des points forts du programme de surveillance.
Cette surveillance s'effectue à l'aide d'informations recueillies auprès du laboratoire de microbiologie, de la pharmacie à usage intérieur et des services cliniques, ce qui peut nécessiter la mise en place d'un système informatisé permettant de collecter les informations utiles à cette surveillance.
La participation des services à des réseaux de surveillance animés par les C.CLIN doit être privilégiée, en raison de l'encadrement méthodologique et de l'appui scientifique apportés par ces structures. En outre, la participation à ces réseaux offre la possibilité, à chacun des services participant, de s'autoévaluer.
1 - 3. L'alerte
Les évènements inhabituels ou sévères, dont l'origine nosocomiale peut être suspectée, doivent être portés, sans délai, à la connaissance du CLIN et de l'équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales afin que les investigations nécessaires à la détermination de leurs causes soient menées et que des mesures de prévention soient mises en oeuvre.
Ces évènements inhabituels par leur gravité ou leur répétition, les caractéristiques du germe, les caractéristiques de survenue concernent notamment :
ð les cas groupés d'infections suspectées d'être causées par le même germe (suspicion d'épidémie) ;
ð les infections dues à des micro-organismes ayant un profil inhabituel de résistance aux anti-infectieux ;
ð les infections suspectes d'être directement causées par une source environnementale (eau, air, alimentation, par exemple : légionellose, aspergillose, toxi-infection alimentaire collective);
ð les infections particulièrement graves : toutes les infections profondes sur prothèses articulaires ou cardiovasculaires ;
ð les infections suspectes d'avoir entraîné un décès. A cet égard, l'analyse des dossiers des patients décédés en vue de détecter une cause iatrogène, n particulier d'infection, est particulièrement importante.
Dans chaque établissement, le CLIN détermine les modalités d'information et d'intervention de l'équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales lors de la survenue de ces événements.
Un décret en Conseil d'Etat pris en application de l'article L. 6111-4 du Code de la santé publique précisera, parmi ces évènements, ceux qui devront faire l'objet d'un signalement aux autorités sanitaires ainsi que leurs modalités de transmission.
1 - 4. La formation des professionnels de l'établissement en matière de lutte contre les infections nosocomiales
La formation dans le domaine de l'hygiène hospitalière et de la gestion du risque infectieux est un élément essentiel de la politique de prévention et de lutte contre les infections nosocomiales menée par tout établissement de santé.
Les établissements privés peuvent utilement s'inspirer des dispositions suivantes prescrites aux établissements de santé publics :
ð les actions de formation sont inscrites dans le plan de formation de l'établissement ;
ð les actions de formation sont proposées à chaque catégorie de personnel : médical, paramédical, médico-technique, technique et administratif. Certaines de ces actions peuvent faire l'objet de formations pluriprofessionnelles ;
ð afin de favoriser une plus grande cohérence entre les actions de prévention du risque infectieux menées dans l'établissement et les formations, le CLIN est consulté, sur les thèmes, contenus, modalités, évaluation des formations dans le domaine de l'hygiène ainsi que sur le choix des intervenants ;
ð les recommandations techniques de bonnes pratiques d'hygiène adoptées dans l'établissement figurent sous forme d'un dossier (cahier d'hygiène) dans chacun des services et font l'objet d'une formation dispensée au personnel concerné. En outre, dans le cadre de la politique d'accueil des nouveaux personnels et étudiants, une présentation des recommandations techniques de bonnes pratiques, qui figurent dans le livret d'accueil, est réalisée.
1 - 5. L'information des professionnels de l'établissement
Pour obtenir leur adhésion dans la durée aux actions de prévention du risque nosocomial, les professionnels de l'établissement doivent bénéficier d'une information régulière concernant les actions menées et leurs résultats.
L'information des services médicaux, médico-techniques, techniques, administratifs et des instances d'avis et de conseil de l'établissement (Commission ou Conférence médicale d'établissement, Commission du service de soins infirmiers, Comité d'hygiène de sécurité et des conditions de travail) est réalisée par le CLIN et l'équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales.
Cette information est assurée par la diffusion :
ð d'une synthèse périodique des données de la surveillance des infections nosocomiales et des résultats d'audits et évaluations ;
ð des recommandations techniques de bonnes pratiques d'hygiène nouvellement adoptées par l'établissement ;
ð de la réglementation dans le domaine de l'hygiène ;
ð des procès-verbaux des réunions du CLIN ainsi que du programme d'action et du rapport annuel d'activité.
1 - 6. L'information des patients
L'accès à une information adaptée est une exigence légitime de tout patient. Il constitue un élément indispensable à l'instauration d'une confiance réciproque entre les professionnels de santé et les malades et contribue à la promotion de la qualité des soins.
L'information des patients est réalisée :
ð de façon générale, lors de leur arrivée, grâce au livret d'accueil qui contient une information sur la politique de lutte contre les infections nosocomiales menée dans l'établissement ;
ð de façon individualisée, par l'équipe soignante, afin de les associer aux mesures spécifiques de prévention et précaution d'hygiène qui leur sont applicables. Cette information permet de renforcer l'adhésion des patients aux mesures annoncées et prises à leur égard, en particulier pour les patients porteurs de bactéries multi-résistantes aux antibiotiques ;
ð lorsqu'il est établi ou suspecté que des patients ont pu être exposés, lors de leur prise en charge hospitalière, à un risque infectieux nécessitant un suivi. Dans ce cas, l'établissement et les praticiens concernés déterminent, avec l'aide du CLIN, une stratégie d'information et de suivi des patients en s'appuyant, au besoin, sur l'aide technique d'experts (par exemple le C.CLIN). La procédure d'information et de suivi adoptée est écrite, notamment pour assurer la traçabilité de sa mise en oeuvre. La nature des informations et les modalités selon lesquelles elles ont été délivrées aux patients sont mentionnées dans le dossier médical.
1 -7. L'évaluation du programme d'action de lutte contre les infections nosocomiales
L'évaluation annuelle du programme permet d'apprécier le degré de réalisation des objectifs du programme, afin de proposer de nouveaux objectifs pour les années suivantes. Elle concerne les actions de prévention, surveillance, formation, information et porte sur les moyens mis en oeuvre, les procédures utilisées et les résultats constatés. Sa méthodologie et les moyens de sa mise en oeuvre sont déterminés dès l'élaboration du programme d'action.
L'évaluation des actions de lutte contre les infections nosocomiales est effectuée par l'équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales de l'établissement de santé.
Les résultats de cette évaluation figurent dans le rapport annuel d'activité établi par le CLIN. Ce rapport, consultable sur place, comporte le bilan standardisé des activités de lutte contre les infections nosocomiales défini par l'arrêté du 17 octobre 2000.
Ce bilan d'activité est adressé par le représentant légal de l'établissement aux services déconcentrés de l'état (DDASS) et au C.CLIN de l'inter-région. Ces bilans permettront aux DRASS, en collaboration avec le C.CLIN de l'inter-région, de réaliser une synthèse régionale des actions menées par les établissements.
2 - Les structures de lutte contre les infections nosocomiales dans les établissements de santé.
La lutte contre les infections nosocomiales concerne l'ensemble des activités de l'établissement et implique tous les professionnels de l'établissement.
La conception, la mise en oeuvre et l'évaluation du programme d'action nécessitent la mise en place, dans chaque établissement de santé, de structures spécifiques :
ð un Comité de lutte contre les infections nosocomiales (CLIN), structure de pilotage,
ð une équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales chargée, notamment, de la mise en oeuvre du programme d'action.
En outre, l'identification au sein de chaque service ou secteur d'activité, de correspondants en hygiène permettra de relayer les actions de prévention des infections nosocomiales.
2 - 1. Le Comité de lutte contre les infections nosocomiales (CLIN) [Articles R. 711-1-4 à R. 711-1-7 du code de la santé publique] :
à Missions
Un CLIN est constitué dans chaque établissement de santé. Ce comité est une instance de proposition et de programmation. Le CLIN, en collaboration avec l'équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales, prépare le programme annuel d'action en matière de lutte contre les infections nosocomiales. Il s'assure de la coordination et de la cohérence des actions menées au sein de l'établissement.
Le CLIN est une instance consultative. Il est informé par le représentant légal de l'établissement et donne son avis sur les projets d'aménagement de locaux, d'étude des circuits et d'acquisition d'équipement dans le cas où ces projets peuvent avoir des conséquences dans le domaine de l'hygiène.
Le CLIN établit le rapport annuel d'activité qui permet d'apprécier le degré de réalisation des objectifs fixés.
à Composition
La composition du CLIN est élargie à l'ensemble des catégories professionnelles. Le conseil d'administration ou l'organe qualifié dans les établissements de santé privés fixe le nombre et la qualité des membres du CLIN conformément à l'article R.711-1-4. La nomination des membres du CLIN est prononcée par le représentant légal de l'établissement.
Au sein du CLIN, l'équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales est représentée par un praticien et un membre du personnel infirmier de cette équipe.
Par ailleurs, conformément au point l) et m) de l'article R. 711-1- 4, au moins une personne parmi les professionnels mentionnés à chacun de ces points est désignée. Enfin, le décret en cours de préparation sur la pharmacie à usage intérieur, prévoit que le président du comité des médicaments et des dispositifs médicaux stériles, ou son représentant, soit membre du CLIN.
Dès sa constitution, le comité élit, parmi les médecins et pharmaciens nommés, un président et un vice-président. Lors de leur premier mandat, il est particulièrement utile que le président et le vice-président participent, en particulier, aux formations orientées sur leurs missions et fonctions de coordination.
En plus des membres nommés, le CLIN peut faire appel aux compétences de professionnels, invités permanents ou occasionnels.
En particulier, selon l'ordre du jour ou chaque fois que nécessaire, il est souhaitable que participent aux travaux du CLIN, un représentant des services économiques, de la formation continue, de la qualité et de la gestion des risques, du Comité d'hygiène de sécurité et des conditions de travail, les correspondants des vigilances, les responsables des écoles professionnelles relevant de l'établissement. Des représentants des ARH, DDASS, DRASS, C.CLIN pourront être invités à ce titre aux réunions du CLIN.
Les usagers sont consultés par le CLIN sur les actions menées dans l'établissement en matière de lutte contre les infections nosocomiales. L'article R. 711-1-6 précise que cette consultation s'effectue par l'intermédiaire de représentants des usagers, qui assistent à la réunion du CLIN au cours de laquelle le rapport annuel d'activité est présenté et le programme d'action discuté.
Le CLIN se réunit en séance plénière au moins 3 fois par an. Le représentant légal de l'établissement met à disposition du comité les moyens nécessaires à son fonctionnement et notamment un temps de secrétariat.
2 - 2. L'équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales [Article R. 711-1-9 du code de la santé publique]
à Missions :
Les actions de l'équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales s'inscrivent dans une démarche d'amélioration continue de la qualité des soins.
Cette équipe est chargée de mettre en oeuvre et d'évaluer le programme de lutte contre les infections nosocomiales adopté par l'établissement. Cette équipe a un rôle d'expert dans la gestion du risque infectieux. Elle intervient dans le choix des méthodologies relatives aux différentes actions à entreprendre. Elle participe, en coopération avec les services concernés, à l'élaboration des recommandations techniques de bonnes pratiques, assure leur diffusion et mise en place et collabore à l'évaluation de leur application. Elle organise le recueil et le traitement des données de la surveillance, coordonne et participe à la formation des professionnels dans le domaine de la gestion du risque infectieux. En outre, elle réalise les investigations et interventions lors de la survenue d'évènements inhabituels ou sévères et participe à la mise en place des mesures réglementaires en matière d'hygiène.
à Composition :
L'équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales associe, au minimum, un médecin ou un pharmacien ainsi qu'un personnel infirmier. Cette équipe peut être complétée par d'autres professionnels (techniciens bio-hygiénistes, techniciens d'études cliniques.) et doit pouvoir s'appuyer sur un secrétariat éventuellement commun avec celui du CLIN.
Chaque établissement de santé se dote de ressources humaines spécifiquement dédiées à la gestion du risque infectieux. L'objectif serait d'atteindre, d'ici trois ans, un ratio d'un personnel infirmier équivalent temps plein pour 400 lits et d'un personnel médical ou pharmaceutique équivalent temps plein pour 800 lits. Dans les établissements de petite taille, la mutualisation des ressources humaines, y compris pour le secrétariat, par la création d'équipes inter-établissement est à privilégier.
Les membres de cette équipe posséderont l'ensemble des compétences nécessaires à l'exercice de leurs missions.
Le personnel infirmier, outre les connaissances dans les domaines de l'épidémiologie, l'hygiène hospitalière et la gestion du risque infectieux, possédera des compétences en matière d'encadrement, pédagogie et méthodologie (qualité, gestion des risques, évaluation). Dans l'objectif de favoriser la reconnaissance de sa fonction transversale au sein de l'établissement, et selon les ressources et le contexte local, il est souhaitable que cet agent occupe une position hiérarchique légitimant ses actions. De plus, dans les établissements publics, cet agent doit être associé aux travaux de la commission du service de soins infirmiers au titre de personne qualifiée conformément à l'article R. 714-26-8.
Le personnel médical et pharmaceutique aura, au cours de son cursus ou de formations post-universitaires, acquis des connaissances en hygiène hospitalière, épidémiologie, microbiologie, maladies infectieuses et démarche qualité.
à Organisation :
Dans les établissements de santé autres que les hôpitaux locaux, l'équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales doit être organisée dans les conditions prévues aux articles L. 6146-1 à L. 6146-8 du code de la santé publique relatifs à l'organisation des soins et fonctionnement médical.
En fonction des besoins de l'établissement de santé, les personnels de l'équipe opérationnelle d'hygiène hospitalière et de prévention peuvent assurer des fonctions dans d'autres secteurs d'activité de l'établissement. Leurs activités au titre de cette équipe doivent être clairement définies.
2 - 3. Les correspondants en hygiène hospitalière
Afin de relayer la mise en oeuvre du programme d'action, il est particulièrement utile que soient désignés parmi les personnels de chaque service ou, dans les établissements privés, de chaque secteur d'activité, un correspondant médical et un correspondant paramédical. Ces correspondants facilitent la mise en oeuvre des actions de prévention et de surveillance des infections nosocomiales, à travers leur participation à :
ð la prévention des infections nosocomiales (aide à l'élaboration et à la mise en place de recommandations techniques de bonnes pratiques d'hygiène...),
ð la diffusion des informations (présentation des nouvelles recommandations, dispositifs médicaux, produits et matériels, information aux nouveaux arrivants, organisation d'un dossier d'hygiène ...) et à l'équipe opérationnelle d'hygiène hospitalière de prévention des infections nosocomiales (difficultés d'application des nouvelles procédures...),
ð la surveillance (aide au recueil des données, participation au retour d'information...) et au signalement d'évènements inhabituels ou sévères,
ð l'évaluation des pratiques et des moyens (faisabilité des recommandations préconisées, essai de nouveaux dispositifs médicaux, produits, matériel et techniques,...).
Le CLIN et l'équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales déterminent le profil des correspondants, la durée de leur mandat, le champ et l'organisation de leurs activités, le contenu de leur formation à inscrire au plan de formation de l'établissement. Au sein de chaque service ou secteur d'activité, le correspondant médical est désigné par le responsable médical du service et, dans les établissements privés, par le directeur ou représentant légal de l'établissement. La liste de ces correspondants est transmise à la commission ou conférence médicale d'établissement. Le correspondant paramédical est désigné par le responsable de l'encadrement paramédical du service ou du secteur d'activité, en concertation avec le directeur du service de soins infirmiers ou, dans les établissements privés, le responsable du service de soins infirmiers.
2 - 4. La lutte contre les infections nosocomiales et les actions de coopération hospitalière.
En vertu des dispositions de l'article L 6134-1, les actions de coopération auxquelles participent les établissements publics de santé peuvent être organisées par voie de convention simple ou dans le cadre de structures dotées de la personnalité morale (syndicat inter-hospitalier, groupement de coopération sanitaire, groupement d'intérêt public, groupement d'intérêt économique).
à L'équipe opérationnelle d'hygiène hospitalière et de prévention
L'article R. 711-1-9 prévoit que les établissements de santé peuvent se doter d'une équipe opérationnelle d'hygiène hospitalière et de prévention par la voie d'une action de coopération hospitalière. En vertu de ces dispositions, les personnels d'un établissement de santé peuvent intervenir dans un autre établissement pour y assurer les missions dévolues à cette équipe opérationnelle d'hygiène hospitalière et de prévention. L'organisation d'une telle coopération ne justifie pas la création de structure de coopération mais peut être utilement mise en oeuvre par voie de convention simple.
Cette équipe mobile, qui pourra être située dans l'établissement le plus important, intervient au niveau de chacun des établissements dans les conditions définies par la convention. Afin de faciliter l'activité de cette équipe, il est nécessaire de :
ð limiter le nombre d'établissements partageant cette équipe,
ð déterminer un éloignement géographique raisonnable entre les établissements,
ð définir les modalités de travail de cette équipe, en collaboration avec le directeur d'établissement, le directeur des services de soins infirmiers, le président de la commission ou conférence médicale d'établissement et du CLIN de chacun des établissements,
ð définir un temps minimal de présence de cette équipe dans chacun des établissements,
ð disposer, au minimum, dans chacun des établissements, d'un correspondant médical et paramédical au niveau de chaque service ou secteur d'activité, réunis régulièrement avec l'équipe inter-établissement d'hygiène hospitalière de prévention des infections nosocomiales.
à La lutte contre les infections nosocomiales dans les structures de coopération hospitalière
L'obligation d'organiser la lutte contre les infections nosocomiales prévue à l'article L. 6111-1 du code de la santé publique ne vise que les établissements de santé et ne concerne pas directement les structures de coopération hospitalière. Toutefois, il va de soi que les établissements de santé qui assurent certaines de leurs missions de soins dans le cadre d'une structure de coopération (syndicat inter-hospitalier ou groupement de coopération sanitaire) restent soumis, pour lesdites activités, aux dispositions législatives et réglementaires relatives à la lutte contre les infections nosocomiales.
Chacun de ces établissements doit, notamment, constituer un CLIN, élaborer un programme d'action.
En outre, il incombe aux établissements de santé ainsi associés d'organiser la lutte contre les infections nosocomiales pour l'ensemble des activités de soins assurées au sein d'une structure de coopération. Une politique cohérente et coordonnée en matière de gestion du risque infectieux doit être instaurée dans les domaines des soins ou médico-techniques intéressés par cette coopération (ex : bloc opératoire, plateau technique ...) et nécessite l'organisation de réunions communes des CLIN des établissements coopérants.
Le cadre général d'élaboration du programme d'action en concertation avec les différents CLIN des établissements membres ainsi que les modalités d'intervention d'une équipe inter-établissement d'hygiène hospitalière et de prévention des infections nosocomiales, prévues à l'article R. 711-1-9, pourraient être utilement définis dans les actes constitutifs des structures de coopération (délibérations concordantes, dans les cas des syndicats interhospitaliers, ou conventions constitutives dans les cas de groupements de coopération sanitaire).
En revanche, dès lors qu'un syndicat interhospitalier est autorisé à exercer les missions d'un établissement de santé en vertu de l'article L. 6132-2 du code de la santé publique modifié par l'article 49 de la loi n°99-641 du 27 juillet 1999 portant création d'une couverture maladie universelle, ce syndicat doit être considéré, bien qu'il ne soit pas un établissement de santé, comme directement assujetti aux obligations prévues à l'article L. 6111-1. Un tel syndicat doit donc, pour les missions de soins qu'il assure lui même, constituer un CLIN, élaborer un programme d'action, se doter d'une équipe opérationnelle d'hygiène hospitalière et de prévention des infections nosocomiales.
L'évaluation des activités de lutte contre les infections nosocomiales mises en oeuvre dans les établissements de santé sera réalisée, au niveau régional et national, par le recueil d'indicateurs portant sur les activités et les moyens mis en place : bilans standardisés d'activité de lutte contre les infections nosocomiales, plans de contrôle de sécurité sanitaire menés par les services déconcentrés.
En outre, les contrats pluriannuels d'objectifs et de moyens conclus entre les établissements de santé et les agences régionales d'hospitalisation ainsi que le suivi de la procédure d'accréditation, fourniront des données sur l'organisation développée dans les établissements de santé.
Vous voudrez bien diffuser la présente circulaire à l'ensemble des établissements de santé de votre département et nous informer des éventuelles difficultés rencontrées à l'occasion de son application.
ANNEXE 3 : CIRCULAIRE DU 22 JANVIER 2004 qui précise le cadre légal et décrit le signalement des infections nosocomiales et l'information des patients dans les établissements de santé.
Textes de référence
à Signalement :
ð Article L. 1413-14 du Code de la santé publique.
ð Décret n° 2001-671 du 26 juillet 2001 relatif à la lutte contre les infections nosocomiales dans les établissements de santé.
ð Décret n° 99-1034 du 6 décembre 1999 relatif à l'organisation de la lutte contre les infections nosocomiales dans les établissements de santé.
ð Circulaire DGS/DHOS/E2 n° 645 du 29 décembre 2000, relative à l'organisation de la lutte contre les infections nosocomiales dans les établissements de santé.
à Information :
ð Articles L. 1111-2 et L. 1413-13 du code de la santé publique (Loi n° 2002-303 du 4 mars relative aux droits des malades et à la qualité du système de santé).
ð Recommandations pour la pratique clinique « Information des patients, recommandations destinées aux médecins », ANAES, mars 2000.
à Textes abrogés :
ð Circulaire n° 2001/383 du 30 juillet 2001 relative au signalement des infections nosocomiales et à l'information des patients en matière d'infection nosocomiale dans les établissements de santé.
ð Circulaire DGS/SD5C-DHOS/E2 2003/02 du 3 janvier 2003 relative aux modalités de signalement des infections nosocomiales dans les établissements de santé.
En application de la loi n°98-535 du 1 er juillet 1998 relative au renforcement de la veille sanitaire, le décret n°2001-671 du 26 juillet 2001 relatif à la lutte contre les infections nosocomiales décrit la nature des infections nosocomiales soumises à signalement, les conditions de recueil des informations et les modalités de leur signalement.
L'article L. 1413-14 du code de la santé publique (loi n°2002-303 du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé) pose le principe d'une déclaration par tout professionnel, hospitalier ou non, de tout événement indésirable lié à une prise en charge médicale : « tout professionnel ou établissement de santé ayant constaté ou suspecté la survenue d'un accident médical, d'une affection iatrogène, d'une infection nosocomiale ou d'un événement indésirable associé à un produit de santé doit en faire la déclaration à l'autorité administrative compétente ».
Le décret n°2001-671 du 26 juillet 2001 relatif à la lutte contre les infections nosocomiales dans les établissements de santé reste en vigueur.
La mise en place de ces mesures est particulièrement importante, et doit permettre de détecter non seulement les événements rares anormaux, mais aussi les infections non étiquetées, éventuellement liées à un germe nouveau. Un autre décret définira les modalités de déclaration des infections nosocomiales par les professionnels de santé exerçant en dehors d'un établissement de santé.
Cette circulaire a pour objet de préciser les recommandations aux établissements de santé et aux DDASS sur les critères de signalement, l'organisation interne des établissements de santé et le rôle des intervenants extérieurs dans le dispositif de signalement.
1 - Le signalement des infections nososocomiales
Prévu en complément du système de surveillance épidémiologique, le signalement des infections nosocomiales repose sur le dispositif de lutte contre les infections nosocomiales en place dans les établissements de santé et dans les cinq interrégions du territoire national (Centres de coordination de la lutte contre les infections nosocomiales (C.CLIN).
Il requiert une évaluation spécialisée de la situation par le CLIN et l'équipe opérationnelle d'hygiène (notamment praticien en hygiène) dans chaque établissement de santé et le C.CLIN de l'interrégion.
Il nécessite également l'adhésion et la participation de l'ensemble des services de soins des établissements de santé.
Les objectifs du signalement des infections nosocomiales sont :
ð alerter les autorités sanitaires (la DDASS) et les Centres interrégionaux de coordination de la lutte contre les infections nosocomiales (C.CLIN) devant un certain nombre d'événements « sentinelles », afin que la DDASS s'assure de la réalisation d'investigations à la recherche de l'origine de l'infection et, le cas échéant, de la mise en oeuvre des mesures correctives nécessaires ;
ð apporter une aide si besoin aux établissements pour l'investigation, l'évaluation du risque, la maîtrise des épisodes infectieux et les modalités éventuelles d'information et de prise en charge des patients potentiellement exposés ;
ð enregistrer, suivre et analyser l'évolution d'événements pouvant conduire l'Institut de veille sanitaire (InVS) à alerter à tout moment sur un risque infectieux concernant tous les établissements de santé et à proposer des mesures ou à suggérer la diffusion de recommandations nationales, au ministère chargé de la santé.
Une première évaluation du dispositif de signalement défini par la circulaire n° 383 du 30 juillet 2001 a été réalisée entre le 15 octobre 2001 et le 1er février 2002 auprès d'un échantillon d'établissements volontaires, de l'ensemble des DDASS et des C.CLIN, afin de décrire les modalités d'organisation à l'échelon des établissements, et des différents intervenants extérieurs et d'évaluer la fiche de signalement. Cette première évaluation et d'autres travaux menés dans le cadre du RAISIN montrent une certaine discordance entre le nombre de signalements reçus par les C.CLIN, les DDASS et l'InVS. Aussi, il est d'ores et déjà nécessaire de souligner l'importance de respecter, strictement et sans délai, les circuits du signalement qui sont rappelés ci-après.
D'autre part, lors de la séance du 3 décembre 2002, le Comité technique national des infections nosocomiales a adopté la synthèse de son groupe de travail portant sur les principes et les critères de signalement prévus dans le décret du 26 juillet 2001. Ce document de recommandations (fiche 1) rappelle les objectifs du dispositif et constitue un texte de référence pour l'aide à la décision du signalement des infections nosocomiales par les établissements de santé.
Suite à ces travaux, plusieurs fiches utiles à la mise en oeuvre du signalement des infections nosocomiales ont été rédigées : la fiche de signalement à utiliser à partir de 2003 (fiche 2) ; des recommandations pour l'organisation du signalement dans les établissements de santé (fiche 3) ; la définition des responsabilités et rôles respectifs des intervenants extérieurs à l'établissement (fiche 4) ; l'organisation et l'articulation des DDASS, des C.CLIN et de l'InVS (fiche 5).
2 -L'information des patients
La loi n°2002-303 du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé donne un nouveau cadre à l'information des patients en ce qui concerne les infections nosocomiales.
Ainsi, l'article L. 1111-2 du code de la santé publique pose les fondements légaux de l'information des patients engagés dans un processus de soins, de diagnostic ou de prévention.
L'information de la personne malade sur les infections nosocomiales doit être mise en oeuvre à différentes étapes au cours des soins :
A - À l'entrée dans l'établissement de santé : information générale dans le livret d'accueil.
b - En cours d'hospitalisation et en fonction du niveau de risque des soins dispensés, une information spécifique sera fournie chaque fois que l'état de santé et les caractéristiques individuelles du patient le permettent, lors d'un entretien individuel avec le médecin en charge du patient.
c - Lorsqu'une personne a contracté une infection nosocomiale, le médecin en charge de cette personne doit l'en informer dans le respect du code de déontologie. La nature de l'information et les modalités de sa délivrance figurent dans le dossier médical de la personne, ainsi que, le cas échéant, la copie de la fiche de signalement (lorsque le signalement concerne le cas de plusieurs personnes, une copie de la fiche de signalement doit figurer dans le dossier médical de chacune de ces personnes).
d - Lorsque plusieurs personnes ont été exposées au même risque infectieux, une information rétrospective est nécessaire. Les praticiens concernés déterminent, en liaison avec la direction de l'établissement, le CLIN et l'équipe opérationnelle d'hygiène, la stratégie d'information et, le cas échéant, de suivi des patients, qui sera mise en oeuvre par l'établissement. Ils s'appuient, selon les besoins, sur l'aide du C.CLIN, de la DDASS ou de l'InVS. Cette stratégie concerne autant les patients encore hospitalisés que les patients ayant quitté l'établissement. La procédure d'information et de suivi adoptée doit être écrite, notamment pour assurer la traçabilité de sa mise en oeuvre. Cette information devra être mentionnée dans le dossier médical.
RECOMMANDATIONS DU COMITÉ TECHNIQUE NATIONAL DES INFECTIONS NOSOCOMIALES POUR LE SIGNALEMENT DES INFECTIONS NOSOCOMIALES adoptées le 3 décembre 2002 et complétées le 15 novembre 2003
L'objet de ce document est d'apporter des précisions techniques pour aider les établissements de santé à mettre en oeuvre le signalement externe des infections nosocomiales, conformément au décret du 26 juillet 2001.
A - Le contexte
Le signalement externe des infections nosocomiales institué par le décret du 26 juillet 2001, s'intègre dans un dispositif général de vigilance et de surveillance des infections, qui comprend :
La surveillance locale des infections nosocomiales menée dans chaque hôpital d'après les recommandations nationales (100 recommandations pour la prévention et la surveillance des infections nosocomiales, CTIN, 1999).
La surveillance régionale et interrégionale des infections nosocomiales qui repose sur les réseaux coordonnés par les C. CLIN et leurs antennes régionales.
La surveillance nationale coordonnée par les C. CLIN en partenariat avec le CTIN et l'invs, dans le cadre du RAISIN (réseau d'alerte, d'investigation et de surveillance des infections nosocomiales) : infections du site opératoire, accidents d'exposition au sang, bactéries multirésistantes, bactériémies, infections en réanimation.
Les systèmes de vigilances liées aux produits de santé (pharmacovigilance, hémovigilance, matériovigilance, biovigilance ...).
La notification et le signalement obligatoire de certaines maladies infectieuses (articles R. 11-2 et R. 11-3 du code de la santé publique et articles D. 11-1 et D. 11-2 comprenant les listes des maladies concernées).
Places respectives du signalement et des programmes de surveillance
Le signalement (interne et externe) des infections nosocomiales doit faciliter l'alerte et l'identification de dysfonctionnements, comme c'est le cas pour les autres vigilances. Il repose sur l'identification d'événements particulièrement significatifs ou « sentinelles » qui jouent un rôle d'alerte et, après analyse, permettent de proposer des mesures correctives locales ou générales, visant à améliorer le niveau de sécurité sanitaire.
Le signalement interne permet aux responsables et professionnels de l'établissement de prendre connaissance d'évènements qui, même si leurs caractéristiques ne justifient pas leur signalement aux autorités sanitaires, ont une grande importance locale. L'analyse de ces évènements peut déboucher sur des actions d'amélioration de la structure, de l'entretien des locaux, des pratiques de soins, de désinfection et de stérilisation.
Le signalement externe permet d'alerter les autorités sanitaires (DDASS) et le C.CLIN sur des événements « sentinelles » et également, d'offrir aux établissements de santé la possibilité de demander une aide extérieure.
Ce signalement externe peut :
Après un enregistrement et une analyse par le C.CLIN, conduire à une aide ou une intervention extérieure.
Après une analyse nationale par l'invs, conduire à proposer des mesures de prévention ou des recommandations générales.
Parmi les événements signalés au sein de l'établissement, ceux qui répondent aux critères d'alerte décrits ci-dessous doivent être signalés aux autorités sanitaires.
Il s'agit d'évènements « rares ou particuliers » dont les caractéristiques justifient une intervention et une investigation locale, si besoin par des structures extérieures à l'établissement, mais dont la portée informative va bien au-delà de l'établissement concerné. Comme le précise le décret, c'est le praticien en hygiène qui, au vu des différents éléments, analyse les événements portés à sa connaissance et juge de la pertinence du signalement externe (en fonction du nombre de cas, de la gravité des cas, des sites concernés, des agents pathogènes impliqué(s), des caractéristiques épidémiologiques, etc.). Le présent document ne constitue donc pas une liste univoque d'évènements à signaler, mais un document qui, à travers des exemples, développe les différents critères du décret.
Le signalement se distingue des programmes de surveillance des infections nosocomiales mis en place dans l'établissement qui sont la base de l'évaluation de la qualité des actes médico-techniques. Ces programmes sont basés sur les recommandations nationales, qui comportent toujours un volet de prévention (ex. : protocoles pour les actes à risque, maîtrise technique de l'environnement, prévention de la transmission croisée des bactéries multirésistantes (BMR)...) et un volet de surveillance. La surveillance consiste en un recueil régulier et systématique d'informations, non seulement sur les cas d'infections (numérateur) mais aussi sur l'ensemble des personnes exposées au risque (dénominateur) afin de dégager des indicateurs pertinents sous forme de taux, par exemple : taux d'incidence des infections du site opératoire sur prothèse chez les patients sans facteurs de risques particuliers (indice NNIS24 ( * ) : 0), taux d'incidence des infections sur cathéter pour 1000 journées de cathétérisme vasculaire, taux d'incidence des staphylocoques dorés multirésistants (SARM) pour 1000 journées d'hospitalisation ...
Les programmes de surveillance ont pour but de mesurer l'efficacité des activités de prévention des infections nosocomiales dans nos établissements de santé et de permettre une analyse évolutive et des comparaisons intra et inter-établissements.
En conclusion, signalement et surveillance sont deux approches complémentaires. Elles ne peuvent se substituer l'une à l'autre et doivent donc être menées de front.
B - En pratique : que signaler aux autorités sanitaires ?
Les définitions des infections nosocomiales à signaler aux autorités sanitaires et au C.CLIN telles qu'énumérées dans le décret sont très générales. Elles reposent sur le caractère « rare ou particulier » ou la notion d'un risque spécifique identifié par l'analyse de signalements internes (ou la surveillance régulière). En conséquence, le caractère opérationnel de ces définitions dépend :
ð de la mise en place d'une procédure de signalement interne permettant de porter à la connaissance du praticien en hygiène les évènements susceptibles de faire l'objet d'un signalement externe.
ð du niveau de formation des acteurs impliqués et surtout de leur connaissance de l'épidémiologie locale, régionale et générale des infections nosocomiales.
C'est pourquoi le présent document donne, sous la forme d'exemples commentés pour chacune des rubriques du décret, des informations complémentaires qui devraient aider les équipes hospitalières dans la mise en place du signalement externe.
Remarques générales
Seules les infections, et non les colonisations (cf. Définition dans le document «100 recommandations pour la surveillance et la prévention des infections nosocomiales », Comité technique national des infections nosocomiales, Ministère de l'emploi et de la solidarité, 2ème édition 1999) doivent faire l'objet de signalement externe.
Cependant, afin "d'alerter les autorités sanitaires et les C. CLIN lorsque des risques de transmission à des tiers, d'apparition ou de diffusion de cas semblables existent", il est conseillé, pour le critère "agent pathogène de résistance inhabituelle aux antibiotiques", et plus précisément pour une résistance non encore décrite, de procéder au signalement externe même lorsque l'agent pathogène est identifié dans une situation de colonisation. C'est aussi le cas des épidémies, qui doivent donner lieu à signalement, même si leur gestion ne requiert pas nécessairement un appui extérieur.
Les infections nosocomiales survenant chez les professionnels de santé sont concernées, si elles répondent à un des critères du décret.
Les termes "rare" ou "particulier" sont utilisés dans le décret. Cela fait référence à une rareté pour l'établissement de santé (rareté « relative ») ou pour les établissements de manière générale (rareté « absolue »).
1) Infections nosocomiales ayant un caractère rare ou particulier
1a) Nature et caractéristiques de l'agent pathogène
ESPÈCE RARE :
ð Espèces à Gram négatif saprophytes, (ex. : Pseudomonas autres que P. aeruginosa, Burkholderia autres que B. cepacia... )
ð Espèces à Gram positif saprophytes (ex: Bacillus cereus , Rhodococcus spp.,., mycobactéries atypiques comme M. chelonae, M. fortuitum, M. xenopi..., Clostridium perfringens...)
ð Champignons autres que C. albicans (sauf dans les urines où les champignons de type levures ne sont pas rares).
ð Parasites.
ð Espèces pathogènes strictes habituellement responsables d'infections communautaires, en général contagieuses, mais rarement responsables d'infections nosocomiales (ex. : méningocoque, streptocoque A , Mycobacterium tuberculosis, Salmonella spp., Shigella spp., VHB, VHC, HIV...
AGENT DE CARACTÉRISTIQUE RARE OU PARTICULIÈRE (EN DEHORS DE LA RÉSISTANCE) :
Il s'agit d'espèces ou de genres habituels mais dont la souche ou le type en cause a des caractéristiques inhabituelles (ex : souches de Staphylococcus aureus productrice de toxine, en cause dans un syndrome de choc toxique ou une infection cutanée bulleuse ; souches de virulence particulière ayant fait l'objet d'une information par un Centre national de référence (CNR)... ).
L'agent du SRAS, qui appartient au genre Coronavirus, en principe peu fréquemment rencontrée en pathologie humaine, entre dans cette catégorie. Le 14 août 2003, l'OMS a émis des recommandations pour déclencher une alerte au SRAS 25 ( * ) . En France, ces recommandations ont été transcrites et précisées par l'Institut de veille sanitaire 26 ( * ) et la Direction générale de la santé 27 ( * ) . Elles envisagent, pour ce qui concerne la survenue de cas nosocomiaux, les situations d'alerte suivantes :
1°- « la survenue, dans un délai de 10 jours, de 2 cas ou plus de pneumopathie aiguë atypique sévère (PAAS) parmi des personnels soignants, ou non, d'un même service hospitalier, ou parmi des malades ou des visiteurs de ce même service. La PAAS est définie comme une fièvre >38°C accompagnée de signes d'atteinte respiratoire basse (toux, dyspnée, gêne respiratoire,...) et une radiographie pulmonaire montrant des infiltrats interstitiels uni ou bilatéraux, localisés ou diffus, chez une personne hospitalisée »
2°- « une fièvre >38°C associée à des signes d'atteintes respiratoire basse (toux, dyspnée, etc.) ET une personne travaillant, ou ayant travaillé dans un laboratoire manipulant, ou ayant manipulé, du coronavirus du SRAS [...] »
AGENT AYANT UNE RÉSISTANCE AUX ANTIBIOTIQUES RARE OU PARTICULIÈRE :
Il s'agit de résistance non décrite dans la littérature, ou bien de résistance décrite mais encore très rare dans l'établissement ou dans les établissements de manière générale.
En cas de signalement d'une résistance non encore décrite ou très rare, les CNR sont impliqués dans l'expertise microbiologique.
Exemples de résistances rares en France : entérocoques résistants aux glycopeptides (VRE), souches de Staphylococcus aureus intermédiaires ou résistantes à au moins l'un des glycopeptides (GISA), entérobactéries résistantes à l'imipénème...
1b) Localisation rare ou particulière :
Infection consécutive à un geste invasif (ex. : intervention sur un site a priori stérile, pose d'un dispositif intravasculaire) et inhabituelle et grave sur le plan fonctionnel ou vital (ex. : infection du segment postérieur de l'oeil, fasciite nécrosante, endocardite...).
1c) L'utilisation d'un dispositif médical :
Infection succédant à l'utilisation d'un dispositif médical suspect d'avoir été préalablement contaminé, du fait d'un défaut de conception ou de fabrication, par exemple, d'un générateur de dialyse, d'un endoscope, d'un phacoémulsificateur... On note ici le lien avec la matériovigilance.
1d) Procédures ou pratiques pouvant exposer ou avoir exposé d'autres personnes :
ð Infection succédant à une procédure inadaptée ou défaillante, par exemple procédure insuffisante de préparation du site opératoire.
ð Infection succédant à l'utilisation d'un dispositif médical suspect d'avoir été préalablement contaminé du fait d'une procédure manifestement inadaptée,
Par exemple : infection succédant à une endoscopie, causée par un agent pathogène dont la nature fait craindre une défaillance des procédures de désinfection (exemple : mycobactéries, virus des hépatites) ou du fait qu'il peut être un contaminant des solutions de désinfection ou de rinçage (exemples : P. aeruginosa, S. maltophilia, B. cepacia, autres espèces à Gram négatif saprophytes et non fermentantes, voir supra) ; infection succédant à l'utilisation par plusieurs patients diabétiques d'un même lecteur de glycémie ...
ð Infection succédant à l'utilisation d'un produit de santé suspect d'avoir été préalablement contaminé du fait de manipulations incorrectes, par exemple méningite bactérienne après anesthésie péridurale, bactériémies après injection d'une solution de perfusion contaminée ou d'un produit sanguin contaminé, péritonite après dialyse péritonéale avec une solution de dialyse contaminée...
On note ici la similitude avec la matériovigilance, la pharmacovigilance, l'hémovigilance, la biovigilance, la réactovigilance : type d'enquête, importance de la traçabilité, procédures d'information et de surveillance des patients...
N.B. : dans le critère 1d ce sont les procédures ou pratiques qui sont a priori suspectées d'avoir causé l'événement, alors que dans le critère 1c ce sont la conception ou la fabrication d'un dispositif médical qui sont suspectées. S'il y a un doute entre les deux, ou que l'origine des cas n'est pas encore établie, cocher 1c et 1d.
Remarques :
En soi, la rareté (le caractère inhabituel) du microorganisme justifie le signalement interne, mais peut ne pas être un argument suffisant pour justifier un signalement externe. En effet, certains agents pathogènes sont très rares mais n'ont aucune signification particulière. Le caractère inhabituel doit être mis en perspective avec d'autres critères (nombre de cas, localisation, lien avec des procédures...) cités dans le décret.
Par exemple :
ð La survenue d'un seul cas d'infection, quelle que soit la localisation, est suffisant en cas de résistance aux antibiotiques non encore décrite, dont le caractère d'alerte collective est évident, ou lorsque l'espèce est un pathogène responsable d'infections communautaires contagieuses (M. tuberculosis, VHB, VHC ...)
ð La survenue d'un seul cas d'infection causée par une espèce rare et concernant un site habituellement stérile après une manoeuvre invasive (ex : infection du site opératoire, méningite ...) est suffisante pour certaines espèces dont la nature suggère un problème particulier : streptocoque A, C.perfringens, mycobactérie atypique...
ð La survenue de cas groupés d'infections causées par une espèce bactérienne saprophyte rare, des champignons ou des parasites, des bactéries de résistance aux antibiotiques très rares dans l'établissement, ou de souches de virulence particulière indique le signalement externe car elle suggère un début d'épidémie.
ð La survenue de cas groupés d'infection succédant à une procédure médico-chirurgicale utilisant du matériel médical réutilisable ou un produit industriel et causée par une espèce saprophyte rare (cf ci-dessus) peut faire craindre un défaut dans les procédures de désinfection, stérilisation ou production. La convergence de plusieurs signalements de même nature provenant de différents établissements peut jouer un rôle décisif dans l'identification de ces défauts au niveau national (lien avec la matériovigilance et la pharmacovigilance)
2) Décès lié à une infection nosocomiale.
La difficulté est d'établir le lien entre l'infection nosocomiale et le décès. La procédure pour établir le lien de causalité pourrait être l'examen des dossiers suspects par un groupe constitué au moins par le médecin en charge du malade, son chef de service, le médecin hygiéniste, l'anatomopathologiste s'il y a eu autopsie. Le groupe remettra ses conclusions.
3) Infections nosocomiales suspectes d'être causées par un germe présent dans l'eau ou l'air.
Les deux exemples les plus évidents sont la légionellose et l'aspergillose.
Il faut aussi y penser en cas d'infection à bactéries ou champignons saprophytes lorsque l'histoire de l'infection n'évoque pas une transmission croisée. Il s'agit, par exemple, de cas d'infections du site opératoire ou de bactériémies à bacille à Gram négatif saprophyte rare (voir supra), à Bacillus cereus, à mycobactérie atypique.
4) Maladies devant faire l'objet d'une transmission obligatoire de données individuelles, lorsque l'origine nosocomiale peut être suspectée.
Se reporter à la liste officielle de ces infections (article R 11-2 en annexe).
Les infections les plus susceptibles de pouvoir être d'origine nosocomiale sont les légionelloses et les toxi infections alimentaires collectives. La question peut se poser aussi pour l'hépatite B aiguë symptomatique et la tuberculose. Les autres infections à notification obligatoire (listériose, fièvre typhoïde, ESST...) ne sont d'origine nosocomiale que dans des situations très exceptionnelles.
Remarque
Toutes les situations épidémiques nouvelles (cas groupés dans le temps ou l'espace) font l'objet d'un signalement externe, dans la rubrique la plus adaptée : 1a si l'agent pathogène rare ou particulier, 1b si la localisation est particulière, 1c si un dispositif médical défectueux est en cause, 1d si une procédure ou pratique est en cause... L'événement peut être signalé sous plusieurs rubriques (ex. 1a et 1c).
FICHE 2 : FICHE DE SIGNALEMENT DES INFECTIONS NOSOCOMIALES, à utiliser à partir du 1 er janvier 2003
Cette fiche n'a pas subi de modification par rapport à la fiche diffusée dans la circulaire n°2 du 3 janvier 2003.
Fiche de signalement des Infections Nosocomiales
à transmettre sans délai à la DDASS et au CCLIN
Rappel : Selon le décret n° 2001-671 du 26 juillet 2001, certains cas d'infections nosocomiales doivent être signalés conjointement à la DDASS et au C.CLIN de votre inter-région (article R. 711-1-14). L'épisode qui doit être signalé peut être constitué de plusieurs cas d'infections nosocomiales, notamment lorsque les caractéristiques ou modalités de survenue du ou des premiers cas ne permettent pas d'emblée de répondre aux critères énoncés ci-dessous.
|
Etablissement : .................................................. Code FINESS (obligatoire) : |__|__|__|__|__|__|__|__|__| Adresse : ............................................................ .......................................................................... .......................................................................... Code postal : |__|__|__|__|__| Ville : ............................................................... Statut : Public Privé PSPH Type : CHU CH H. Local Psy MCO SSR SLD Mil CLCC HAD Autre
Personne responsable du
signalement :
Nom : ............................................................... Fonction : ......................................................... Tel : |__|__|__|__|__|__|__|__|__|__| Fax : |__|__|__|__|__|__|__|__|__|__| E-mail : ............................................................ Praticien en hygiène ou autre personne contact : Nom : ............................................................... Fonction : ......................................................... Tel : |__|__|__|__|__|__|__|__|__|__| Fax : |__|__|__|__|__|__|__|__|__|__| E-mail : ............................................................ |
|
Evènement n° |__|__|__|__|__|__|__| (1) Nombre de cas : |__|__|__| Dont décédés : |__|__| Date de début du 1er cas : |__|__|__|__|__|__|__|__| Si plusieurs cas, date du dernier cas connu : |__|__|__|__|__|__|__|__| Cet épisode se rapporte-t-il à un épisode déjà signalé ? Oui Date : |__|__|__|__|__|__|__|__| Non (1) : X AAAA, où X est le Xième évènement signalé par l'établissement depuis le début de l'année et AAAA l'année. |
MOTIFS DE SIGNALEMENT (À COCHER OBLIGATOIREMENT, UNE OU PLUSIEURS CASES) :
|
1.Infection nosocomiale ayant un caractère rare ou particulier du fait : 1.a. De l'agent pathogène en cause (nature, caractéristiques, ou profil de résistance) Agent pathogène envoyé au CNR Oui Date : |__|__|__|__|__|__|__|__| Non 1.b. De la localisation de l'infection 1.c. De l'utilisation d'un dispositif médical (DM), lequel : ....................................................................
1.d. De procédures ou pratiques
pouvant exposer ou avoir exposé d'autres personnes au même
risque
2. Décès lié à une infection nosocomiale 3. Infection nosocomiale suspecte d'être causée par un germe présent dans l'eau ou dans l'air environnant 4. Maladie devant faire l'objet d'une Déclaration Obligatoire et dont l'origine nosocomiale peut être suspectée D.O. faite pour cette maladie : Oui Date : |__|__|__|__|__|__|__|__| Non Autre, précisez : ............................................................................................................................ Lien avec les vigilances : déclaration faite pour ce cas Oui NonSi oui, précisez type et date pharmaco- hémo- bio- matério-vigilance Date : |__|__|__|__|__|__|__|__| Justification des critères de signalement, description de l'évènement (éléments de gravité, potentiel épidémique, caractère exceptionnel, n° de fiche vigilance éventuel, etc.) : Description de l'évènement (joindre les documents établis par l'établissement rendus anonymes) : Epidémie ou cas groupés : Oui, précisez .............................................................................. Non Caractère nosocomial : Certain Probable Origine du (des) cas : Acquis dans l'établissement Importé(s) Autre(s) établissement(s) concerné(s) : Oui, le (s)quel(s) ............................................................... ........................................................................................................................ Non Ne sait pas Service(s ) ou unité(s) concerné(s) : ....................................................................................................... ......................................................................................................................................................... Microorganisme(s) en cause : ............................................................................................................ Profil de résistance ( joindre l'antibiogramme ) : ................................................................................... ......................................................................................................................................................... Site(s) anatomique(s) de l'infection : .................................................................................................... .........................................................................................................................................................
Investigations réalisées à la date
du signalement
Précisez : .................................................................................................................................... |
|
Hypothèse sur la cause de l'infection : Oui Non Précisez : ....................................................................................................................................... ......................................................................................................................................................... ......................................................................................................................................................... Mesures correctives : (joindre les documents établis par l'établissement rendus anonymes) Prises à la date de signalement Oui Non Sans objet A prévoir à long terme : Oui Non Ne sait pas Sans objet Précisez : ...................................................................................................................................... ......................................................................................................................................................... ......................................................................................................................................................... Besoin d'expertise extérieure : Oui Non Précisez : ..................................................................................................................................... ......................................................................................................................................................... Pensez-vous que l'événement soit maîtrisé : Oui Non Précisez : ...................................................................................................................................... ......................................................................................................................................................... Commentaires du praticien en hygiène : ......................................................................................................................................................... .................................................................................................................................................................................................................................................................................................................. |
Fait à : ............................... le : |__|__|__|__|__|__|__|__| Signature :..................................................
A RETOURNER SANS DÉLAI À LA DDASS ET AU CCLIN
PROPOSITIONS D'ORGANISATION DANS LES ETABLISSEMENTS DE SANTE
L'étude pilote conduite dans un échantillon d'établissements volontaires met en évidence l'importance de la mise en place, au sein de l'établissement, d'un dispositif qui doit être adapté à l'organisation et aux ressources de l'établissement.
1- Les étapes importantes de la mise en place par le CLIN du dispositif de signalement dans un établissement de santé
1.1- Mise en place d'une procédure de signalement interne des infections nosocomiales :
Pour détecter les événements pouvant relever d'un signalement externe, il est important que l'équipe opérationnelle d'hygiène soit informée de façon pertinente par les différents services de soins et/ou services médico-techniques de l'établissement des cas d'infections nosocomiales. A cette fin, les éléments suivants doivent être pris en considération :
ð L'information préalable des instances sur la procédure de signalement est impérative : commission médicale d'établissement (CME) ou conférence médicale, commission du service de soins infirmiers.
ð La formation des professionnels est un enjeu majeur : c'est l'occasion de constituer ou renforcer un réseau de correspondants en hygiène, notamment médicaux, dans les services de soins. Par ailleurs, les médecins titulaires et en formation, les cadres de santé, les biologistes, les paramédicaux, les pharmaciens et sages-femmes, qui sont tous en principe susceptibles de signaler en interne, devraient, au minimum, bénéficier d'une information.
ð Il est possible de mettre en place dans l'établissement divers types d'outils nécessaires ou pouvant faciliter le recueil de l'information : fiche de signalement interne pouvant préciser les critères de signalement, liste explicative des critères de signalement ou fiche d'événements indésirables dans le cadre d'une démarche globale de gestion des risques, etc.
ð L'organisation d'un contrôle de qualité du signalement interne, par l'EOH ou les correspondants en hygiène par exemple, peut permettre d'améliorer la motivation des professionnels des services et la pertinence des signalements internes transmis à l'équipe opérationnelle d'hygiène hospitalière.
ð La gestion de la confidentialité relative aux patients devra impérativement être assurée et ses modalités définies au préalable.
1.2- Articulation avec les structures de gestion des risques ou d'autres systèmes de recueil d'information :
Les établissements peuvent mettre en place des circuits d'information communs ou partagés dans le cadre d'une démarche coordonnée des activités transversales, telles que la gestion des risques, les vigilances, l'évaluation ou la qualité des pratiques. En l'absence d'une telle démarche, l'information réciproque des correspondants locaux de matériovigilance, d'hémovigilance, du pharmacien et du praticien en hygiène sera encouragée, en cas de signalements d'infections nosocomiales impliquant un produit de santé, ou bien si des signalements d'incidents de matériovigilance, hémovigilance, pharmacovigilance, biovigilance ou réactovigilance sont suceptibles d'avoir des conséquences d'ordre infectieux.
De même, l'organisation d'une information systématique de l'EOH pour toute déclaration de maladie faisant l'objet d'une transmission obligatoire de données individuelles à l'autorité sanitaire, pourrait faciliter la détection des cas d'origine nosocomiale. Toutefois, l'information transmise doit être anonyme et les fiches de notification ne doivent en aucun cas être communiquées à l'EOH.
1.3- Protocole de mise en place d'une cellule de coordination ou d'une cellule de crise en prévision d'événement majeur :
Lorsqu'un événement signalé nécessite une évaluation de ses conséquences (estimation de la population exposée au risque infectieux) ou/et une réorganisation temporaire ou permanente de la prise en charge des patients (réaménagement des locaux, report ou annulation de soins programmés, changement d'équipement, de stock de matériel ou de médicament ...), la situation doit être examinée dans le cadre d'une cellule multidisciplinaire associant les instances décisionnaires de l'établissement.
Cette cellule comprend :
ð Au minimum le praticien en hygiène et le médecin responsable du service et/ou le médecin responsable du patient,
ð Le président du CLIN
ð L'équipe opérationnelle d'hygiène hospitalière
ð Le directeur de l'établissement
ð Le président de la CME ou de la conférence médicale
ð En cas d'infection nosocomiale impliquant un dispositif médical, un produit d'origine sanguine ou un médicament, le correspondant local de matériovigilance, le correspondant local d'hémovigilance ou le pharmacien
ð Le cadre de santé du service ou du secteur d'activité en charge du patient
ð Le cas échéant le responsable qualité ou gestion des risques
ð Le cas échéant, le (micro)biologiste et le médecin du travail
1.4- Retour d'information dans les services de soins et vis-à-vis des instances
L'adhésion et la participation de l'ensemble des professionnels de l'établissement nécessitent que le CLIN et l'équipe opérationnelle d'hygiène organisent un retour d'information systématique sur le dispositif et les événements signalés vis-à-vis des instances et de chacun des services de l'établissement.
Ce retour d'information doit être constitué de données agrégées et assurer la confidentialité vis-à-vis de chaque service. Les services disposeront par ailleurs d'un retour sur leurs propres signalements au cas par cas.
Ce retour d'information pourra porter sur :
ð le nombre et la nature des signalements transmis à la DDASS et au CCLIN
ð la nature des investigations menées et leurs principaux résultats
ð les mesures prises à l'issue des investigations
ð les éventuelles mesures prévues à plus long terme
Le retour d'information pourra se faire par le biais du rapport annuel des activités de lutte contre les infections nosocomiales, de présentation à la conférence médicale d'établissement ou la conférence médicale, ainsi qu'à la commission du service de soins infirmiers, de présentations ouvertes à tous, de publication interne ou d'affichage ...
D'autre part, afin d'améliorer la motivation et la qualité de la participation des professionnels des services au dispositif, il est primordial que ceux-ci soient informés en retour par le praticien en hygiène du devenir de leurs signalements internes (information en temps réel, rendu périodique global ou par service ...)
2- La décision de signaler un épisode à la DDASS et au C.CLIN
2-1. Critères de signalement externe : Grille de lecture (cf. fiche 1 : recommandations du CTIN)
2-2. Validation du praticien en hygiène
Selon les principes énoncés dans le décret du 26 juillet 2001, c'est le praticien en hygiène qui produit l'expertise spécialisée nécessaire à la validation des critères de signalement externe. Cependant, en cas d'absence temporaire de praticien en hygiène, il est important que le CLIN désigne une ou plusieurs personnes chargées de valider les critères de signalement.
2-3. Signalement écrit
ð Selon l'article R. 711-1-14-1 du code de la santé publique, un professionnel de santé chargé du signalement et un suppléant sont désignés par le responsable de l'établissement après avis du CLIN. Ce responsable du signalement peut être un professionnel différent du praticien en hygiène : président du CLIN, responsable d'une autre vigilance, responsable qualité, gestionnaire de risque ... en fonction de l'organisation propre à l'établissement de santé. En aucun cas cependant, il ne peut procéder au signalement d'un épisode d'infection nosocomiale sans la validation des critères par le praticien en hygiène.
ð L'envoi de la fiche à la DDASS et au C.CLIN doit être réalisé sans délai dès lors qu'au moins un des critères de signalement externe est rempli. La fiche est remplie au jour du signalement, avec les éléments disponibles ce même jour.
ð Les documents relatifs aux investigations ou aux cas seront joints ultérieurement et ne doivent pas retarder l'envoi de la fiche à la DDASS et au C.CLIN. Il est toutefois utile de joindre à la fiche un document décrivant les investigations ou travaux en cours ou prévus.
ð Il est important d'envoyer simultanément la fiche à ces deux structures, en raison de leurs rôles respectifs complémentaires (cf fiche 4).
ð Enfin, le responsable du signalement doit informer le responsable de l'établissement, le médecin responsable du service ou des patients concernés et le président du CLIN dès lors que le signalement est envoyé.
3- Investigations, mesures correctrices
L'équipe opérationnelle d'hygiène de l'établissement est responsable de l'investigation de l'épisode signalé afin d'identifier et mettre en oeuvre des mesures correctives adaptées. Selon ses ressources et son degré d'expertise, elle peut, avec le signalement, faire appel à une aide extérieure (C.CLIN, DDASS, InVS, autres experts).
La prise en charge d'un épisode signalé suit plusieurs étapes, qui peuvent être résumées de la manière suivante. Les étapes listées ci-dessous et leur ordre sont donnés à titre indicatif ; certaines peuvent être un préalable au signalement :
ð définition des rôles de chacun (investigation, communication, etc.) ;
ð si nécessaire, mise en place d'une cellule de crise ;
ð confirmation du diagnostic, définition, identification, et dénombrement des cas ; description en termes de temps, lieu et caractéristiques des patients (réalisation d'un tableau synoptique, d'une courbe épidémique, d'un schéma topographique) ;
ð mise en place immédiate de mesures correctives générales (exemple : hygiène des mains, isolement, précautions standard, etc.) ; elles seront complétées ultérieurement par des mesures spécifiques selon les résultats de l'investigation ;
ð si nécessaire, audit des pratiques ;
ð identification du (des) facteur(s) de risque lié(s) à l'épisode signalé : élaboration des hypothèses pouvant expliquer l'épisode, à confirmer le cas échéant par une enquête épidémiologique analytique (étude cas-témoin ou de cohorte rétrospective). Les résultats de cette enquête sont à corroborer aux données du laboratoire de microbiologie et aux conclusions de l'audit des pratiques ;
ð rédaction d'un rapport résumant l'investigation, comparant ses résultats aux données de la littérature et de l'épidémiologie locale et fournissant des recommandations pour le contrôle et la prévention de l'épisode ; communication de ce rapport en interne (personnels du service, CME, CLIN, ...) et en externe (C.CLIN, DDASS, InVS et autres partenaires éventuels) ;
ð si nécessaire, identification et information des autres patients exposés au même risque ;
ð mise en oeuvre des mesures correctives : à court terme, consécutives à l'hypothèse retenue initialement ; à plus long terme, selon les résultats définitifs de l'investigation (formation des personnels, équipement, travaux...) ;
ð suivi, évaluation et adaptation éventuelle des mesures correctives : notamment par la mise en place d'une surveillance adaptée, et le signalement immédiat de tout nouveau cas relié à l'épisode initial.
N.B. : le rôle de chaque intervenant dans l'implémentation de ces différentes étapes n'est pas précisé ici car variable selon les épisodes et spécifié dans d'autres parties de la circulaire.
4- Cas particulier des infections nosocomiales importées
Par principe, le signalement devra être systématiquement réalisé par l'établissement dans lequel le ou les cas d'infections nosocomiales sont constatés, auprès de la DDASS de son département et du C.CLIN de son interrégion. Si l'établissement de santé présumé à l'origine du cas (établissement de santé source) est connu, le responsable du signalement de cet établissement sera informé de cette infection et de son signalement par le responsable du signalement de l'établissement ayant constaté le ou les cas. La DDASS ayant reçu le signalement transmet la copie de la fiche à la DDASS du siège de l'établissement de santé source afin que celle-ci coordonne le dossier. Si l'établissement de santé présumé à l'origine du cas est inconnu, il appartient à la DDASS destinataire du signalement d'impulser les investigations nécessaires à sa recherche.
SIGNALEMENT
Constatation / Suspicion
d'un cas à signaler
Validation des critères de signalement
Communication
Information patients
ETABLISSEMENT DE SANTE
Tout soignant 1
PRATICIEN EN HYGIÈNE
Médecins en charge
du patient
Investigations
- Constitution cellule de crise
- Mesures correctrices
Responsable
du signalement
- Médecins responsables
du service et du patient
- Président du CLIN
- Praticien de l'EOH
- Responsable légal de l'établissement
Information
Médecins responsables du(des) service(s)
concerné(s)
DDASS
CCLIN
Contrôle
Coordination
Saisie d'expertise
Expertise
Conseil
Coopération
INVS
Analyse nationale
Expertise
DGS / DHOS
Evolution réglementaire
Recommandations nationales
Rétro - information
Aide à l'investigation
Recommandations
SCHEMA : CIRCUIT DU SIGNALEMENT
Information
1 médecin, pharmacien, biologiste, chirurgien-dentiste, sage-femme, personnel paramédical
Circuit du signalement dans l'établissement
Circuit de la fiche de signalement
Liaisons fonctionnelles
Légende
Rôles des intervenants extérieurs a l'établissement
1. Intervenants permanents
1.1. Direction départementale des affaires sanitaires et sociales
La DDASS est l'autorité sanitaire destinataire des fiches de signalement adressées par l'établissement de santé. A ce titre, elle :
ð analyse les fiches reçues, en collaboration avec le C.CLIN ;
ð saisit ses partenaires extérieurs et coordonne leurs actions quand une expertise complémentaire est nécessaire ;
ð assure les visites d'inspection et de contrôle dans les établissements ;
ð recueille les rapports d'investigation et les transmet au directeur de l'établissement ;
ð transmet les fiches de signalement à l'Institut de veille sanitaire (InVS), dans des délais compatibles avec les missions d'alerte de celui-ci.
1.2. Centre de coordination de lutte contre les infections nosocomiales
Le C.CLIN est le second échelon d'expertise spécialisée - le praticien de l'EOH étant le premier échelon dans l'établissement de santé. Destinataire de façon concomitante avec la DDASS des fiches de signalement, le C.CLIN :
ð assure une mission d'expertise et de conseil dans son domaine de compétences ;
ð à ce titre, se concerte avec la DDASS afin d'évaluer le degré d'urgence et/ou de gravité des situations décrites dans les fiches de signalement (cf. fiche 5) ;
ð aide, le cas échéant, les établissements de santé pour la gestion et l'investigation de l'épisode (audit des pratiques, investigation épidémiologique, détermination de la population exposée au risque infectieux ...) ;
ð intervient dans le cadre d'une saisie par la DDASS ou d'une demande de l'établissement ;
ð procède à la rétroinformation des établissements de santé dès lors qu'une situation à risque est susceptible de s'y reproduire.
1.3. Institut de veille sanitaire
L'InVS analyse de manière continue les évènements signalés qui lui sont transmis par les DDASS. Il les enregistre, les confronte aux autres données épidémiologiques dont il est destinataire (données de la déclaration obligatoire, données des centres nationaux de référence, rapports des autres agences sanitaires et de l'établissement français du sang, etc.) et en réalise un bilan annuel afin notamment de proposer au ministère chargé de la santé toutes mesures nécessaires.
Il facilite les échanges entre les C.CLIN.
Il a un rôle d'alerte pour les infections à caractère émergent ou pour les risques infectieux nosocomiaux impliquant plusieurs établissements de santé, des produits de santé ou des procédures communes à plusieurs établissements. Il en alerte la ou les DDASS et le ou les CCLIN correspondant(s), ainsi que le bureau des alertes de la DGS. L'InVS apporte à la demande de la DDASS, du C.CLIN ou du Ministre chargé de la santé son expertise épidémiologique pour définir toute mesure ou action appropriée en réponse à un signalement.
2. Intervenants occasionnels
2.1. Agence régionale de l'hospitalisation
Au vu des informations que lui fournit le DDASS, le directeur de l 'ARH peut mettre en oeuvre la procédure de suspension ou de retrait de l'autorisation de fonctionner de l'établissement de santé, le cas échéant, après avoir fait procéder à une inspection dans les conditions de l'article L6116-2 du code de la santé publique.
Dans ce cadre, la DDASS adresse au directeur de l'ARH les éléments nécessaires à la prise de décision.
2.2. Direction régionale des affaires sanitaires et sociales
La DRASS peut être saisie par les autorités sanitaires afin de :
ð contribuer à l'expertise, par la participation de pharmacien inspecteur régional, médecin ou pharmacien chargé du dossier des encéphalopathies spongiforme subaiguës transmissibles (ESST), ingénieur sanitaire, infirmière de santé publique ...
ð faciliter les actions des intervenants lorsque plusieurs DDASS d'une même région sont concernées.
2.3. Cellules interrégionales d'épidémiologie (CIRE)
En cas d'infections nosocomiales dont la source est communautaire, ou de possibilité d'extension de cas d'origine nosocomiale à la communauté extrahospitalière, la CIRE peut être conduite à mener, en liaison avec la ou les DDASS et l'InVS, les investigations épidémiologiques nécessaires.
2.4. Agence française de sécurité sanitaire des produits de santé
L'Afssaps a notamment en charge la pharmacovigilance, la matériovigilance, l'hémovigilance, la réactovigilance et la biovigilance. Lorsqu'un épisode signalé d'infection nosocomiale implique un produit de santé, un dispositif médical, un médicament, un réactif ou un produit d'origine humaine, l'équipe opérationnelle d'hygiène réalise des investigations, en liaison avec les correspondants locaux des vigilances ou le pharmacien selon les cas, et le cas échéant avec l'aide du C.CLIN et/ou de l'InVS, afin d'identifier une relation entre l'événement signalé et le produit de santé. Les correspondants locaux des vigilances et le pharmacien ont, pour leur part, un rôle d'expertise des matériels et des produits suspectés en lien avec les infections signalées. En ce qui la concerne, l'agence, qui a un rôle d'expertise technique vis-à-vis des produits de santé, confirme les éléments techniques à l'origine de la relation. Elle peut exercer toute action réglementaire (retrait par exemple) autour d'un produit ou d'un dispositif pour lequel une relation est identifiée ou suspectée avec la survenue des événements signalés.
2.5. Administration centrale du ministère chargé de la santé
L'intervention des services de l'administration centrale du ministère chargé de la santé n'est, en principe, pas requise, pour un signalement externe d'infection nosocomiale.
Toutefois, certaines situations, peuvent nécessiter leur intervention. Il s'agit notamment des cas suivants :
ð l'épisode met en évidence un risque nouveau ou méconnu, grave en termes de santé publique, évitable par des mesures spécifiques et susceptible d'exposer d'autres patients dans les autres établissements de santé du territoire national ;
ð l'épisode risque d'avoir un retentissement médiatique important.
Identifiées à l'occasion d'un épisode survenant dans un ou plusieurs établissements, ou par l'analyse des signalements par l'InVS ou des données des systèmes de vigilance par l'AFSSAPS, ces situations imposent l'information sans délai par les DDASS ou les agences impliquées de la Direction générale de la santé
(Numéro d'alerte : 01 40 56 57 84 et messagerie d'alerte : dgs-alerte@sante.gouv.fr , pendant les heures ouvrables).
Organisation et articulation des DDASS, des C.CLIN et de l'InVS
Chacune de ces structures organise un système de gestion des fiches afin de traiter celles-ci dès leur réception. Concernant le C.CLIN, la gestion des cas signalés, après enregistrement de la fiche par le C.CLIN, peut être déléguée à un relais régional de la lutte contre les infections nosocomiales, lorsqu'il existe.
1- Articulation entre DDASS et C.CLIN
Les DDASS et C.CLIN se transmettent mutuellement les coordonnées de leurs correspondants chargés de ce dossier, mettent en place une organisation coordonnée et prévoient des échanges réguliers d'information, en vue de :
a) Contrôler l'exhaustivité des fiches reçues par chacune des deux structures.
b) Coordonner les interventions si nécessaire :
ð En cas de demande d'intervention de l'établissement à l'une ou/et l'autre de ces structures, une articulation entre la DDASS et le C.CLIN doit être organisée.
ð En l'absence de demande de l'établissement, une intervention de la DDASS est justifiée dès lors que la situation nécessite de contrôler la mise en oeuvre de mesures permettant d'assurer la sécurité des patients.
ð Dans tous les cas : en cas de problème de sécurité des patients, de sécurité des installations, de non respect des textes réglementaires : l'intervention sera réalisée par la DDASS éventuellement aidée de la DRASS. Si une analyse des pratiques en hygiène et de l'épidémiologie de l'épisode est nécessaire : le C.CLIN interviendra si les moyens ou/et les compétences de l'équipe d'hygiène locale sont insuffisants, le cas échéant avec tout autre expert nécessaire à l'analyse de la situation.
ð Le C.CLIN ne peut intervenir de sa propre initiative, sans la demande de l'établissement de santé ou d'une autorité sanitaire (DDASS, ARH). S'il suspecte un problème mettant en jeu la sécurité des patients, il prévient la DDASS, qui décide de l'intérêt ou non d'une intervention du C.CLIN.
ð En cas d'intervention isolée de la DDASS ou du C.CLIN, un rapport sera adressé à l'autre structure.
2- Articulation entre DDASS et InVS
Les DDASS transmettent chaque fiche de signalement à l'InVS dans un délai compatible avec les objectifs de ce système d'alerte et sans attendre la fin des investigations.
3- Articulation entre C.CLIN et InVS
Les C.CLIN et l'InVS coordonnent leurs actions concernant le signalement dans le cadre du Réseau d'alerte, d'investigation et surveillance des infections nosocomiales (RAISIN) afin 1) de définir le cadre méthodologique des investigations ; 2) de détecter les alertes relevant de phénomènes récurrents ; 3) d'améliorer les outils de recueil et d'échange d'information, éventuellement par voie d'informatisation du circuit de signalement. Ils organisent les retours d'information sur les signalements et leurs investigations vers les établissements de santé, afin de les informer des enseignements tirés de certains épisodes.
ANNEXE 4 : L'ARRETE DU 11 JUIN 2002 relatif au bilan annuel des activités de lutte contre les infections nosocomiales des établissements de santé
|
Article 1 er Le bilan annuel des activités de lutte contre les infections nosocomiales dans les établissements de santé prévu à l'article R. 711-1-2 est établi conformément au modèle annexé au présent arrêté et transmis à la direction départementale des affaires sanitaires et sociales et au centre de coordination de la lutte contre les infections nosocomiales. Article 2 L'arrêté du 17 octobre 2000 relatif au bilan annuel des activités de lutte contre les infections nosocomiales dans les établissements de santé est abrogé. Article 3 Le directeur général de la santé et le directeur de l'hospitalisation et de l'organisation des soins sont chargés, chacun en ce qui le concerne, de l'exécution du présent arrêté qui sera publié au Bulletin officiel du ministère chargé de la santé. Fait à Paris, le 11 juin 2002.
ANNEXE I
Année ...
Commentaires Cette année, la saisie informatisée du bilan 2001 vous est proposée sous une forme plus conviviale. Les questions apparaîtront à l'écran les unes après les autres avec les commentaires inscrits dans cette colonne. Vous pourrez corriger ou compléter votre première saisie. Quand vous aurez terminé, le programme sauvegardera le fichier sur la disquette que vous devez retourner au service de la DDASS qui vous l'a adressé. Si vous avez des commentaires particuliers à faire sur vos activités ou sur ce bilan, portez-les sur la version papier et adressez-la en même temps que la disquette. Pour le bilan 2002, le ministère envisage de proposer une saisie directe sur Internet. Afin d'évaluer la faisabilité de cette procédure, il vous est demandé de préciser si l'établissement dispose d'une liaison Internet qui pourra être utilisée pour le bilan standardisé 2002 : Liaison Internet : Oui Non Adresse Internet : I. - DONNÉES ADMINISTRATIVES DE L'ÉTABLISSEMENT Nom de l'établissement : Adresse de l'établissement : Ville : Département : Numéro Finess de l'entité juridique : Numéro Finess de l'établissement :
Type de l'établissement
CHR - CHU CH - CHG CHS - Etablissement psychiatrique Hôpital local Clinique MCO Hôpital des armées Etablissement SSR/SLD CLCC, instituts du cancer
HAD
Statut de l'établissement
Public
Privé (OQN) Commentaires : Les données de ce premier chapitre seront automatiquement reprises les années suivantes dans le bilan informatisé. Pour cela, vous ne devez pas détruire les fichiers qui sont automatiquement copiés sur votre disque dur dans le répertoire c:\bcr2001. Si vous changez d'ordinateur, il faudra recopier ce répertoire complet dans votre nouvel ordinateur.
Pour effectuer une saisie efficace sur l'ordinateur,
préparez vos réponses à partir de cette version
papier.
Pour les données administratives et celles concernant le personnel (ch. II), demandez à l'administration de l'établissement de vous transmettre les informations. Type de l'établissement : Le type « AUTRE » doit être exceptionnel. Pour les établissements privés non MCO, les inscrire dans le type correspondant à leur spécialité (Psy, SSR ou SLD, HAD...). Les maisons de convalescence émargent généralement à la carte sanitaire SSR : les inscrire en établissements SSR/SLD. |
|
CATÉGORIES DE LITS ET PLACES
|
NOMBRE
|
NOMBRE
|
|
Médecine (et réanimation médicale), court séjour dont réanimation médicale |
/ / / / / / / / / |
|
|
Chirurgie (et réanimation chirurgicale), court séjour dont réanimation chirurgicale |
/ / / / / / / / / |
|
|
Obstétrique |
||
|
Néonatalogie (y compris réanimation néonatale) |
/ / / / / / / / / |
|
|
Soins de suite et de réadaptation |
||
|
Soins de longue durée |
/ / / / / / / / / |
|
|
Psychiatrie |
||
|
Urgences (HTCD) |
/ / / / / / / / / |
|
|
Hémodialyse |
/ / / / / / / / / |
|
|
Hospitalisation à domicile |
/ / / / / / / / / |
|
|
Autre type de services sanitaires |
||
|
Nature du service |
|
Nombre total de services ou de secteurs d'activités : Nombre total de services ou de secteurs d'activités de chirurgie : Nombre total de services ou de secteurs d'activités d'obstétrique : Commentaires : Sous cette rubrique, vous devez inscrire les lits et places installés. Les lits et places non installés n'ont pas d'intérêt pour la lutte contre les infections nosocomiales. Les catégories proposées correspondent aux différentes cartes sanitaires gérées par l'ARH. Les lits de médecine et de chirurgie comprennent leur pédiatrie respective. Pour la réanimation préciser le nombre de lits de réanimation, en médecine et en chirurgie respectivement (ex. : 55 lits de chirurgie y compris 5 lits de réanimation chirurgicale). Ces questions sur le nombre de services ou de secteurs d'activités permettront de mesurer l'évolution de certains items renseignés ci-dessous ainsi que le % de réalisation des objectifs concernant les services chirurgicaux.
II. - LE COMITÉ DE LUTTE
Un CLIN a-t-il été constitué dans l'établissement ? Oui Non Nom du président du CLIN Outre les moyens éventuellement alloués à l'équipe opérationnelle d'hygiène, le CLIN dispose-t-il d'un budget de fonctionnement (secrétariat, frais de fonctionnement, etc.) ? Oui Non Combien y a-t-il eu de réunions plénières du CLIN durant l'année ?
Combien y a-t-il eu de réunions de groupes de travail
durant l'année ?
Si OUI, le(s)quel(s) ?
C-CLIN
Groupement de CLIN Autre
III. - RESSOURCES DE L'ÉTABLISSEMENT
1. L'équipe opérationnelle d'hygiène (EOH) L'établissement dispose-t-il d'un personnel spécialement dédié à la lutte contre les infections nosocomiales ? Oui Non Si oui, ce personnel est-il partagé avec d'autres établissements ? Oui Non Si OUI, Avec combien d'établissements (y compris le vôtre) Convention avec ces établissements (signée ou en cours) ? Oui Non
Commentaires :
Réunions des groupes de travail : réunions, en
dehors des précédentes, de groupes de travail ou de commissions
chargés par le CLIN de soumettre des propositions adoptées en
séance plénière.
Personnels :
|
|
CATÉGORIES
|
NOMBRE
D'ETP
|
NOMBRE D'ETP
|
NOMBRE D'ETP
|
|
Médecin |
|||
|
Pharmacien |
|||
|
Cadre infirmier |
|||
|
Infirmier non cadre |
|||
|
Tech. biohygiéniste |
|||
|
Secrétaire |
|||
|
Autre personnel
|
|||
|
Autre personnel en formation (internes, étudiants...) |
... personnes :
|
|
Commentaire : Colonne 2 : Ne compter que le personnel dédié à la lutte contre les infections nosocomiales, à l'exclusion de tout autre personnel. Si ce personnel partage son temps, au sein de l'établissement, avec d'autres activités, ne compter que la part consacrée à la lutte contre les infections nosocomiales. Si ce personnel est partagé avec d'autres établissements associés, ne compter que la part consacrée au sein de votre établissement. Colonne 3 : Inscrire les ETP dont le financement est à la charge du budget de votre établissement.
Ne pas inscrire les ETP intervenant dans votre
établissement mais émargeant au budget d'un autre
établissement.
Colonne 4 : Il s'agit des postes non occupés au 31 décembre parmi ceux qui émargent au budget de votre établissement (donc inclus dans la colonne 3). Ces questions doivent permettre de mesurer les efforts budgétaires accomplis et à prévoir pour l'avenir. 2. L'organisation de l'EOH Indiquez le type d'organisation de l'EOH en inscrivant le numéro correspondant à sa situation: 1. Service d'hygiène avec chef de service (ou structure spécifique autonome dans le secteur privé).
2. Fédération médicale
interhospitalière (art. L. 6135-1 du CSP)3. Unité fonctionnelle
d'hygiène (voir ci-après)
5. Personnel rattaché directement à un service médico-technique (pharmacie, laboratoire...) 6. Personnel rattaché directement à un service administratif (DSSI) 7. Sans organisation formelle S'il s'agit d'une unité fonctionnelle (art. L. 6146-1 du CSP), est-elle : au sein d'un service, département ou fédération* de soins de soins au sein d'un service, département ou fédération* médico-technique au sein d'une structure multidisciplinaire (vigilances, pôle qualité) rattachée à un service administratif (DSSI) indépendante de toute autre structure * Fédération (interne à l'établissement) : art. L. 6146-4 du CSP.
Commentaires :
Secteur public : les définitions proposées (1, 2 et 3) correspondent aux dispositions du code de la santé publique. Le CLIN ou le C-CLIN ne sont pas des services de l'établissement. Si l'EOH n'a pas d'autre lien hiérarchique que celui qui le lie au CLIN, cocher « Sans organisation formelle ». 3. Les correspondants en hygiène dans les services de soins Existe-t-il, dans les services de soins ou secteurs d'activités, des correspondants en hygiène ? Oui Non Si OUI, indiquer le nombre de services de soins où est identifié : au moins un correspondant médical : au moins un correspondant paramédical :
Commentaire :
|
|
IV. - OBJECTIFS ET STRATÉGIE DE LUTTE
L'établissement a-t-il adopté un projet d'établissement ? Oui Non Si oui, les objectifs généraux en matière de lutte contre les infections nosocomiales sont-ils définis dans le projet d'établissement ? Oui Non L'établissement a-t-il signé un contrat d'objectifs et de moyens (COM) avec l'ARH ? Oui Non Si oui, le COM signé avec l'ARH définit-il des objectifs et des moyens relatifs à la lutte contre les infections nosocomiales ? Oui Non L'établissement a-t-il publié un livret d'accueil ? Oui Non Si oui, ce livret d'accueil comporte-t-il une information synthétique sur la lutte contre les infections nosocomiales dans l'établissement ? Oui Non
2. - Le programme d'action Cette année, un programme d'action en matière de lutte contre les infections nosocomiales a-t-il été élaboré par le CLIN avec l'EOH ? Oui Non Si oui, ce programme d'action a-t-il été : soumis à l'avis de la conférence ou commission médicale de l'établissement ? Oui Non soumis à l'avis de la commission du service de soins infirmiers (secteur public uniquement) ? Oui Non soumis pour délibération au conseil d'administration (ou équivalent dans le secteur privé) ? Oui Non transmis, après délibération du CA, au comité d'hygiène, de sécurité et des conditions de travail ? Oui Non |
|
2. - Les objectifs prioritaires du programme d'action
Evaluation des objectifs prioritaires du programme d'action |
|
OBJECTIFS FIXÉS |
RÉALISÉS CETTE ANNÉE |
COMMENTAIRES |
|
1. |
Complètement |
|
|
Partiellement |
||
|
Non |
||
|
2. |
Complètement |
|
|
Partiellement |
||
|
Non |
||
|
3. |
Complètement |
|
|
Partiellement |
||
|
Non |
||
|
4. |
Complètement |
|
|
Partiellement |
||
|
Non |
|
Commentaire : si le programme d'action a défini plus de 4 objectifs, sélectionner les 4 objectifs qui vous paraissent les plus importants. .4. - Le rapport annuel sur les activités de l'année précédente Un rapport annuel sur les activités de l'année précédente a-t-il été élaboré par le CLIN ? Oui Non Si oui, ce rapport d'activités a-t-il été : soumis à l'avis de la conférence ou commission médicale de l'établissement ? Oui Non soumis à l'avis de la commission du service de soins infirmiers (secteur public uniquement) ? Oui Non soumis pour délibération au conseil d'administration (ou équivalent dans le secteur privé) ? Oui Non transmis, après délibération du CA, au comité d'hygiène, de sécurité et des conditions de travail ? Oui Non
V. - PRÉVENTION DES RISQUES INFECTIEUX
1. - Prévention de la diffusion des BMR Existe-t-il un programme de maîtrise de la diffusion des BMR ? Oui Non Si oui, depuis quelle année ? A-t-il été : actualisé cette année ? Oui Non évalué cette année ? Oui Non 2- Bon usage des antibiotiques L'établissement a-t-il un comité du médicament ? Oui Non Si oui : un représentant du comité du médicament est-il membre du CLIN ? Oui Non des protocoles concernant le bon usage des antibiotiques sont-ils élaborés en collaboration avec le CLIN et le comité du médicament ? Oui Non Existe-t-il des protocoles (1) sur l'antibioprophylaxie chirurgicale (2) ? Oui Non Si oui, ont-t-il été : mis en place cette année ? Oui Non actualisés cette année ? Oui Non évalués (observance) cette année ? Oui Non Existe-t-il des protocoles (1) sur l'antibiothérapie de première intention (3) dans les principales infections ? Oui Non Si oui, ont-ils été : mis en place cette année ? Oui Non actualisés cette année ? Oui Non évalués (observance) cette année ? Oui Non 3. - Accidents d'exposition au sang (AES) Existe-t-il un système de signalement des AES en collaboration avec la médecine du travail ? Oui Non Existe-t-il un protocole de prise en charge en urgence des AES ? Oui Non L'établissement a-t-il mené des actions de prévention des AES cette année ? Oui Non
L'eau a-t-elle fait l'objet d'une surveillance microbiologique cette année en ce qui concerne : * les fontaines réfrigérantes ? Oui, avec un seuil d'alerte définiOui, sans seuil d'alerte défini Non, Il n'y a pas de fontaines réfrigérantes * l'eau bactériologiquement maîtrisée (postes de lavage en chirurgie, réanimation, service des grands brûlés) ? Oui, avec un seuil d'alerte défini Oui, sans seuil d'alerte défini
Non
* réseau d'eau chaude sanitaire ? Oui, avec un seuil d'alerte défini Oui, sans seuil d'alerte défini
Non
Si oui : Y a-t-il eu cette année une surveillance de l'air dans les secteurs où l'air est traité ? Oui, avec un seuil d'alerte défini Oui, sans seuil d'alerte défini Non 5- Protocoles de prévention des risques infectieux Cocher en cas de réponse affirmative |
|
THÈMES des protocoles |
PROTOCOLES
|
ACTUALISÉS
|
APPLICATION
|
DIFFUSION
|
|
1. Hygiène des mains |
||||
|
2. Précaution « standard » |
||||
|
3. Préparation de l'opéré* |
||||
|
4. Sondage urinaire |
||||
|
5. Dispositifs intra-vasculaires |
||||
|
6. Hémocultures |
||||
|
7. Ventilation artificielle* |
||||
|
8. Techniques d'isolement |
||||
|
9. Maladie de Creutzfeldt-Jakob |
||||
|
10. Escarres |
||||
|
11. Pansements |
||||
|
12. Antiseptiques |
||||
|
13. Désinfectants |
||||
|
14. Traitement des dispositifs médicaux (endoscopes, matériel médico-chirurgicaux)* |
||||
|
15. Entretien des locaux |
||||
|
16. Elimination des déchets |
||||
|
17. Circuit du linge |
||||
|
18. Maintenance des systèmes de traitement de l'air des secteurs protégés* |
||||
|
19. Hygiène en radiologie* |
||||
|
20. Hygiène en hémodialyse* |
||||
|
21. Hygiène en service d'explorations fonctionnelles* |
||||
|
22. Hygiène en laboratoire* |
||||
|
23. Hygiène en pharmacie |
||||
|
24. Autre n° 1 :
|
||||
|
25. Autre n° 2 :
|
||||
|
* Inscrire 8 si l'activité n'existe pas dans l'établissement. |
||||
|
VI. - SURVEILLANCE ÉPIDÉMIOLOGIQUE
1. Une enquête de prévalence a-t-elle été réalisée cette année ? Oui Non Si oui, indiquer le nombre de services concernés : 2. Une enquête d'incidence a-t-elle été réalisée cette année ? Oui Non Si oui, remplir le tableau suivant : |
|
THÈME DES ENQUÊTES
|
NOMBRE DE SERVICES
|
ENQUÊTE RÉALISÉE
|
|
1. Tous types d'infections |
Oui Non |
|
|
2. Infections du site opératoire |
Oui Non |
|
|
3. Pneumopathies nosocomiales |
Oui Non |
|
|
4. Infections urinaires nosocomiales |
Oui Non |
|
|
5. Infections sur cathéter |
Oui Non |
|
|
6. Bactériémies nosocomiales |
Oui Non |
|
|
7. Autres |
Oui Non |
|
|
Préciser : |
|
Incidence : une enquête d'incidence recense le nombre de nouveaux cas apparus au cours d'une période de temps (passages répétitifs dans le même service pour recenser le nombre de cas nouvellement apparus depuis le passage précédent). 3. Surveillance à partir du laboratoire de microbiologie L'établissement dispose-t-il d'un laboratoire de microbiologie ?
Interne
Non
Si oui, a-t-elle concerné ? Uniquement les BMR BMR + autres germes Uniquement autres germes. Si BMR, a-t-elle porté sur l'ensemble des services de l'établissement ? Oui Non 4. Diffusion des résultats de la surveillance Les résultats de la surveillance (enquêtes et données du laboratoire) ont-ils été diffusés aux services participants ? Oui Non VII. - SITUATIONS D'ALERTE OU ÉPIDÉMIQUES Nombre de situations d'alerte ou de situations épidémiques (cas rares, cas groupés...) détectées cette année au sein de l'établissement : Nombre de situations d'alerte ayant conduit à solliciter un expert ou une structure extérieure à l'établissement cette année pour une aide : Nombre de situations d'alerte ayant fait l'objet d'un signalement externe (C-CLIN et DDASS) cette année : VIII. - FORMATION EN HYGIÈNE HOSPITALIÈRE Un programme de formation continue en hygiène hospitalière a-t-il été inscrit cette année dans le plan de formation de l'établissement ? Oui Non Si oui, le CLIN a-t-il été consulté ? Oui Non Une formation en hygiène a-t-elle été prévue pour les nouveaux professionnels de l'établissement (formations inscrites au plan de formation de l'établissement ou programmées) ? nouveaux personnels recrutés Oui Non intérimaires Oui Non étudiants (médicaux, paramédicaux, autres) Oui Non Tableau des formations relatives à la lutte contre les infections nosocomiales ou à l'hygiène hospitalière suivies au cours de l'année par le personnel de l'établissement (au sein ou à l'extérieur de l'établissement) : |
NOMBRE TOTAL
|
NOMBRE TOTAL D'HEURES
|
|
Médecins ou pharmaciens |
||
|
Personnels infirmiers |
||
|
Autres personnels permanents |
||
|
Autres personnels intérimaires ou étudiants |
|
IX. - ÉVALUATION Des actions d'évaluation ont-elles été menées durant l'année (en dehors des évaluations de l'application des protocoles déjà signalées) ? Oui Non Si oui : y a-t-il eu des audits de pratiques ? Oui Non y a-t-il eu d'autres actions d'évaluation ? Oui Non Si oui, lesquelles : X. - COMMENTAIRES
Signature du président
ANNEXE II MODALITÉS D'UTILISATION DU MODULE AUTOMATISÉ DU BILAN STANDARDISÉ DES ACTIVITÉS DE LUTTE CONTRE LES INFECTIONS NOSOCOMIALES ANNEXE III CALENDRIER DES ÉTAPES DE RECUEIL ET DE TRAITEMENT DES BILANS STANDARDISÉS DES ACTIVITÉS DE LUTTE CONTRE LES INFECTIONS NOSOCOMIALES |
|
ACTEURS |
ÉTAPES |
CALENDRIER 2002 |
|
Etablissements de santé |
Envoi des données saisies à la DDASS |
Fin septembre 2002 |
|
DDASS |
Contrôle d'exhaustivité, saisie complémentaire, constitution d'une base de données départementale |
Période septembre-octobre 2002 |
|
Envoi de la base départementale à la DRASS |
Fin octobre 2002 |
|
|
DRASS |
Constitution d'une base de données régionale et contrôle de validité des données par le référent régional |
Période octobre-décembre 2002 |
|
Edition d'une synthèse régionale par le référent régional |
||
|
Transmission de la base régionale à la cellule infections nosocomiales du ministère de la santé, de la famille et des personnes handicapées |
Date limite : 20 novembre 2002 |
|
|
Ministère de la santé, de la famille et des personnes handicapées |
Publication et diffusion de l'analyse nationale |
Janvier 2003 |
|
(2) Ne concerne que les établissements disposant de services chirurgicaux. (3) Il s'agit de la prescription d'antibiotiques à usage curatif avant ou en absence d'antibiogramme ou de documentation bactériologique. |
ANNEXE 5 : PROGRAMME NATIONAL DE LUTTE CONTRE LES INFECTIONS NOSOCOMIALES



















ANNEXE 6 : CIRCULAIRE N°DHOS/E2/E4/2004/176 du 29 mars 2004 relative aux recommandations pour la mise en place d'un programme de gestion des risques dans les établissements de santé
Résumé :
Chaque établissement de santé développe un programme de gestion globale et coordonnée des risques. Ce programme comporte les objectifs à atteindre et les actions à mener en matière de prévention et de maîtrise des risques, de sensibilisation, d'information, de formation et d'évaluation du programme.
Mots-clés :
Accréditation, programme de gestion des risques, management des risques, gestionnaire de risques, hiérarchisation des risques, formation et sensibilisation.
Textes de référence : Art L.6113-2, Art L.6113-3 et art L.6114-3 du CSP
1. INTRODUCTION
La présente circulaire accompagne la diffusion d'un document sur le management des risques en établissement de santé intitulé « Recommandations pour l'élaboration et la mise en oeuvre d'un programme de gestion des risques dans les établissements de santé».
Le champ des risques dans un établissement de santé est vaste : risques spécifiques aux établissements de santé liés aux activités médicales et de soins, encore appelés risques cliniques, risques communs à toutes les organisations comme les risques techniques, environnementaux mais aussi informatiques, sociaux, financiers...
Si la démarche de gestion de risques (identification, analyse, hiérarchisation, élaboration et mise en oeuvre de plan d'action, suivi et évaluation) est identique quel que soit le risque considéré, les recommandations s'attachent surtout au management des risques cliniques, des risques techniques et environnementaux dès lors qu'ils mettent en jeu la sécurité des patients et des personnels et la continuité des soins.
1. MANAGEMENT DES RISQUES AU SEIN DES ETABLISSEMENTS DE SANTE : PROBLEMATIQUE ET ENJEUX
L'obligation faite aux établissements de santé par les ordonnances de 1996 de s'engager dans des démarches d'amélioration de la qualité et de la sécurité a conduit à des progrès importants dans la maîtrise sectorielle de certains risques, comme les risques liés aux produits de santé, le risque infectieux nosocomial ou le risque incendie. Cependant, des efforts importants restent à faire.
En effet, la prévention des événements indésirables graves liés aux soins est devenue, ces dernières années, un enjeu de santé publique. Les études internationales, de plus en plus nombreuses sur ce thème, ont révélé leur ampleur et leur impact considérable sur les systèmes de santé en termes de coût humain et économique. Selon les études, trente à cinquante pour cent de ces événements graves sont potentiellement évitables. En France, une enquête nationale prospective devrait permettre de disposer en 2005 de données sur la fréquence des événements indésirables graves liés aux soins dans les établissements de santé et d'identifier les causes les plus fréquentes. Toutefois, l'enquête de faisabilité réalisée en Aquitaine en 2002 a d'ores et déjà montré des résultats comparables à ceux des autres pays.
La perception du risque et son acceptabilité par l'usager, désormais mieux informé et plus exigeant en matière de qualité et sécurité des soins, se sont considérablement modifiés ces dernières années. Les établissements sont également confrontés à une augmentation des contentieux, à des évolutions assurancielles et à une pression médiatique, lors de la survenue d'accidents médicaux graves notamment. Ils doivent pouvoir démontrer qu'ils se sont organisés pour prévenir les risques dans la mesure du possible.
Or, seule une approche transversale, coordonnée et pluridisciplinaire de la gestion des risques permet d'appréhender les risques de façon globale. Cette approche, à la faveur de l'accréditation notamment, se développe dans les établissements. Elle exige de l'ensemble des acteurs hospitaliers des changements importants et durables sous tendus par l'acquisition d'une culture commune de vigilance et de sécurité.
Les recommandations accompagnant cette circulaire sont proposées comme outil de mise en oeuvre d'un programme de gestion des risques dans les établissements de santé.
2. PROGRAMME DE GESTION DES RISQUES DANS LES ETABLISSEMENTS DE SANTE
Les recommandations développent les aspects opérationnels d'une démarche de gestion des risques en déclinant les différentes étapes de l'élaboration et de la conduite d'un tel programme. Des exemples témoignent d'expériences d'établissements de santé. En annexes, les risques techniques et environnementaux sont spécifiquement développés.
2.1 Les conditions de développement d'un programme de gestion des risques
Le pilotage
L'impulsion donnée par le directeur d'établissement est un élément fondamental de réussite. Un comité de pilotage est mis en place. Il réunit au minimum le directeur, le directeur des soins et le président de la Commission médicale d'Etablissement (ou de son équivalent pour les établissements privés). Il définit la politique de gestion des risques et valide le programme. Il veille à la cohérence avec les différents projets institutionnels et à la synergie avec la démarche d'amélioration de la qualité des soins.
Un gestionnaire de risques
Le rôle du gestionnaire de risques est d'animer, de coordonner la démarche, de mettre en oeuvre et d'évaluer le programme de gestion des risques. Il est rattaché à la direction. La transversalité de sa fonction lui permet de mobiliser toutes les compétences utiles et de fédérer les acteurs autour des objectifs du programme. Cette fonction peut être mutualisée entre plusieurs établissements.
La mobilisation des compétences
La mise en place d'un programme de gestion des risques répond à un projet collectif. Le gestionnaire de risques s'appuie sur les acteurs impliqués dans la gestion d'un risque particulier. Partie prenante dans l'élaboration et la mise en oeuvre du programme de gestion des risques, ils apporteront non seulement leurs compétences dans un domaine de risque, mais aussi leur savoir faire en termes de formation, d'information, de connaissance des outils et méthodes d'identification et d'analyse des risques. Ces acteurs sont par exemple l'équipe opérationnelle d'hygiène, les vigilants, le médecin du travail, les ingénieurs, le coordonnateur des risques techniques et environnementaux lorsqu'il existe.
2.2 Le programme de gestion des risques
Ce programme fait l'objet d'un document écrit. Il est présenté pour avis et délibération aux instances. Il est inscrit dans le projet d'établissement et/ou les annexes qualité et sécurité des contrats d'objectifs et de moyens. Le gestionnaire de risque élabore chaque année un rapport d'activité qui est intégré au rapport annuel d'activité de l'établissement.
Il comprend le bilan de l'existant, les risques prioritaires à traiter, les plans d'action et de prévention correspondants, les modalités de suivi et d'évaluation. La problématique d'un système d'information pour la gestion des risques est à intégrer dès la conception du programme.
3. ROLE D'ACCOMPAGNEMENT DES AGENCES REGIONALES DE L'HOSPITALISATION
L'agence contribue au développement des programmes de gestion des risques dans l'ensemble des établissements de santé publics et privés de sa région. L'organisation régionale dans les domaines de la qualité et de la sécurité vise à favoriser le partage d'expériences entre établissements, la mutualisation des compétences, la mise à disposition de méthodes et d'outils communs et à faciliter la veille réglementaire et scientifique. La conduite d'actions en matière d'information, de formation, de sensibilisation aux risques des professionnels de santé est nécessaire à l'impulsion d'une dynamique régionale de développement des programmes (journée régionale par exemple).
Les agences pourront s'appuyer notamment sur les réseaux qualité et/ou les coordinations régionales des vigilances déjà en place. En effet, lorsqu'ils intègrent la problématique de l'amélioration de la sécurité, ces réseaux ou coordinations facilitent le développement d'une politique régionale de gestion des risques(1) .
Le programme gestion des risques peut faire l'objet d'un contrat d'objectifs et de moyens entre l'ARH et l'établissement de santé.
Mes services sont à la disposition des ARH pour participer à leurs réunions régionales. Afin de suivre la mise en place des programmes dans les établissements de chaque région, des points réguliers seront faits avec les responsables qualité des ARH et mes services.
Une évaluation de l'application des recommandations sera conduite fin 2004 sur un panel d'établissements volontaires à des stades différents d'avancement de la démarche. Les établissements volontaires voudront bien se faire connaître auprès du bureau E2 de la DHOS (par courrier ou par mail : secrétariat du bureau E2, DHOS - anne.broyart@sante.gouv.fr ).
4. DIFFUSION
Les DDASS sont chargées de la diffusion de la présente circulaire aux établissements de santé de leur département.
Les recommandations sont accessibles et téléchargeables sur le site internet du ministère de la Santé.
ANNEXE 7 : Actions de gestion du risque dans les instances internationales
Les risques sanitaires dans les établissements de santé constituent une préoccupation majeure de santé publique tant du point de vue européen que mondial ; voici quelques points de repère (source DHOS).
1. Union européenne (UE)
Si l'organisation des soins relève de chaque Etat en raison du principe de subsidiarité, en revanche la libre circulation des professionnels de santé est inscrite depuis plusieurs années dans les instances européennes ainsi que celle des patients, depuis que la jurisprudence européenne en a affirmé le principe (arrêt Kholl et Decker en 1998). Ces principes ont conduit la Commission Européenne à prendre en compte les enjeux de qualité, de sécurité et d'accessibilité aux services de santé et à développer une coopération, au delà de la veille et de la gestion indispensables de certains risques sanitaires (SRAS, grippe aviaire par exemple).
La Commission européenne a ainsi initié, avec les ministres des Etats membres et des représentants de la société civile, un processus de réflexion à haut niveau sur la mobilité des patients et l'évolution des soins de santé dans l'Union Européenne. Elle a mis en place en 2004 un groupe de réflexion afin que les Etats membres puissent partager leur expérience, comparer leur politique et leur performance et développer en commun des actions concrètes sur la base d'une " méthode ouverte de coordination ". Dans ce cadre, la sécurité des patients est un des thèmes faisant l'objet d'un groupe de travail spécifique.
Parallèlement à ce groupe à haut niveau, le National Health Service sous présidence britannique a mis en place en 2005 un groupe de travail associant une vingtaine de pays européens. Sa réflexion porte notamment sur la mise en oeuvre d'un certificat européen de statut professionnel garantissant la bonne pratique des professionnels de santé lors de la mobilité de ces derniers en Europe.
L'ensemble de ces travaux conduira à des recommandations ou à des standards de sécurité et de qualité.
Programme d'action communautaire dans le domaine de la santé publique
Le thème de la sécurité des patients a fait l'objet d'un appel à propositions du programme d'action communautaire 2004/2005 de santé publique. Un projet relatif à l'amélioration de la sécurité du patient en Europe, dit projet SIMPATIE - Safety Improvement for Patients in Europe - a été retenu et financé pour 2005.
Ce projet multipartenaires, coordonné par le Conseil de l'Europe, vise à définir à travers une approche concertée une politique européenne de gestion des risques : cartographie des activités liées à la sécurité des patients d'une vingtaine d'Etats membres, outils d'amélioration de la sécurité des patients (vocabulaire commun, outils d'analyse, indicateurs..), recommandations européennes dans les domaines technique et politique, notamment.
Conférences de la présidence de l'Union européenne
Compte tenu de l'importance du thème " sécurité du patient ", des conférences se sont déroulées sous les présidences 2005 de l'Union Européenne (UE) luxembourgeoise et britannique. La conférence du Luxembourg " la sécurité des patients : en faire une réalité " (avril 2005) et la conférence britannique " sommet de Londres sur la sécurité des patients " (novembre 2005) confirment la volonté de l'UE d'inscrire la sécurité du patient à son agenda politique pour développer une stratégie européenne de promotion de la sécurité des patients.
La première conférence luxembourgeoise a permis l'adoption d'une déclaration, dite déclaration du Luxembourg, comportant des recommandations aux autorités nationales et aux professionnels de santé.
La seconde conférence britannique élargie à l'OMS et réunissant la plupart des ministres européens de la santé, a permis, d'une part, de sensibiliser la société civile par une mobilisation des patients, en accordant une place importante à leurs témoignages, et, d'autre part d'aborder les questions relatives au recueil et à l'analyse de données, aux expériences issues des secteurs industriels en matière de sécurité, à l'enseignement, à la formation et à la recherche.
2. Conseil de l'Europe
Un projet de recommandations intitulé "Prévention des évènements indésirables dans les soins de santé : une approche systémique " comportant 10 points clés, a été adopté en juin 2005 par le comité européen de la santé (CDSP). Ces recommandations élaborées avec la participation des nombreux pays européens s'inscrivent dans le droit fil de la déclaration du Luxembourg. Elles ont déjà fait l'objet de plusieurs présentations lors des différentes conférences européennes et internationales en 2005 sur la sécurité des patients et devraient être prochainement diffusées aux Etats membres.
La déclaration de Varsovie, qui consolide la déclaration du Luxembourg, a été adoptée à l'issue de la conférence de Varsovie " la sécurité des patients : un défi européen " (avril 2005).
3. Activités au sein de l'Organisation Mondiale de la Santé (OMS)
La sécurité des patients représente un enjeu mondial comme en témoignent les études concordantes des différents pays sur la fréquence des événements indésirables liés aux soins. En effet, quel que soit le système de santé, au moins 10% des admissions à l'hôpital entraînent des événements indésirables pour les patients hospitalisés, la moitié d'entre eux étant considérés comme évitables. Ces événements qui peuvent avoir des conséquences sévères (décès, handicap), ont un impact économique non négligeable.
Lors de la cinquante-cinquième assemblée mondiale de la santé en 2002, une résolution "Qualité des soins : sécurité des patients" invitait les pays à accorder la plus grande attention à ce sujet et incitait l'OMS à promouvoir le développement d'une politique de sécurité des patients en établissant notamment des standards internationaux, en encourageant la recherche et en appuyant les efforts des Etats Membres.
Dans ce contexte, l'Alliance mondiale pour la sécurité des patients a été créée en octobre 2004. Des lignes d'action "Global Patient Safety Challenge" ont été définies pour un cycle de deux ans ; les travaux pour la période 2005-2006 portent sur les infections associées aux soins ("Clean Care is Safer Care ").
Les différents volets du programme de l'Alliance Mondiale concernent l'implication des patients et usagers, le développement d'une taxonomie internationale, la recherche et la mise en place de "solutions" pour améliorer la sécurité des patients
Un projet de recommandations relatif aux systèmes de déclaration et d'apprentissage des événements indésirables liés aux soins (« WHO draft guidelines for adverse event reporting and learning systems, from information to action ») a été diffusé aux Etats Membres lors du sommet de Londres fin 2005.
ANNEXE 8 : Indicateurs du tableau de bord des infections nosocomiales

L'indicateur "SHA" - solutions hydro-alcooliques.
1 - La définition de l'indicateur SHA
L'indicateur est défini par le volume de produits hydro-alcooliques consommé dans l'année écoulée, en litres pour 1000 jours d'hospitalisation. Sa valeur est calculée à partir des quantités commandées (celles-ci reflétant les quantités consommées par les services).
Les établissements de santé retranscrivent uniquement les données du numérateur dans le bilan standardisé des activités de lutte contre les infections nosocomiales 2005 dont le format a été actualisé par l'arrêté du 8 mars 2006.
Le dénominateur en journées d'hospitalisation sera directement extrait à l'échelon national des données de la DREES à partir des déclarations SAE des établissements de santé
La valeur de l'indicateur sera calculée par l'administration centrale (cellule infections nosocomiales DGS-DHOS).
2 - Le numérateur de l'indicateur SHA
Le volume en litres de solutions ou gels hydro-alcooliques, commandés par la pharmacie et/ou le service économique ou chargé des achats de l'établissement pendant l'année 2005 (les quantités commandées reflètent les quantités consommées par les services).
3 - Le mode de calcul du numérateur de l'indicateur SHA
Le calcul est réalisé pour tous les produits et conditionnements, le numérateur sera égal à la somme totale. Le cas des produits en échantillon: La consommation de SHA pourra être incluse s'il existe des éléments de preuve attestant la quantité de produits effectivement donnée à titre gratuit par les entreprises pharmaceutiques.
Un tableur XLS est à disposition comme outil d'aide au calcul. La liste des produits y est indicative. Les dernières lignes sont libres pour réaliser les calculs en fonction des produits utilisés dans l'établissement de santé.
4 - En pratique
Exemple : Deux produits ont été commandés par l'établissement en 2005 :
13 recharges souples de Magiqcha de 500ml par le service chargé des achats et 11 flacons de poche de Douchanet de 50ml par la pharmacie.
Pour l'année 2005, le numérateur en litre de l'établissement de santé sera:
((13x500) + (11 x 50)) /1000 = 7,05 litres de SHA commandés par l'établissement de santé pour l'année 2005.
La valeur 7,05 litres sera à inscrire dans la case du bilan des activités de lutte contre les infections nosocomiales 2005 : Volume de solutions ou de gels hydro-alcooliques, commandé par la pharmacie ou les services communs pendant l'année (converti en litres).
L'indicateur "SARM" - Staphylococcus aureus résistant à la méticilline.
1. La définition de l'indicateur SARM
Nombre de patients hospitalisés chez lesquels au moins une souche de Staphylococcus aureus résistant à la méticilline (SARM) a été isolée dans l'année 2005 au sein d'un prélèvement à visée diagnostique pour 1000 journées d'hospitalisation.
Les établissements de santé retranscrivent uniquement les données du numérateur dans le bilan standardisé des activités de lutte contre les infections nosocomiales 2005 dont le format a été actualisé par l'arrêté du 8 mars 2006.
Le dénominateur en journées d'hospitalisation sera directement extrait à l'échelon national des données de la DREES à partir des déclarations SAE des établissements de santé
La valeur de l'indicateur sera calculée par l'administration centrale (cellule infections nosocomiales DGS-DHOS).
2. Le numérateur de l'indicateur SARM
Le nombre de patients hospitalisés chez lesquels au moins une souche de SARM a été isolée dans l'année au sein d'un prélèvement à visée diagnostique.
3. Le mode de calcul du numérateur de l'indicateur SARM
Seront incluses toutes les souches de SARM isolées, issues de prélèvements' à visée diagnostique, c'est-à-dire de tous les prélèvements sauf ceux à visée de dépistage chez les malades en hospitalisation complète ou de semaine; Dans l'ensemble des services de soins: court séjour (médecine, chirurgie, obstétrique), soins de suite et de réadaptation, soins de longue durée, psychiatrie; Quels que soient le mode d'admission dans le service (direct, en urgence, par transfert) et le mode de sortie (à domicile, transfert externe ou décès).
Remarques :
Les prélèvements à visée diagnostique sont ceux effectués pour le diagnostic individuel (diagnostic positif et diagnostic étiologique) des pathologies infectieuses. Ces prélèvements sont destinés à rechercher chez des sujets malades les bactéries responsables de ces pathologies.
Pour un patient donné, il ne faut donc compter que la 1 ère souche de SARM isolée dans l'année dans l'établissement (dédoublonnage). Un doublon correspond ici à « toute souche de SARM isolée chez un patient pour lequel une souche de SARM a déjà été prise en compte dans l'année, quel que soit son antibiotype et quel que soit le site de prélèvement ».
Seront exclues les souches de SARM isolées de prélèvements à visée de dépistage : prélèvement réalisé dans le but exclusif de rechercher des SARM (écouvillon nage nasal ou de la peau faisant l'objet de cultures à la recherche de SARM sur milieux sélectifs contenant en général des antibiotiques. Prélèvements environnementaux (surfaces, ...).
4. En pratique
Selon l'organisation, l'équipe opérationnelle d'hygiène hospitalière demande au laboratoire de microbiologie l'édition de la liste des patients chez lesquels au moins une souche de SARM a été isolée dans l'année au sein d'un prélèvement à visée diagnostique.
Un patient n'est compté qu'une seule fois dans l'année. Le nombre de patients est égal au numérateur de l'indicateur à inscrire dans la case du bilan des activités de lutte contre les infections nosocomiales 2005 : Nombre de patients hospitalisés chez lesquels au moins une souche de SARM a été isolée dans l'année au sein d'un prélèvement à visée diagnostique.
ANNEXE 9 : Analyse bibliographique sur les coûts induits par les infections nosocomiales - Fiches de lecture
|
Titre : Les coûts de la qualité et de la non-qualité des soins dans les établissements de santé : état des lieux et propositions Institution émettrice : CCECQA / ANAES / service évaluation économique Année : Juillet 2004 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : analyse bibliographique
Pays étudié : France et international
Coûts analysés :
Coût d'investissement dans la lutte contre les infections nosocomiales
Coût de survenue d'une infection nosocomiale
Les coûts sont exprimés en euro (application du taux de change du 3 juillet 2004)
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
La revue de la Littérature a été réalisée à partir de bases de données bibliographiques automatisées et de bases de données nationales.
Ont été sélectionnés les travaux publiés entre 1990 et 2003 en français ou en anglais se plaçant dans la perspective économique des établissements de santé.
Ont été écartés les travaux pour lesquels les méthodes d'évaluation des coûts n'étaient pas précisées.
DÉFINITIONS :
Les coûts de prévention de qualité de soins :
Ils sont constitués de l'ensemble des coûts de toute activité ou intervention visant à améliorer la qualité des soins (formation du personnel, activité des équipes qualité, démarche qualité, diffusion de recommandations de pratique clinique ou de protocoles, achat de matériel et d'équipement dédiés spécifiquement à la prévention des défauts de qualité des soins).
Une distinction est faite entre :
les interventions réglementaires imposées par la loi,
les interventions non réglementaires mises en place à l'initiative des professionnels des établissements de santé.
Les coûts des mesures des défauts de la qualité des soins :
Il sont composés de l'ensemble des coûts des systèmes de signalement des évènements indésirables, des audits cliniques et autres interventions d'évaluation interne ou externe des défauts de qualité des soins.
Les coûts liés directement aux défauts de qualité des soins (ou non-qualité) et à leur correction :
Les défauts de qualité des soins ou non-qualité se répartissent en sous-utilisation des ressources, sur utilisation des ressources ou défauts de réalisation d'un soin adéquat entraînant un évènement indésirable évitable.
RÉSULTATS ET DONNÉES CHIFFRÉES :
L'extrapolation des coûts des infections nosocomiales évitables en réanimation, par an en France, réalisée à partir des données de fréquence et des coûts de défauts de qualité des soins disponibles, aboutit à une fourchette très large : entre 23 (Garo et al.,1995) et 200 millions d'euros (Brun-Buisson et al.), en fonction des hypothèses suivantes : de l'ordre de 265 000 séjours annuels en réanimation, incidence des IN de l'ordre de 13%, taux d'évitabilité de 20% et coût moyen de 3 400 euros (Garo et al.) à 35 185 euros (Brun-Buisson et al.).
Le coût de la non-qualité
Dix études internationales 28 ( * ) ont été analysées : deux études américaines, trois anglaises, une chinoise, une israélienne, une espagnole, une allemande et une australienne publiées entre 1990 et 1995.
Cinq de ces études ont étudié les infections nosocomiales (tout type confondu), trois études les bactériémies, une étude les infections de plaie et une étude les pneumopathies de ventilation.
Huit de ces études ont utilisé la méthode de la comparaison appariée et deux la comparaison ajustée.
Le coût moyen d'une infection nosocomiale est estimé entre 588 € (toute infection) et 35 022 € (bactériémie) : consommation de soins et coûts des séjours
Le coût moyen par patient a été estimé à 4 503 € et 6 332 € dans un service d'orthopédie en Grande Bretagne.
Les bactériémies et les pneumopathies sont les infections nosocomiales les plus coûteuses.
Le surcoût lié aux infections nosocomiales est principalement dû à l'augmentation de la durée de séjour et au traitement antibiotique.
Six études françaises 29 ( * ) ont été analysées : deux études ont travaillé sur l'ensemble des infections nosocomiales, une étude s'est intéressée aux staphylocoques méticilline-résistants dans les services de réanimation, deux études aux septicémies et/ou aux pneumopathies de ventilation en service de réanimation, une étude aux infections urinaires en service de médecine, urologie et gériatrie.
Quatre de ces études ont pris en compte les coûts directs, une les coûts directs et indirects et une a valorisé les coûts à partir de la durée de séjour.
Trois de ces études ont réalisé des comparaisons appariées, deux des comparaisons ajustées et une étude a réalisé une estimation directe.
Les Résultats : le coût est estimé entre 383 € en moyenne pour une infection urinaire et 26 256 € à 35 185 € pour une septicémie en réanimation.
La majeure partie du surcoût est due à l'augmentation de la durée de séjour, valorisée entre 920 et 25 000 €.
Conclusion : Les données de coûts sont peu nombreuses en France et fondées sur des travaux monocentriques : les études diffèrent par type de service inclus, type d'infection prise en compte et par mode de valorisation des coûts.
Le coût de la prévention
Deux études internationales (Jarvis et al., 1996 et mehtar et al., 1995) ont été retenues (une étude américaine de 1996 et une étude anglaise de 1995).
Le coût de l'intervention est estimé par une comparaison entre les économies générées et le coût de l'intervention. Le coût annuel d'un programme de prévention des infections nosocomiales est estimé à 86 974 € (étude américaine). Le coût de prévention des infections à staphylocoques méticilline-résistants est de 682 € par porteur (étude anglaise).
Le retour sur investissement des interventions de prévention des infections nosocomiales est jugé favorable par les deux études :
à partir d'un seuil minimal d'efficacité de 6% pour l'étude américaine,
le coût de l'infection nosocomiale est 6 fois supérieur à celui de la prévention estimé dans l'étude anglaise (4 463 € par IN).
Deux études françaises ( Chaix et al., 1999 et Bientz et al., 1994) ont montré un retour sur investissement positif de la mise en place des mesures de prévention des infections nosocomiales :
Le coût d'une infection à staphylocoques méticilline-résistants a été estimé à 9 009 € alors que celui du programme de prévention était de 1 438 € par patient (Chaix et al., 1996) ;
Le coût des infections urinaires est estimé en moyenne à 383 €, la campagne de prévention (avec un taux de réduction de 43% des infections) a permis des économies de 922 729 € pour un coût de 45 329 € (Bientz et al., 1994).
LIMITES :
L'étendue des fourchettes montre la faible précision des estimations possibles à partir des données de la littérature
|
Titre : Economic impact of healthcare associated rotavirus infection in a pediatric hospital Auteurs : E Piednoir, K Bessaci, F Bureau-Chalot, P Sabouraud, V Brodard, L Andréoletti, O Bajolet Revue : the journal of hospital infection, 55(3), 190-195 Année : 2003 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : analyse prospective, étude de deux cohortes (enfants admis de décembre 2001 à mars 2002) appariées (23 cas - 23 témoins) avec ajustement
Pays étudié : France
Coûts analysés : coût moyen par enfant ayant contracté une gastro-entérite (rotavirus)
Les coûts sont exprimés en euro de l'année courante (mars 2002).
Les coûts sont estimés du point de vue de l'établissement.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
L'ajustement des variables pour la constitution des couples cas - témoins :
L'ajustement se fait sur le motif de l'admission, la date d'entrée (+ ou - 7 jours), l'âge, le sexe, la durée de séjour et le nombre de diagnostics posés.
Définitions :
Infection nosocomiale : infection se manifestant au moins 48h après l'admission
Description de la cohorte :
La cohorte a été construite à partir des enfants âgés de 1 à 2 ans admis dans une unité de 23 lits au CHU de Reims.
Les coûts estimés :
Les coûts estimés sont répartis en 4 catégories :
Les coûts médicaux estimés selon la méthode de Haley (Haley et al., 1991) ;
Les coûts de la prévention, constitués des procédures d'isolement ;
Les coûts de personnel ;
Les coûts fixes.
Le coût journalier de l'isolement a été estimé à partir de l'observation de 10 patients isolés pendant 24 heures (micro costing). Le coût journalier est appliqué au nombre de journées d'isolement.
Les coûts de personnels sont estimés à partir du nombre d'heures de travail de chaque membre de l'équipe auquel les auteurs appliquent le taux de salaire horaire fourni par l'administration de l'établissement.
Les coûts fixes sont ceux du service selon la comptabilité analytique de l'établissement.
RÉSULTATS ET DONNÉES CHIFFRÉES :
La durée de séjour moyenne supplémentaire chez les enfants ayant contracté l'infection nosocomiale est de 4,9 jours .
Le coût moyen supplémentaire dû à une infection nosocomiale est de 1 930 €. (3 097 € pour les patients infectés contre 1 167 € pour les patients sains).
Le coût dû à l'augmentation de la durée de séjour est le plus important.
Une étude autrichienne estimait le coût supplémentaire dû à l'infection nosocomiale à 1 494 €.
Le coût d'une salmonellose serait de 1 825 €.
Le coût moyen national des gastro-entérites nosocomiales (rotavirus) serait (extrapolation) compris entre 24,2 millions d'euro et 121 millions d'euro.
LIMITES :
La durée d'observation de l'étude (3 à 4 mois) est très brève et le nombre de cas sur lesquels les coûts sont estimés est faible (23 cas).
|
Titre : The costs of septic syndromes in the intensive care unit and influence of hospital acquired sepsis Auteurs : C. Brun-Buisson, F. Roudot-Thoraval, E. Girou, C. Grenier-Sennelier, I. Durand-Zaleski Revue : Intensive care med, 29(9), 1464-1471 Année : 2003 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : analyse du coût des syndromes septiques à partir de l'étude prospective d'une cohorte de 224 patients admis entre mai 1997 et avril 1998.
Pays étudié : France
Coûts analysés : coûts directs
Les coûts sont exprimés en euro de l'année 2001.
Les coûts sont estimés du point de vue de l'établissement.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
Définitions :
Infection nosocomiale : infection acquise au moins 48 heures après l'admission en soins intensifs
Les infections étudiées sont :
Les syndromes septiques (87 patients)
Les syndromes septiques sévères (81 patients)
Les chocs septiques (56 patients).
Description de la cohorte :
La cohorte est construite à partir des admissions dans un service de 26 lits de soins intensifs de l'hôpital Henri Mondor.
Les critères d'inclusion dans la cohorte sont d'avoir un diagnostic de syndrome septique à l'admission en soins intensifs ou durant le séjour (48 heures après l'admission dans le service).
Méthodologie d'évaluation des coûts :
Les auteurs utilisent un modèle de valorisation conçu et testé par Chaix et al. ( Chaix et al.,1999 ).
La valorisation est réalisée à partir des données collectées pour chaque patient de toutes les ressources consommées (fluides, médicaments, produits sanguins et procédures).
Le volume du niveau de consommation de chaque patient est estimé à partir du score Oméga et à partir des durées de séjour.
Les coûts fixes sont les coûts du service fournis par la comptabilité analytique de l'établissement.
RÉSULTATS ET DONNÉES CHIFFRÉES :
127 patients présentaient un syndrome septique à l'admission et n'ont pas contracté d'autre infection durant leur séjour en soins intensifs.
97 patients ont acquis un syndrome septique durant leur hospitalisation dans le service ; 46 d'entre eux ne présentaient aucune infection lors de l'admission.
Le coût total des patients ayant contracté une infection en soins intensifs est de 39 908 € pour les patients ayant un syndrome septique, de 42 132 € pour les syndromes septiques sévères et 44 851 € pour les chocs septiques.
Le coût par patient n'ayant contracté aucune infection est de 12 719 €.
Le coût du patient ayant acquis une infection durant le séjour en soins intensifs sans en présenter une lors de l'admission est de 41 006 € (surcoût de 28 287 €).
Le coût par patient admis avec une infection et qui n'en contracte pas d'autre durant son séjour est de 18 871 € (surcoût de 6 152 €).
Enfin, le coût d'un patient admis avec une infection et qui en contracte une autre durant son séjour est de 49 146 € (surcoût de 36 427 €).
LIMITES :
Le coût est estimé uniquement pour le séjour en soins intensifs. L'établissement est un CHU, on peut supposer que les patients qu'il accueille sont plus lourds que dans les centres hospitaliers.
|
Titre : Epidemiology and economic evaluation of severe sepsis in France: age, severity, infection site, and place of acquisition (community, hospital, or intensive care unit) as determinants of workload and cost Auteurs : Adrie C, Chaix Couturier C, de Lassence A, Meshaka P, Thuong M, Garrouste-Orgeas M, Timsit JF Revue : Journal of critical care, 20(1), 46-58 Année : 2005 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : analyse rétrospective d'une cohorte de 1 698 patients sur 3 années (1997 à 2000) dans 6 services de réanimation
Pays étudié : France
Coûts analysés : évaluation des coûts directs chez les adultes selon le site de l'infection, le mode d'acquisition, et la sévérité.
Les coûts sont exprimés en euro de l'année 2001.
Les coûts sont évalués du point de vue de l'établissement.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
La cohorte :
Elle est constituée de 1 698 personnes de plus de 16 ans hospitalisées plus de 48 heures.
Définitions :
Infection non nosocomiale : infection se manifestant avant 48 heures d'hospitalisation
Infection nosocomiale : infection se manifestant au moins 48 heures après l'hospitalisation mais avant l'admission en soins intensifs
Infection nosocomiale contractée en soins intensifs : infection se manifestant 48 heures après l'admission en soins intensifs
Les sites :
Pneumonie, péritonite, infection urinaire, obstruction pulmonaire chronique, bactériémie primaire, sites divers, multi-sites
Les coûts :
Les coûts sont évalués uniquement en soins intensifs.
Le coût total par patient est constitué des coûts médicaux, des coûts fixes et des coûts de personnel.
Les coûts médicaux par patient sont évalués en fonction du temps passé auprès de chaque patient. Cette évaluation prend en compte l'intensité des soins mesurée par l'indice Oméga.
Les coûts sont issus de la comptabilité analytique de l'établissement et de la répartition des coûts par service.
RÉSULTATS ET DONNÉES CHIFFRÉES :
Coût moyen par patient des infections nosocomiales par site :
Péritonite : 27 900 € (durée de séjour : 30 jours)
Multi-sites : 25 800 € (durée de séjour : 23 jours)
Exacerbation BPCO : 16 300 € (durée de séjour : 22 jours)
Infection urinaire : 18 500 € (durée de séjour : 21 jours)
La durée moyenne de séjour est au total de 23 jours.
Le coût moyen en soins intensifs était plus de deux fois supérieur chez les patients ayant une infection sévère (22 800 €) par rapport à ceux sans infection sévère (9 600 €).
Le coût moyen en soins intensifs des patients sans aucune infection était de 7 200 € (6 jours).
Le coût moyen en soins intensifs des patients ayant une infection nosocomiale non suivie par une infection contractée en soins intensifs était de 10 800 € (8 jours).
Le coût moyen en soins intensifs des patients ayant une infection nosocomiale suivie par une infection contractée en soins intensifs était de 36 600 € (26 jours).
Le coût moyen en soins intensifs des patients sans infection nosocomiale ayant contracté une infection en soins intensifs était de 32 700 € (19 jours).
Le coût moyen en soins intensifs des patients ayant une infection non nosocomiale est significativement inférieur à celui des patients ayant une infection nosocomiale.
Le coût moyen augmente significativement avec l'âge (maximum pour la classe d'âge 60 - 64 ans) et le nombre d'organes « en dysfonctionnement ».
LIMITES :
L'hypothèse posée sur les durées de séjour (plus de 48 heures) induit des taux de mortalité plus faibles ce qui peut influer sur les coûts.
Les six services de soins intensifs sont à Paris ou en région parisienne, quatre sont des CHU (AP-HP) ; la gravité des patients n'est certainement pas représentative des centres hospitaliers de taille moyenne.
L'estimation des coûts est réalisée uniquement pour le séjour en soins intensifs, pas sur l'ensemble du séjour.
|
Titre : Cost of Endemic Methicillin-Resistant Staphylococcus Aureus : A Cost Benefit Analysis in an Intensive Care Unit Auteurs : C Chaix, I Durand-Zaleski, C Alberti, C Brun Buisson Revue : JAMA, 282(18), 1745-1751 Année : 1999 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : analyse rétrospective d'une étude de deux cohortes (patients admis en réanimation dans un centre hospitalier universitaire (Henri Mondor) français entre janvier 1993 et juin 1997) appariées (25 cas - 25 témoins) avec ajustement des variables.
Pays étudié : France
Coûts analysés : comparaison du coût supplémentaire attribuable à un staphylocoque au coût du programme de prévention.
Les coûts sont exprimés en $ (conversion par rapport au franc de 1997 au taux de 1 franc = 1,5 $).
Les coûts sont estimés du point de vue de l'établissement.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
Le taux de prévalence des staphylocoques à l'admission en réanimation est de 4% à l'hôpital Henri Mondor.
Est considérée comme infection nosocomiale toute infection contractée au moins 72 heures après l'admission en réanimation.
L'ajustement des variables pour la constitution des couples cas - témoins :
L'ajustement se fait sur l'âge, le sexe, la sévérité de la maladie, selon la classification de McCabe et Jackson, le score de physiologie aigu et le nombre d'organes en défaillance à l'admission en réanimation.
Chaque individu du groupe témoin a une durée de séjour au moins aussi longue que le cas.
Les coûts ne sont estimés que pour la durée de séjour en réanimation.
L'estimation des coûts dus à l'infection :
L'intensité des soins est mesurée à partir du score Oméga.
Le score Oméga considère 47 diagnostics ou procédures thérapeutiques qu'il classifie en 3 catégories :
• Procédures recensées une seule fois durant le séjour en réanimation (Oméga 1)
• Procédures recensées à chaque fois qu'elles sont réalisées (Oméga 2)
• Procédures recensées quotidiennement (Oméga 3)
L'estimation des coûts médicaux par patient a été réalisée à partir d'un modèle développé par les auteurs. Cette estimation est réalisée hors coûts de personnels et frais généraux.
Le coût médical est calculé selon l'équation suivante :
Cm=45 (oméga 1) + 106 (oméga 2) + 16 (oméga 3) + 4 703 K +191.
K est une variable muette qui renseigne sur la réalisation ou pas d'une intervention chirurgicale durant le séjour en réanimation.
Les coûts de personnels et les frais généraux ont été estimés à partir de la comptabilité analytique de l'établissement. Ces coûts sont des coûts journaliers.
Le coût supplémentaire attribuable au staphylocoque est la différence entre ce coût entre les cas et les témoins.
L'estimation des coûts de la prévention :
L'estimation a été réalisée à partir de l'observation sur une période de 3 mois (janvier à mars 1997).
L'estimation est réalisée à partir des coûts médicaux en réanimation, qui incluent tous les coûts de fournitures et les produits utilisés du fait de l'isolement du patient.
Les fournitures sont valorisées à partir du prix d'achat.
Le coût journalier infirmier est valorisé à partir du salaire brut moyen annuel d'une infirmière (27$ de l'heure) appliqué au nombre d'heures passées par jour auprès du patient.
La valorisation du coût médical est réalisée selon la même méthode sur la base de 41$ de l'heure.
Le coût de la chambre d'isolement est estimé à partir du coût de construction avec une hypothèse d'amortissement sur 10 ans.
RÉSULTATS ET DONNÉES CHIFFRÉES :
Il n'y a pas différence significative entre les cas et les témoins sur les variables d'ajustement.
Le taux de mortalité est significativement supérieur chez les cas par rapport aux témoins.
La durée médiane de séjour est de 18 jours chez les cas (21 jours si l'on écarte les patients décédés) contre 14 jours pour les témoins (respectivement 12,5 jours). La différence de séjour (4 jours) est significative si l'on considère l'ensemble des cas et des témoins.
Le coût moyen des témoins est de 20 950 $ contre 30 225 $ pour les cas ; le coût supplémentaire du au staphylocoque est donc de 9 275$.
Le coût moyen par patient de l'isolement est estimé entre 655 $ et 705 $ pour des séjours d'en moyenne 20 jours en réanimation.
Les mesures d'isolement ont un ratio « coûts/bénéfices » favorable si le taux de staphylocoques diminue de 14%.
LIMITES :
L'estimation n'est réalisée qu'à partir d'un seul site.
L'estimation des coûts ne porte que sur la partie du séjour en réanimation.
|
Titre : The Impact of Nosocomial Infections on Hospital Care Costs Auteurs : F.N. Lauria, C. Angeletti Revue : Infection 31. 2003. Supplement 2 Année : 2003 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude :
Analyse bibliographique des études des coûts additionnels dus aux infections nosocomiales,
Etude coût efficacité des mesures de prévention des infections nosocomiales
Pays étudié : International
Coûts analysés :
Coût d'investissement dans la lutte contre les infections nosocomiales
Coût de survenue d'une infection nosocomiale
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
Méthodologie des analyses de coûts :
Les principaux postes de coûts associés aux infections nosocomiales, variables selon les services et la localisation de l'infection sont :
Les soins infirmiers (42%)
Les frais généraux des hôpitaux, frais de structure et de gestion (33%)
Les coûts directs étaient principalement composés de :
L'augmentation de la durée de séjour,
Le coût des médicaments,
Les procédures médicales et chirurgicales.
Estimés rarement, les coûts indirects incluent les pertes de salaires, le temps perdu et le handicap.
Les méthodologies d'estimation de l'augmentation des durées de séjours :
4 méthodologies sont utilisées :
A dires d'experts (les médecins)
Comparaison de groupes sans ajustement
Comparaison de groupes avec ajustement
La méthode AEP développée par Wakefield et al.
La méthode Appropriateness Evaluation Protocol (AEP) est une méthode standardisée qui évalue l'adéquation entre les admissions et la durée de séjour. Cette méthode pose comme hypothèse que toutes les informations médicales nécessaires sont contenues dans les données médicales recensées (informations relatives au motif de l'admission et informations relatives aux infections nosocomiales). Cette méthode aboutit à des estimations de l'augmentation de la durée de séjour induite par les infections nosocomiales moins importantes que les autres méthodologies.
Les méthodologies d'évaluation des coûts additionnels associés aux infections nosocomiales :
Pour évaluer les coûts des infections nosocomiales en Grande Bretagne, Plowman et al. ( Plowman et al., 2001 ) ont utilisé un modèle de régression linéaire de façon à identifier les variations de ressources et des coûts imputables aux infections nosocomiales ; leur estimation a été réalisée sur un échantillon de 3 980 patients. Ils ont estimé le coût journalier d'une hospitalisation en Grande Bretagne, qu'ils ont appliqué à la durée de séjour de chaque patient infecté.
Hollenbeack et al. ( Hollenbeack et al., 2002 ) ont estimé le coût des infections nosocomiales à la suite de la pose d'un stent coronaire en utilisant 4 méthodologies différentes. La première méthodologie qui consiste en l'analyse de deux cohortes appariées (cas - témoins) sans ajustement aboutit à un coût additionnel des infections nosocomiales de 20 012 $ par patient . La deuxième méthodologie, l'analyse de deux cohortes appariées (cas - témoin) avec ajustement sur les variables (âge, sexe, diabète, insuffisance rénale, durée de l'intervention) aboutit à un coût additionnel des infections nosocomiales de 20 445 $ par patient . L'estimation par une analyse de régression (troisième méthodologie), qui tenait compte de davantage de variables (gravité de la maladie, durée de l'intervention, sexe, obésité, infarctus, insuffisance cardiaque congestive, diabète, nouvelle exploration pour saignement et utilisation d'un ballon aortique) aboutit à un coût additionnel des infections nosocomiales inférieur : 19 311 $ par patient . Enfin, ils ont appliqué la méthode d'Heckman qui aboutit à un coût additionnel nettement inférieur de 14 211 $ par patient.
RÉSULTATS ET DONNÉES CHIFFRÉES :
Aux Etats-Unis le coût des traitements des infections nosocomiales a été estimé à plus de 4,5 milliards de $ en 1992 (pas de référence).
En Grande-Bretagne le coût annuel des infections nosocomiales a été estimé à 930,62 millions de £ ( Plowman et al., 2001 ).
En Italie le poids des infections nosocomiales est estimé à 1,03% du coût total du système national de santé (pas de référence).
En Italie, une étude rétrospective de cohorte a évalué l'augmentation de la durée de séjour due à une infection nosocomiale à 15 413 € par patient. Le coût additionnel du traitement par patient est estimé à 943 €, portant le coût total par patient à 16 356 € ( Orsi et al., 2002 ).
Le Duke University Medical Center a estimé l'augmentation de la durée de séjour due à une infection sur site opératoire ( orthopédie ) à deux semaines (médiane) par patient ( Whitehouse et al., 2002 ).
Des études ont montré un coût additionnel dû à une infection locale chez des patients ayant un cathéter d'environ 400 $ et un coût additionnel dû à une infection nosocomiale (bactériémie) chez des patients ayant un cathéter compris entre 6 005 $ et 9 738 $ ( Saint et al., 2002 ).
Le Duke University Medical Center a estimé le coût médian d'une infection nosocomiale (staphylocoques sensibles à la méticilline) à 9 661 $ contre 27 083 $ pour les staphylocoques méticilline-résistants ( Abramson et al., 1999 ).
Une analyse bibliographique recensant les études menées entre 1990 et 2000 a montré que les infections du sang ( coût moyen de 38 703 $) et les staphylocoques méticilline-résistants ( coût moyen de 35 367 €) étaient les infections nosocomiales les plus coûteuses ( Stone et al., 2002 ).
L'évaluation du coût des infections nosocomiales en Italie :
Les auteurs utilisent les résultats des estimations de l'augmentation des durées de séjours de plusieurs études ( Pittet et al., 1994 et Wenzell et al., 1989 ) :
10 à 14 jours pour les infections du sang
9 jours pour les pneumonies
2 à 5 jours pour les infections urinaires et les infections sur site opératoire
1 jour pour les autres types d'infection nosocomiale
L'étude (INF-NOS) sur la prévalence des infections nosocomiales dans 16 établissements de santé italiens a abouti à la répartition suivante des infections nosocomiales par type :
Les infections du sang représentent 8% des infections nosocomiales
Les infections des voies respiratoires 37%
Les infections urinaires 20%
Les infections sur site opératoire 13%
Les autres 22%
En utilisant les résultats de l'étude de Wenzel ( Wenzell et al., 1989 ) sur l'augmentation des durées de séjour et ceux de l'étude INF-NOS, les auteurs estiment que dans un établissement de 270 lits réalisant 3 600 admissions, avec un taux d'infection nosocomiale de 5%, le nombre de journées d'hospitalisation supplémentaires attribuables aux infections nosocomiales est de 1 417. En appliquant à ces journées d'hospitalisation les tarifs issus du système de paiement au DRG italiens, le coût des infections nosocomiales s'élève à 223 716 €.
Le coût du programme de prévention des infections nosocomiales (0,5 ETP médical, 2 ETP d'IDE, 0,25 ETP d'information, équipement) pour un établissement s'élève à 128 727 €.
LIMITES :
Dans l'estimation du coût des infections nosocomiales pour un établissement italien, seule l'augmentation de la durée de séjour est valorisée.
|
Titre : Hospital-acquired, laboratory-confirmed bloodstream infection: increased hospital stay and direct costs Auteurs : G. B. Orsi, L. Di Stefano, N. Noah Revue : Infection control and hospital epidemiology, 23(4), 190-197 Année : 2002 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : Etude rétrospective de trois cohortes (5 106 patients admis dans 8 services de chirurgie ou de soins intensifs entre janvier 1994 et juin 1995) appariées (105 cas - 105 témoins / groupe A - 105 témoins / groupe B) avec ajustement des variables.
Pays étudié : Italie
Coûts analysés : coûts directs dus à une infection nosocomiale (infection du sang)
Les coûts sont estimés en € (absence de précision sur le taux de conversion).
L'étude est réalisée du point de vue de l'établissement.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
Le groupe témoin (A) est constitué pas à pas, selon 6 variables de contrôle (la durée de séjour, le diagnostic d'entrée, le service d'hospitalisation, la présence d'un cathéter central, l'âge, et le sexe), avec un score de 25 points.
Le groupe témoin (B) est constitué avec 5 variables d'ajustement (la durée de séjour en moins).
Services concernés par l'étude :
3 services de chirurgie générale
1 service de chirurgie thoracique
1 service de chirurgie vasculaire
1 service de neurotraumatologie
1 service de soins intensifs
1 service de chirurgie cardiovasculaire
Etait considérée comme une infection nosocomiale, toute infection contractée au moins 48 heures après l'admission.
L'ensemble des données nécessaires a fait l'objet d'une collecte spécifique.
Estimation de l'augmentation des durées de séjour :
La différence entre la durée de séjour des témoins et de celle des cas était calculée uniquement sur la période d'hospitalisation dans les unités concernées par l'étude, et pas sur l'ensemble du séjour hospitalier.
Estimation des coûts :
L'estimation des coûts directs n'a été réalisée que pour le groupe témoin A et correspondait à la durée de séjour et au traitement.
Le coût journalier a été fourni par les services administratifs de l'établissement, il couvre l'ensemble des coûts hôteliers mais également le temps médical et paramédical.
Le coût de l'augmentation de la durée de séjour a été estimé en multipliant le nombre de jours d'hospitalisation supplémentaires par le coût d'une journée d'hospitalisation. Le coût journalier est estimé à 400 € dans un service de chirurgie et 1 200 € dans un service de soins intensifs.
Le coût du traitement est estimé à partir du prix d'achat de la thérapie antibiotique relative à l'infection (prix payé par l'hôpital pour acheter le médicament : 50% du prix de l'industrie).
RÉSULTATS ET DONNÉES CHIFFRÉES :
Sur les 105 cas, 83 présentaient une infection nosocomiale (bactériémie), 19 une infection du sang liée à la pose d'un cathéter, et 22 une infection secondaire.
La qualité de l'ajustement a été contrôlée, 60 paires sur 105 étaient ajustées à 100% dans le groupe A et 89 dans le groupe B.
Le nombre moyen de jours d'hospitalisation supplémentaires était de 15,7 jours par rapport au groupe A et 18,7 jours par rapport au groupe B en soins intensifs.
L'augmentation de la durée de séjour est plus importante en chirurgie : respectivement 24,6 pour le groupe A et 21,9 pour le groupe B.
Tous services confondus, l'augmentation de la durée de séjour des cas était de 19,1 jours par rapport au groupe A et 19,9 jours par rapport au groupe B.
Le coût supplémentaire attribuable à l'infection nosocomiale (durée de séjour uniquement) est de 15 413 € par patient par rapport au groupe témoin A. Le surcoût par patient en soins intensif est presque le double par rapport à celui de la chirurgie : 18 849 € contre 9 380 €.
Le surcoût des antibiotiques représente 5,6% du coût total de l'infection nosocomiale (943 € par patient) ; il est plus important dans les services de chirurgie (1 224 €) que dans les services de soins intensifs.
Le surcoût total de l'infection nosocomiale est estimé à 16 356 € sur l'ensemble des services, à 19 620 € en soins intensifs et 11 054 € en chirurgie.
LIMITES :
La gravité de la pathologie n'est pas prise en compte dans l'ajustement des variables, or la gravité de la maladie peut peser sur les durées de séjour. L'estimation ne porte pas sur la totalité du séjour hospitalier.
|
Titre : Nosocomial pneumonia : a cost of illness analysis Auteurs : Dietrich ES, Demmler M, Schulgen G, Fekec K, Mast O, Pelz K, Daschner FD Revue : Infection, 30(2), 61-67 Année : 2002 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : étude prospective de deux cohortes (114 patients au total admis en soins intensifs entre mai 1998 et mars 1999), appariées (48 cas - 66 témoins) avec ajustement
Etude rétrospective de deux cohortes (89 patients au total admis en soins intensifs entre février 1997 et décembre 1998), appariées (45 cas - 44 témoins) avec ajustement.
Pays étudié : Allemagne
Coûts analysés : estimation des coûts directs supplémentaires attribuables aux pneumonies nosocomiales par patient et par jour.
Les coûts sont exprimés en DM de l'année courante (1999).
Les coûts sont estimés du point de vue de l'établissement.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
Description des cohortes :
L'étude prospective est réalisée sur :
1 service de soins intensifs de neurochirurgie
1 service de soins intensifs de neurologie
1 service de réanimation
2 services de soins intensifs médicaux
L'étude rétrospective n'a été réalisée que sur les services de soins intensifs de neurochirurgie et de neurologie.
Les critères d'inclusion étaient l'âge (supérieur à 16 ans), l'absence d'antécédents de pneumonies et la durée du séjour dans le service de soins intensifs supérieure à 48 heures.
Les critères d'exclusion étaient la survenue d'une pneumonie non nosocomiale, la neutropénie, la séropositivité et l'addiction à une drogue dure.
L'ajustement entre les cas et les témoins a été réalisé sur les variables suivantes : la gravité de la maladie, l'âge, les services de provenance du patient, le recours à l'assistance respiratoire, l'immunodépression, le sexe et la durée de l'hospitalisation avant l'admission en soins intensifs.
L'évaluation des coûts :
Les coûts suivants ont été comparés entre les cas et les témoins dans les deux études :
Coût du séjour hospitalier
Coût de l'assistance respiratoire (coût journalier multiplié par la durée)
Coût des soins
Coûts des examens biologiques et des traitements antibiotiques
Dans l'étude rétrospective, le nombre de jours d'hospitalisation supplémentaires a également été valorisé.
Dans l'étude prospective, l'ensemble des données a fait l'objet d'une collecte spécifique durant l'hospitalisation (30 jours au maximum).
Les données de coûts relatives au diagnostic, au traitement, aux soins dispensés (matériels et personnels) ont été introduites dans l'estimation.
RÉSULTATS ET DONNÉES CHIFFRÉES :
Etude prospective :
29 paires ont été évaluées après ajustement.
La durée moyenne de séjour en soins intensifs des patients ayant contracté une infection nosocomiale (pneumonie) est de 16,4 jours contre 9,83 jours pour les témoins.
Le coût des antibiotiques par patient et par jour infecté est de 44,42 DM contre 21,87 DM pour les témoins, soit un coût additionnel total par patient de 500 DM.
Le coût supplémentaire moyen par patient ayant contracté une pneumonie est de 14 606 DM dans l'étude prospective.
Etude rétrospective :
37 paires ont été évaluées après ajustement.
La durée moyenne de séjour des patients ayant contracté une infection nosocomiale (pneumonie) est de 22,76 jours contre 12,62 jours pour les témoins.
Le coût supplémentaire moyen par patient ayant contracté une pneumonie est de 29 610 DM dans l'étude rétrospective.
|
Titre : Costs associated with hospital-acquired bacteraemia in a Belgian hospital Auteurs : Pirson M, Dramaix M, Struelens M, Riley TV, Leclercq P Revue : The Journal of Hospital Infection, 59(1), 33-40 Année : 2005 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : analyse des coûts associés aux bactériémies nosocomiales dans un établissement de santé belge et extrapolation au système de santé national : année d'étude 2001
Etude rétrospective de deux cohortes de 1 344 patients appariées (46 cas - 1 308 témoins) avec ajustement.
Pays étudié : Belgique
Coûts analysés : estimation des coûts directs
Les coûts sont exprimés en euro de l'année 2001.
L'étude est réalisée du point de vue de l'établissement.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
L'étude est réalisée sur un établissement bruxellois de 278 lits qui a réalisé 8 169 séjours hospitaliers en 2001.
A été inclus dans l'étude l'ensemble des hospitalisations adultes à l'exception des patientes d'obstétrique.
Les services concernés par l'étude étaient : chirurgie générale et médecine générale, pédiatrie, psychiatrie, gériatrie, et services spécialisés : maladies chroniques, maladies cardiaques et pulmonaires, orthopédie et soins palliatifs.
Etait considérée comme une infection nosocomiale toute infection survenant au moins 48 heures après l'admission.
L'ajustement des deux cohortes a été réalisé en fonction du groupe homogène de malades.
Les données analysées :
Durée de séjour, score de sévérité, taux de mortalité, coût total, coût des médicaments, coûts des antibiotiques, coûts médicaux, et coûts médicaux spécifiques par service
L'Analyse des coûts :
Certains coûts ont été estimés ; d'autres ont fait l'objet d'un recensement.
Les coûts administratifs et généraux, les coûts médicaux et la durée de séjour pondérée par les charges médicales et de médicaments ont été estimés.
Le coût total par service était divisé par l'activité totale pour obtenir le coût unitaire.
Le coût total par patient est obtenu par la multiplication des quantités consommées par le coût unitaire.
Le coût des soins était identifiable par centre de coût et estimable pour chaque patient à partir de la durée de séjour (80% du coût), pondérée par les coûts des consommations médicales et de médicaments.
RÉSULTATS ET DONNÉES CHIFFRÉES :
Roberts R. et al ont estimé les coûts moyens supplémentaires induits par les infections nosocomiales à 15 275 $ par cas après ajustement des variables ( Roberts et al., 2003 ).
46 patients ont présenté une infection nosocomiale en 2001. Leur durée moyenne de séjour était de 34,6 jours contre 13,5 jours pour les non infectés. La durée moyenne de séjour en soins intensifs des cas était de 14,9 jours contre 7,7 jours pour les témoins.
Il existe une corrélation importante entre le degré de gravité de la maladie et l'incidence des infections nosocomiales.
Le coût moyen des cas était de 18 288 € contre 5 440 € pour les témoins. Le coût supplémentaire induit par les infections nosocomiales était donc de 12 853 € par patient.
Le coût moyen des cas admis en soins intensifs était de 29 285 € contre 17 842 € pour les témoins, soit un coût additionnel de 11 443 €.
Les augmentations de coûts les plus importantes ont été constatées pour les maladies de l'appareil digestif et les maladies vasculaires.
LIMITES :
La faiblesse du nombre de cas (46) limite la portée des résultats.
L'ajustement à partir des DRG semble contestable par rapport à un ajustement plus fin en fonction du degré de gravité et de l'âge.
|
Titre : Epidemiology and cost of nosocomial gastroenteritis Avon, England, 2002-2003 Auteurs : Lopman BA, Reacher MH, Vipond IB, Hill D, Perry C, Halladay T, Brown DW, Edmunds WJ, Sarangi J Revue : Emerging Infectious Diseases, 10(10), 1827-1834 Année : 2004 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : analyse du coût des gastroentérites « nosocomiales » sur une période d'une année
Pays étudié : Comté de Avon en Angleterre puis extrapolation à l'Angleterre
Coûts analysés : coût d'opportunité
Coûts directs : fermeture de lits et absence du personnel contaminé
Coûts indirects : perte de productivité des patients (arrêts maladie)
Les coûts directs ont été estimés du point de vue de l'établissement.
Les coûts sont exprimés en £ de l'année 2002 et convertis en dollars au taux de conversion suivant : 1 £ = 1,6 $.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
Etude de la comparabilité de la population du Comté de Avon à la population d'Angleterre (taux de mortalité standardisé sur l'âge toutes causes confondues, caractéristiques sociales et structure de la population).
L'analyse portait sur 4 centres hospitaliers de référence et 11 hôpitaux de proximité, soit un total de 2 900 lits avec un taux d'occupation moyen de 95,6% et de 171 unités médicales de 20 lits en moyenne.
L'ensemble du personnel médical et paramédical a été inclus dans la population cible.
Le diagnostic de gastroentérite « nosocomiale » était posé à partir d'une analyse virologique (analyse des selles) sur les 10 premiers patients et d'une analyse bactériologique sur les 3 premiers pour s'assurer de leur caractère « épidémique ».
Certains coûts directs n'ont pas été analysés ; il s'agit des annulations d'interventions, des procédures de désinfection supplémentaires, et de la prescription de médicaments.
Le coût des lits fermés et l'absence de personnel ont été estimés à partir des coûts unitaires de la santé 2002. L'hypothèse est posée pour estimer le coût de l'absence du personnel que le personnel est au grade moyen.
L'évaluation du coût des lits fermés pose comme hypothèse l'interdiction de réaliser une nouvelle admission dans une unité touchée ; vu le taux d'occupation (95,6%), il est considéré qu'il y a une perte d'activité systématique. Quant au personnel, il ne peut pas être réaffecté au risque de contaminer une autre unité.
La perte de productivité est évaluée à 5 jours pour chaque patient ; son coût est estimé à partir des salaires moyens du Bureau national de la Statistique.
RÉSULTATS ET DONNÉES CHIFFRÉES :
Les coûts directs :
69,6% des 227 « épidémies » ont abouti à l'interdiction de nouvelles admissions. Les unités étaient fermées pendant en moyenne 9,65 jours, ce qui se traduit par une perte de 5,443 journées par lit pour chaque épidémie.
Le coût de la fermeture des lits était d'approximativement 480 000£ (768 000 $) pour 1000 lits.
1 360 infections ont été dénombrées parmi le personnel. Le coût d'une journée d'absence est de 113£ (181 $). Le coût de contamination du personnel médical et non médical est estimé à 1,97 millions de £ (3,15 millions de $) pour 1000 lits.
Les coûts indirects :
Un total de 971 journées d'arrêt maladie des patients a été recensé, soit une perte de productivité estimée à 66 000 £ (106 000 $) pour 1000 lits.
LIMITES :
L'observation ne porte que sur une seule année ; or, il existe des pics dans le rythme des épidémies de gastro-entérites.
Le résultat économique dépend fortement de la taille des unités médicales (plus elle est importante, plus le coût économique est important)
|
Titre : The rate and cost of hospital-acquired infections occurring in patients admitted to selected specialties of a district general hospital in England and the national burden imposed Auteurs : R Plowman, N Graves, MAS Griffin, JA Roberts, AV Swan, B Cookson, L Taylor Revue : The Journal of Hospital infection, 47(3), 198-209 Année : 2001 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : analyse prospective d'une étude de cohorte (4 000 patients admis dans un centre hospitalier entre avril 1994 et mai 1995).
Pays étudié : Angleterre
Coûts analysés : analyse du coût supplémentaire attribuable aux infections nosocomiales.
Extrapolation du coût à l'Angleterre.
Les coûts sont exprimés en £ de l'année courante.
Les coûts sont estimés du point de vue de l'établissement.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
L'estimation des coûts :
L'estimation de la valeur des ressources consommées par chaque patient a été réalisée selon les méthodes utilisées dans une étude précédente (Plowman et al., 1999).
Les coûts sont classés selon plusieurs catégories : le coût d'occupation d'un lit (frais généraux, charges de gestion et de structure), le coût des soins et traitements spécifiques, ...
L'estimation des ressources consommées se fait à dire d'experts (chef de service et personnel paramédical).
Un coût journalier par lit a été estimé pour chaque spécialité et appliqué à la durée de séjour de chaque patient.
Un coût médical journalier a été calculé pour chaque spécialité et appliqué à la durée de séjour de chaque patient.
L'estimation a été réalisée selon un modèle de régression linéaire, avec les variables suivantes : âge, sexe, diagnostic, nombre de co-morbidités, spécialité d'admission, type d'admission.
L'extrapolation des coûts :
N : nombre d'admissions en Angleterre
C : le coût de prise en charge d'un patient non infecté
i : le taux d'incidence des infections nosocomiales
r : le ratio estimé de coût : infection nosocomiale/patient non infecté
Le surcoût national des infections nosocomiales est : NiC(r-1)
RÉSULTATS ET DONNÉES CHIFFRÉES :
Sur les 4 000 patients, 309 ont contracté une infection nosocomiale.
Le coût moyen pour un patient ayant contracté une infection nosocomiale (tous types confondus) est 4 782£ contre 1 628£ pour les patients non infectés, soit un coût 2,9 fois supérieur (coût supplémentaire de 3 154£) .
Le coût supplémentaire induit par les infections nosocomiales est le plus faible en obstétrique (césariennes) : le coût moyen des patientes ayant acquis une infection nosocomiale est de 2 761£ contre 2 481£ pour les patientes saines, soit un coût 1,1 fois supérieur (coût supplémentaire de 280£).
Le coût supplémentaire induit par les infections nosocomiales est le plus important en chirurgie ; le coût moyen d'un patient ayant acquis une infection nosocomiale est de 6 189£ contre 1 290£, soit un coût 4,8 fois supérieur (coût supplémentaire de 4 898£).
La durée moyenne de séjour supplémentaire attribuable aux infections nosocomiales est de 14,1 jours ; un patient ayant une infection nosocomiale est hospitalisé en moyenne 21,7 jours contre 7,6 jours pour un patient « sain », soit un ratio de 2,9.
La durée moyenne de séjour supplémentaire la plus faible attribuable aux infections nosocomiales est observée en obstétrique (césarienne), elle est de 1,2 jour ; une patiente ayant une infection nosocomiale est hospitalisée en moyenne 8,6 jours contre 7,6 jours pour les patientes saines (ratio de 1,2).
La durée moyenne de séjour supplémentaire la plus importante attribuable aux infections nosocomiales est observée en gériatrie, elle est de 23,5 jours ; un patient ayant une infection nosocomiale est hospitalisé en moyenne 34,7 jours contre 11,3 jours pour les patients non infectés (ratio de 3,1).
L'extrapolation aboutit à 320 994 infections nosocomiales en Angleterre (tous types confondus) qui coûteraient 930,62 millions de £, et seraient à l'origine de 3,64 millions de jours d'hospitalisation supplémentaires.
LIMITES :
L'extrapolation est réalisée à partir d'une étude monocentrique (l'établissement considéré n'a pas des caractéristiques significativement différentes des autres établissements britanniques).
|
Titre : Adverse impact of surgical site infections in english hospitals Auteurs : R. Coello, A. Charlett, J. Wilson, V. Ward, A. Pearson, P. Borriello Revue : Journal of Hospital Infection, 60, 93-103 Année : 2005 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : calcul de l'incidence des ISO et de la mortalité liée à une ISO dans 140 hôpitaux anglais, avec une étude des conséquences en termes de prolongation des séjours et de coûts
Pays étudié : Grande Bretagne
Coûts analysés :
Les coûts sont exprimés en £
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
Définitions : Les ISO étaient stratifiées selon l'index de risque américain NNIS qui classe de 0 à 3 le risque d'acquérir une ISO ; les classes 2 et 3 ont été combinées pour avoir un nombre de patients suffisant. Les infections ont été classées selon le type de l'incision : superficielle, profonde et touchant un organe ; les 2 dernières catégories ont été combinées. ISO acquis sur une période de : immédiatement après l'intervention jusqu'à 30 jours après l'intervention (mais pour des prothèses, 120 jours sont requis)
Les infections étudiées : ISO après amputation d'un membre inférieur, interventions vasculaires et sur artères coronaires, prothèses de hanche et de genou, réduction de fracture d'un os long, hystérectomie, intervention colique
Description de la cohorte : données provenant de 140 hôpitaux entre octobre 1997 et juin 2001 où au moins 10 procédures chirurgicales ont lieu et au moins 500 interventions dans une catégorie donnée ont eu lieu, ce qui a conduit à éliminer certaines interventions comme les interventions sur le pancréas, le foie...
Méthodologie d'évaluation des coûts : Le coût additionnel lié à une ISO est calculé en fonction de l'augmentation de la durée de séjour du patient ayant acquis une ISO. Ce calcul est basé sur une étude précédente réalisée en Angleterre durant les années 1995 - 1996 (Plowman et al., 2001) où un coût moyen avait été évalué à 1 594£ avec une augmentation de durée de séjour de 7,1 jours. Compte tenu d'un ajustement en fonction de la catégorie d'établissements, le ratio s'établissait à 290,60£ par jour supplémentaire lié à l'ISO. Ce coût a été multiplié, pour chaque type d'intervention, par le nombre moyen de jours supplémentaires trouvés dans la présente étude.
RÉSULTATS ET DONNÉES CHIFFRÉES :
12 catégories d'intervention chirurgicales ont été retenues. 67 410 interventions chirurgicales enregistrées et 2 832 ISO ont été rapportées par les 140 hôpitaux impliqués.
Les patients ayant acquis une ISO ont tous une augmentation de durée de séjour allant de 21 jours pour une amputation (sans ISO, la moyenne de durée de séjour est de 13,2 jours) à 3,3 jours pour une hystérectomie (sans ISO, la moyenne de durée de séjour est de 5,1 jours) ; les autres interventions ont une durée additionnelle de séjour d'une douzaine de jours.
Le coût attribuable à l'ISO varie ainsi de 6 103£ pour une amputation à 959£ pour une hystérectomie, les autres interventions se situant aux alentours de 3000£. Les données classées selon la localisation de l'ISO (superficielle / profonde) montrent que la durée de séjour augmente pour les ISO profondes pour toutes les interventions chirurgicales sauf pour les amputations. Le plus fort coût additionnel concerne les ISO profondes sur prothèse de hanche (6 626£) ; le coût tend à presque doubler quand les ISO sont de localisation profonde, ce qui correspond à un doublement de la durée de séjour.
Cette variation des conséquences de l'ISO selon le type d'intervention peut permettre d'établir des priorités en matière de surveillance et de mesures de prévention.
Limites :
Il est important d'estimer également le volume global des interventions chirurgicales avec ISO car une intervention chirurgicale très fréquente, avec un taux d'ISO bas, peut être plus coûteuse qu'une opération rare, avec une forte incidence d'ISO.
|
Titre : Attributable cost of nosocomial primary bloodstream infection in pediatric intensive care unit patients Auteurs : Elward AM, Hollenbeak CS, Warren DK, Fraser VJ Revue : Pediatrics, 115(4), 868-872 Année : 2005 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : analyse prospective d'une cohorte de 911 patients admis dans un service de soins intensifs pédiatriques de l'Hôpital pour Enfants de Saint-Louis (235 lits).
Période d'étude : du 1 er septembre 1999 au 31 mai 2000.
Pays étudié : Etats Unis
Coûts analysés :
Les coûts sont exprimés en $ de l'année courante
Les coûts directs sont analysés du point de vue de l'établissement.
Coûts directs
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
Description de la cohorte :
Les critères d'exclusion de la cohorte étaient : un âge supérieur à 18 ans, le décès dans les 24 heures suivant l'admission en soins intensifs, l'admission dans le service de soins intensifs non pédiatrique.
Le service de soins intensifs pédiatriques comptait 22 lits au début de l'étude et 28 à partir d'avril 2000. Le nombre moyen d'admissions par an est de 1 400. Le ratio personnel - patient est de 2 pour 1.
Est considérée comme infection nosocomiale toute infection objectivée par test sanguin et contractée au moins 48 heures après l'admission dans le service de soins intensifs.
Les auteurs ont mené une régression linéaire multiple pour déterminer les variables explicatives potentielles des coûts : sévérité de la maladie, maladie pulmonaire chronique sous-jacente, maladie cardiaque congénitale, transplantation, journées d'assistance respiratoire, et âge.
Analyse des coûts :
Base de données utilisée : système de comptabilité analytique de l'hôpital qui utilise des ratios coûts / facturations.
RÉSULTATS ET DONNÉES CHIFFRÉES :
Des études estiment le surcoût induit par les infections nosocomiales primaires chez les patients adultes en soins intensifs à 40 000 $ (Pittet et al., 1994).
Dominguez et al. ont suivi en prospectif deux cohortes appariées pour estimer le coût total moyen d'une complication infectieuse en soins intensifs pédiatriques ; ils aboutissent à une estimation de 50 362 $ (Dominguez et al., 2001). L'ajustement des deux cohortes cas-témoins reposait sur les variables suivantes : catégorie de diagnostic, durée de séjour et risque de mortalité pédiatrique. Les résultats de cette étude sont limités par la faiblesse du nombre de patients inclus (23).
Slonim et al ont mené une étude similaire ; l'ajustement des deux cohortes a été réalisé sur l'âge, la gravité de la maladie, le diagnostic primaire, et la date d'admission. Le coût moyen attribuable à l'infection nosocomiale était de 46 133$ ( Slonim et al., 2001 ). Leur étude souffre des mêmes limites que l'étude de Dominguez et al.
911 admissions ont été réalisées dans le service de soins intensifs pédiatriques durant la période d'étude.
57 enfants ont développé 65 infections nosocomiales, 7 patients avaient des infections multiples.
La durée moyenne entre la date d'admission dans le service et la date de survenue de l'infection nosocomiale était de 11,7 jours.
Résultats de l'analyse univariée :
Le coût moyen de l'admission est de 80 291$ pour les patients infectés et de 15 663$ pour les patients sains.
Le coût moyen direct de l'admission en soins intensifs des patients infectés est de 70 936 $ et de 10 828$ pour les patients sains.
Le coût moyen direct par lit est de 11 672 $ pour les patients infectés et de 7 385 $ pour les patients sains.
Le coût moyen total par lit est de 24 619 $ pour les patients infectés et de 14 990 $ pour les patients sains.
Résultats de la régression linéaire multiple :
Le coût direct d'une admission en soins intensifs des patients ayant contracté une infection nosocomiale est de 45 615 $ contre 6 396$ pour les patients sains, soit un surcoût de 39 219 $.
|
Titre : The impact of surgical-site infections following orthopedic surgery at a community hospital and a university hospital : adverse quality of life, excess length of stay, and extra cost Auteurs : J. D. Whitehouse, N.D. Friedman, K.B. Kirkland, W.J. Richardson, D.J. Sexton Revue : Infection control and hospital epidemiology, 23 (4), 183-189. Année : 2002 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : analyse des conséquences d'une ISO après intervention orthopédique sur : la qualité de vie, la durée de séjour, la fréquence de la ré-hospitalisation, les coûts médicaux directs
Etude de cohorte cas-témoin
Pays étudié : Etats-Unis
Coûts analysés : coûts en $ de patients ayant acquis une ISO après chirurgie orthopédique dans un centre de référence universitaire et un hôpital local du 01/01/97 au 01/06/98.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
Définitions : ISO après intervention orthopédique, définies selon les critères du CDC (NNIS) : superficielles (survenant 30 jours après intervention) et profondes/sur organe (un an après intervention).
Description de la cohorte : pour chaque patient, un patient témoin est sélectionné durant la période étudiée, comparable suivant les critères suivants : index de risque NNIS, âge (intervalle de 5 ans), date de l'intervention, chirurgien.
Méthodologie d'évaluation des coûts : les coûts sont calculés en prenant en compte les coûts des services de santé, des médicaments, le matériel utilisé par le patient (implants, anesthésie, chambre et bloc opératoire, médecins, traitement physique, laboratoire). Les coûts indirects ne sont pas inclus comme la lingerie.
RÉSULTATS ET DONNÉES CHIFFRÉES :
59 patients avec ISO ont été sélectionnés pour être étudiés versus 59 patients témoins : 31 de l'hôpital référent et 28 de l'hôpital local. Les interventions chirurgicales étaient de différents types : de la fracture à l'amputation, arthroplasties de hanche ou de genou, etc. La durée médiane de séjour sans ISO était de 5 jours et avec ISO, était observé un temps additionnel de 1 jour lors de l'hospitalisation initiale ; en outre, une 2 ème hospitalisation était plus fréquente (avec p=0,0001, l'étude montre qu'une intervention orthopédique avec ISO double le risque du patient d'être ré-hospitalisé dans l'année qui suit et de subir une réintervention) ; au total, la durée de séjour totale additionnelle s'établit à 14 jours (total d'hospitalisation de 19 jours au lieu de 5 jours pour une intervention chirurgicale sans ISO). Le coût estimé était de 6 636 $ sans ISO et de 24 344 $ avec ISO.
Ces résultats étaient les mêmes quelque soit l'hôpital étudié. Ainsi les coûts étaient multipliés par presque 4 pour les interventions avec ISO, que ce soient les coûts directs fixes ou variables ou les coûts indirects.
Un hôpital qui assurerait 5000 interventions orthopédiques par an pourrait économiser 350 000 $ par an en coûts directs en mettant en place un programme de prévention qui réduirait le taux d'ISO de 2% à 1% (par exemple prophylaxie antibiotique).
Limites
Difficultés pour trouver les « bons » témoins pour les interventions rares.
Fort taux de perdus de vue (20%).
Sous-estimation probable des coûts en ayant omis parfois des réhospitalisations dans d'autres établissements.
Pas de prise en compte des coûts ambulatoires.
Durée de surveillance d'1 an parfois insuffisante pour la déclaration de l'ISO.
|
Titre : Surgical-site infection due to staphylococcus aureus among elderly patients : mortality, duration of hospitalization, and cost Auteurs : S.A. McGarry, J.J. Engemann, K. Schmader, S.J. Sexton, K.S. Kaye Revue : Infection control and hospital epidemiology, 25 (6), 461-467 Année : 2004 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : mesure de l'impact d'une ISO par staphylococcus aureus (S. aureus) après intervention chirurgicale sur la mortalité, la durée d'hospitalisation, les coûts, parmi les personnes âgées, et impact de l'âge en comparant avec des personnes plus jeunes, sur la période de 01/01/94 à 30/11/2000.
Etude de cohorte
Pays étudié : Etats-Unis
Coûts analysés : les coûts exprimés en $ correspondent aux facturations de l'hôpital (coûts de référence : 2000)
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
Définitions : Les patients proviennent de 2 hôpitaux : un hôpital référent et un hôpital local
Description de la cohorte : 3 groupes de patients ont été analysés : des patients de plus de 70 ans avec ISO par S. aureus, des patients plus jeunes (de 18 à 60 ans) avec ISO par S. aureus et des patients âgés de plus de 70 ans sans ISO.
Méthodologie d'évaluation des coûts : non précisée, les facturations étant utilisées comme substituts aux coûts
RÉSULTATS ET DONNÉES CHIFFRÉES :
286 patients ont été étudiés : 96 âgés de plus de 70 ans, 131 plus jeunes ayant acquis une ISO par S. aureus et 59 patients âgés non infectés.
Les interventions les plus fréquentes étaient les interventions cardio-thoraciques et orthopédiques. Les patients âgés de plus de 70 ans avec ISO passaient 22 jours à l'hôpital (contre 7 jours pour les patients du même âge mais sans ISO, chiffres médians) alors que les patients plus jeunes ayant également une ISO ne passaient que 14 jours.
Les coûts s'élevaient à 85 650 $ (médiane) pour les patients âgés de plus de 70 ans (contre 32 000 $ pour une intervention sans ISO) ; les coûts étaient de 45 770$ pour les patients plus jeunes ayant acquis une ISO par S. aureus.
Chez les patients âgés, l'infection à S. aureus constituait un facteur indépendant d'augmentation de la durée de séjour (à hauteur de 12 jours supplémentaires) et des coûts (multiplication par 2, soit de l'ordre de 40 000 $), une fois pris en compte les autres facteurs (diabète, insuffisance rénale, tumeurs...), par rapport aux patients âgés non infectés.
Par contre, par rapport aux patients plus jeunes infectés, la prise en compte des autres facteurs en analyse multivariée fait disparaître la différence de coûts entre les deux groupes. Ainsi, l'âge en lui-même n'est pas un facteur d'augmentation des coûts ou de la durée de séjour ; les comorbidités jouent probablement le rôle principal.
La mortalité à 90 jours est en outre plus élevée dans le groupe des patients âgés avec ISO versus les deux autres groupes.
Ces résultats sont similaires à d'autres déjà obtenus (Raymond et al., Am Surg, 2001).
Limites
Les groupes n'étaient pas tous comparables en termes de nature d'interventions.
Les coûts n'étaient pas accessibles directement.
Il serait intéressant de poursuivre cette étude en intégrant les soins à domicile, la rééducation...
|
Titre : The attributable mortality and costs of primary nosocomial bloodstream infections in the intensive care unit Auteurs : DiGiovine B, Chenoweth C, Watts C, Higgins M Revue : American Journal Respir Crit Care Med, 160, 976-981 Année : 1999 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : étude prospective de deux cohortes appariées (68 cas et 68 témoins) sélectionnées parmi 3 003 patients amis dans un service de soins intensifs médicaux de 20 lits de l'hôpital universitaire du Michigan entre le 1 er janvier 1994 et le 31 décembre 1996.
Pays étudié : Etats-Unis
Coûts analysés : estimation des coûts directs
Les coûts sont exprimés en $ de l'année courante.
L'étude est menée du point de vue de l'établissement.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
Acute Physiology And Chronic Health Evaluation (APACHE III) :
Il s'agit d'une base de données contenant un nombre important de patients (17 440) et fournissant des prévisions sur les soins intensifs et la mortalité sur une base journalière de l'admission en soins intensifs à la sortie du patient. Il fournit des prévisions à l'admission de la durée totale du séjour et de la durée du séjour en soins intensifs.
Chaque patient de la cohorte avait un score journalier sur APACHE III.
Les données contenues dans la base de données :
Age, sexe, race, date d'entrée à l'hôpital, date d'entrée en soins intensifs, date de sortie des soins intensifs, date de sortie de l'hôpital, mode de sortie (vivant ou décédé), toute comorbidité chronique, et le score APACHE III.
La méthodologie d'ajustement :
Les deux cohortes ont été ajustées sur les variables suivantes : la prédiction de mortalité la veille de la survenue de l'infection, le sexe, l'âge, la race, la durée de séjour avant la date de l'appariement, la date d'admission, le diagnostic d'entrée et la présence ou non d'une maladie chronique.
La méthode d'analyse :
Une régression logistique a été menée afin de savoir si la survenue des infections nosocomiales est corrélée à une augmentation de la mortalité en soins intensifs.
L'évaluation des coûts :
La durée de séjour additionnelle est définie comme la différence entre le jour de sortie du service de soins intensifs et le jour de survenue de l'infection nosocomiale.
Les données de coûts sont issues d'une base de données (Transition System Inc.). Cette base de données fournit une pondération qui permet de répartir les différents coûts entre les services.
Les coûts sont basés sur les dépenses courantes constatées dans chaque service pendant la durée de l'étude.
La base de données ne contient pas de données de coûts journaliers pour chaque patient. Elle contient le « coût total du séjour » et le « coût des soins en soins intensifs ».
Les auteurs ont déterminé un premier ratio sur un échantillon de patients de l'étude qui avaient réalisé la totalité de leur séjour hospitalier en soins intensifs, afin, dans un deuxième temps, de pouvoir déterminer pour chaque patient les différents coûts détaillés.
Les analyses sont réalisées sur toute la cohorte (68 paires), puis sur 35 paires (patients non décédés) afin de déterminer si la mortalité joue sur la durée de séjour et donc sur le coût.
RÉSULTATS ET DONNÉES CHIFFRÉES :
Les durées de séjours et les coûts sont significativement plus importants chez les cas que chez les témoins dans les deux cas (68 paires ou 35 paires).
L'infection nosocomiale entraîne 5 jours d'hospitalisation supplémentaires en soins intensifs et un coût supplémentaire d'au moins 16 000 $ pour la médiane de la distribution.
Comparaison sur 68 paires :
Les cas ont une durée moyenne de séjour en soins intensifs de 13,24 jours contre 5,68 jours pour les témoins. La durée de séjour totale est de 24,16 jours pour les premiers et de 20,29 jours pour les seconds. Le coût total pour les premiers est de 60 650 $ contre 36 899 $. Le surcoût est de 23 751 $ en moyenne.
Comparaison sur 35 paires (patients non décédés) :
Les cas ont une durée moyenne de séjour en soins intensifs de 17,37 jours contre 7,03 jours pour les témoins. La durée de séjour totale est de 35,43 jours pour les premiers et de 30,25 jours pour les seconds. Le coût total pour les premiers est de 79 835 $ contre 45 327 $. Le surcoût est en moyenne de 34 508 $.
|
Titre : The direct costs of nosocomial catheter-associated urinary tract infection in the era of managed care Auteurs : Tambyah PA, Knasinski V, Maki DG Revue : Infection control and hospital epidemiology, 23(1), 27-31 Année : 2002 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : étude prospective d'une cohorte de 1 497 patients hospitalisés avec une sonde urinaire (123 patients infectés) entre 1997 et 1998.
Pays étudié : Etats-Unis
Coûts analysés : estimation des coûts directs
Les coûts sont exprimés en $ de l'année 1998.
L'étude est menée du point de vue de l'établissement.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
Les critères d'exclusion de la cohorte :
Age inférieur à 18 ans
Femmes enceintes
Allergie au silicone, au notrifurazone ou à l'argent.
Les données recueillies :
Age, sexe, maladie urologique, maladies chroniques (diabète, cancer, ...), HIV, service d'hospitalisation, hospitalisation en soins intensifs, gravité de la maladie (APACHE II), intervention chirurgicale récente, les motivations de la pose de la sonde, les examens et les traitements quotidiens.
A la sortie du patient, un des investigateurs de l'étude détermine quels examens, quels traitements et quelles journées d'hospitalisation supplémentaires sont attribuables aux infections nosocomiales.
Les coûts du laboratoire et les coûts de l'achat et de l'administration des médicaments sont recensés.
Les coûts sont déterminés à partir d'un ratio coûts/facturations.
RÉSULTATS ET DONNÉES CHIFFRÉES :
224 infections nosocomiales sont survenues, 123 ont été diagnostiquées par le biologiste de l'hôpital.
Ces 123 infections nosocomiales sont estimées engendrer un coût additionnel de 20 662 $ pour les examens de laboratoire, 35 872 $ pour les traitements médicamenteux, soit une moyenne de 589 $ par infection nosocomiale.
LIMITES :
Les coûts attribuables aux infections nosocomiales sont déterminés à dires d'experts.
|
Titre : The use of economic modelling to determine the hospital costs associated with nosocomial infections Auteurs : Roberts RR, Scott RD, Cordell R, Solomon SL, Steele L, Kampe LM, Trick WE, Weinstein RA Revue : CID 36(1 June), 1424-1432 Année : 2003 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : étude rétrospective d'une cohorte de 246 patients (25 IN et 139 sains) admis entre le 1 er janvier et le 31 décembre 1998.
Pays étudié : Etats-Unis (Cook County Hospital de Chicago)
Coûts analysés : coûts directs
L'étude est réalisée du point de vue de l'établissement.
Les coûts sont exprimés en $ de l'année courante.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
Les critères d'inclusions dans la cohorte :
Le patient devait présenter plus de 6 diagnostics.
De ce groupe étaient exclus tous les patients ayant moins de 18 ans, hospitalisés en chirurgie, en obstétrique ou en traumatologie.
Les données étaient collectées à partir des dossiers médicaux.
L'estimation des coûts :
Première étape :
L'estimation prend en compte la durée de séjour dans tous les services, le nombre et le type d'examens biologiques et radiographiques réalisés, les procédures de soins mises en place, les consultations et les traitements.
Les coûts unitaires par service sont ceux présentés dans le rapport d'activité de l'hôpital de 1998 ; ils incluent l'immobilier, les équipements, le personnel, les consommables.
L'estimation du coût total par patient s'obtient par la multiplication de la quantité de chaque ressource consommée par son coût unitaire.
3 régressions ont été réalisées :
La première régression a été effectuée sur tous les patients avec ou sans infection nosocomiale, l'objectif était de déterminer l'influence de la gravité de la maladie sur le coût.
Dans la deuxième régression, la présence d'une infection nosocomiale a été introduite comme variable explicative.
Dans la troisième régression, l'hospitalisation en soins intensifs a été intégrée comme variable explicative.
La base de données APACHE III a été utilisée pour ajuster les estimations en fonction du degré de sévérité de la maladie.
RÉSULTATS ET DONNÉES CHIFFRÉES :
Première régression :
Le coût moyen par patient ayant une infection nosocomiale est de 25 638 $ contre 7 338 $ en cas d'absence d'infection nosocomiale.
Deuxième régression :
Le coût moyen par patient ayant un score de gravité de 0 à 20 est de 5 056 $ sans infection nosocomiale et 41 481 $ avec infection nosocomiale. Pour un score de gravité de 81 - 110, le coût est de 17 380 $ sans infection et de 35 624 $ avec une infection.
Il existe une corrélation forte entre le score APACHE, et donc le degré de gravité de la maladie, et la survenue d'une infection nosocomiale, et par conséquent les coûts.
Troisième régression :
Le coût moyen par patient ayant une infection nosocomiale est de 38 869 $ contre 15 562 $ sans infection s'il y a eu passage en soins intensifs. Le coût moyen par patient ayant une infection nosocomiale est de 15 242 $ contre 6 561 $ s'il n'y a pas eu de passage en soins intensifs.
Il existe également une corrélation entre le passage en soins intensifs et l'importance du surcoût lié à l'infection nosocomiale.
Le coût moyen par patient augmente de 6 767 $ pour les suspicions d'infection nosocomiale et de 15 275 $ pour les infections nosocomiales confirmées.
Le degré de sévérité de la maladie et le passage en soins intensifs augmentent le coût total de prise en charge indépendamment de la présence ou non d'une infection nosocomiale.
|
Titre : Marginal increase in cost and excess length of stay associated with nosocomial bloodstream infections in surviving very low birth weight infants Auteurs : Payne NR, Carpenter JH, badger GJ, Horbar JD, Rogowski J Revue : Pediatrics, 114(2), 348-355 Année : 2004 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : étude rétrospective d'une cohorte de 2 809 grands prématurés (553 infections nosocomiales) admis dans les établissements concernés entre le 1 er janvier 1998 et le 31 décembre 1999.
Pays étudié : Etats-Unis
Coûts analysés : estimation des coûts directs
Les coûts sont exprimés en $ de l'année 1999.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
Les données sources :
Les données sont issues du programme de l'amélioration de la qualité des soins intensifs néonataux, mené en 2000 par le Vermont Oxford Network.
17 établissements parmi les 34 participants au programme ont été retenus ; l'étude a été réalisée à partir des données médicales et financières qu'ils ont fournies dans le cadre du programme.
L'analyse statistique :
Les coûts et les durées de séjour ont été évalués par une analyse univariée et une régression multiple.
Les critères d'inclusion :
Etaient inclus dans l'étude les prématurés nés dans un des 17 établissements ou transférés dans l'un d'eux, sortis vivants de l'établissement.
Les critères d'exclusion :
Les enfants décédés ou transférés dans un autre établissement, les enfants présentant un sepsis précoce, ou une malformation congénitale importante, ou les enfants dont certaines données étaient manquantes.
Les témoins de la cohorte ont été comparés à une cohorte de 29 586 enfants répondant aux critères d'inclusion de l'étude, hospitalisés durant la même période dans un des 261 établissements ne participant pas au programme.
L'évaluation des coûts :
L'évaluation a été réalisée en transformant les facturations des établissements en coûts selon une méthode préalablement établie par Rogowski et al 30 ( * ) .
Chaque établissement a fourni les factures où figurait le montant des charges de l'hôpital. Tous les codes relatifs à la néonatologie ont été sélectionnés au niveau du département, tels que définis par les rapports financiers des centres Medicaid et Medicare. A partir de ces rapports, les auteurs ont calculé les ratios coûts / facturations spécifiques par département pour chaque hôpital.
Le coût total par patient est égal au produit des facturations par ce ratio.
Définition des infections nosocomiales :
Les infections nosocomiales sont définies comme les infections survenant 3 jours après la naissance.
Des modèles de régression multiple ont été utilisés pour estimer les coûts additionnels et l'augmentation de la durée de séjour attribuables aux infections nosocomiales, après ajustement des variables suivantes : comorbidités, interventions, poids de naissance, terme de grossesse, lieu de naissance, sexe, race, soins périnataux, stéroïdes anténataux, naissance multiple, score d'APGAR, syndrome et détresse respiratoire, ...
RÉSULTATS ET DONNÉES CHIFFRÉES :
Gray JE et al estiment que les infections nosocomiales augmentent la durée de séjour d'en moyenne 14 jours et les coûts pour l'établissement de 25 090 $ (Gray et al., 1995).
Description de la cohorte :
La cohorte des témoins issue des 17 établissements est comparable aux 29 586 enfants hospitalisés dans d'autres établissements.
L'augmentation du coût était inversement corrélée au poids à la naissance et à la durée de la grossesse.
L'augmentation des durées de séjour attribuable aux infections nosocomiales après ajustement des variables se situe entre 4 et 7 jours.
Le coût moyen additionnel dû aux infections nosocomiales varie entre 6 276 $ pour les bébés de 1251 à 1 500 g, et 12 480 $ pour les bébés de 400 à 750 g.
|
Titre : The clinical and economics consequences of nosocomial central venous catheter-related infection : are antimicrobial catheters useful ? Auteurs : S Saint, DL Veenstra, BA Lipsky Revue : Infection control and hospital epidemiology, 21(6), 375-380 Année : 2000 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : analyse bibliographique et dires d'experts.
Pays étudié : Etats-Unis
Coûts analysés : Analyse du coût supplémentaire des infections consécutives à la pose d'un cathéter.
Les coûts sont exprimés en $ de l'année courante.
Les coûts sont estimés du point de vue de l'établissement.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
Définitions :
Infection locale : éruption cutanée se manifestant à proximité du cathéter
Colonisation : développement d'un organisme à partir du cathéter
Bactériémie : infection du sang « généralisée »
L'estimation de l'incidence :
L'incidence a été estimée à partir de l'analyse de 13 études :
§ Incidence des infections locales : 40% des cathéters colonisés ( Penberton et al., 1996 )
§ Incidence des bactériémies : 2,1% à 11,7% (estimation à partir de l'analyse de 11 études).
Selon le CDC, le taux d'infection se situe entre 2,8 et 12,8 pour 1000 jours avec cathéter en soins intensifs et 4,5 à 6,1 en soins intensifs médico-chirurgicaux.
En posant l'hypothèse d'une durée de 8 jours avec cathéter, les auteurs estiment le taux d'infection entre 4,9 et 8,2 pour 1000 jours avec cathéter.
L'estimation des coûts :
L'estimation de la durée de séjour et de la consommation de ressources est réalisée à partir d'une analyse bibliographique, à dires d'experts ou grâce à du microcosting.
Les coûts des analyses et de médicaments du système de santé du Michigan ont servi de référence aux estimations.
Les coûts estimés :
Les coûts estimés sont différents pour les infections locales et pour les bactériémies.
Les coûts estimés pour les infections locales sont le remplacement du cathéter, les analyses nécessaires pour poser le diagnostic (analyses de sang) et le coût des antibiotiques.
Les coûts des bactériémies sont estimés à partir de la durée de séjour supplémentaire attribuable à l'infection nosocomiale multipliée par le coût journalier de l'hospitalisation.
Le coût journalier de l'hospitalisation a été calculé à partir des factures grâce au ratio coûts / factures du centre médical universitaire de Washington.
Le coût journalier de l'hospitalisation ne comprend pas les honoraires des médecins.
La première estimation du coût des bactériémies a été réalisée à partir de l'estimation de l'augmentation de la durée de séjour attribuable à un cathéter réalisée par Pittet et al.
RÉSULTATS ET DONNÉES CHIFFRÉES :
Le coût supplémentaire induit par une infection locale est d'environ 399 $ :
Coût de remplacement du cathéter : 264 $,
Coût des analyses de sang : 71$,
Coût des antibiotiques : 64 $.
Pittet et al. estiment l'augmentation de la durée de séjour attribuable à une bactériémie consécutive à la pose d'un cathéter à 6,5 jours en soins intensifs suivis de 6 jours en services cliniques ( Pittet et al., 1994 ).
Le coût supplémentaire induit par une bactériémie (avec passage en soins intensifs) :
Le coût journalier d'une hospitalisation est de 1 152 $ en soins intensifs et 375 $ en service clinique.
En considérant les journées supplémentaires d'hospitalisation de l'étude de Pittet et al., le coût supplémentaire attribuable aux bactériémies est de 9 738 $ (1 152 × 6,5 + 338 × 6).
|
Titre : Nonrandom selection and the attributable cost of surgical-site infections Auteurs : CS Hollenbeack, D Murphy, WC Dunnagan, VJ Fraser Revue : Infection control and hospital epidemiology, 23(4), 177-182 Année : 2002 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : « seconde »analyse prospective d'une étude de deux cohortes (patients admis dans un établissement hospitalier du Midwest entre avril 1996 et mars 1998) appariées (16 cas - 160 témoins) avec ajustement des variables.
Pays étudié : Etats-Unis
Coûts analysés : Analyse du coût supplémentaire des ISO (stent).
Les coûts sont exprimés en $ de l'année courante.
Les coûts sont estimés du point de vue de l'établissement.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
L'ajustement des variables pour la constitution des couples cas - témoins :
L'ajustement se fait sur l'âge, le sexe, le diabète, l'insuffisance rénale et la durée de l'intervention chirurgicale.
L'estimation des coûts :
La valorisation des coûts est réalisée à partir de la comptabilité analytique de l'établissement.
Première estimation : comparaison à partir des deux cohortes non appariées.
Le coût supplémentaire attribuable à l'infection nosocomiale est obtenu par la différence entre le coût moyen des 16 cas et le coût moyen des 160 témoins.
Deuxième estimation : comparaison à partir des deux cohortes appariées et régression.
Méthode identique à la première, mais les paires sont ajustées sur certaines variables.
Troisième estimation : estimation du coût à partir d'un modèle de régression multi-linéaire.
Le coût a été estimé à partir d'une régression multi-linéaire dans laquelle le coût est fonction des variables d'ajustement qui peuvent avoir une influence sur le coût, de la présence ou non d'une infection nosocomiale.
Quatrième estimation : méthodologie d'estimation en deux étapes d'Heckman.
L'hypothèse de Heckman est que si les patients qui ont un risque plus important de contracter une infection nosocomiale nécessitent des soins plus coûteux même s'ils n'ont pas l'infection, alors le coût supplémentaire attribuable à l'infection nosocomiale de l'estimation précédente est surestimé.
Dans un premier temps, la méthode d'Heckman estime le risque de contracter une infection nosocomiale par un « probit ». Ce risque est ensuite introduit comme une variable explicative du coût de l'infection nosocomiale.
RÉSULTATS ET DONNÉES CHIFFRÉES :
Première estimation : Le coût moyen supplémentaire attribuable à l'infection nosocomiale est de 20 012 $.
Deuxième estimation : Le coût moyen supplémentaire attribuable à l'infection nosocomiale est de 19 579 $.
Troisième estimation : Le coût moyen supplémentaire attribuable à l'infection nosocomiale est de 20 103 $.
Le diabète n'influe pas sur le coût supplémentaire.
Quatrième estimation :
Les variables qui augmentent la probabilité de survenue de l'infection (variables significatives statistiquement) sont l'obésité et l'insuffisance rénale.
Les variables qui semblent augmenter la probabilité de survenue de l'infection (variables non significatives statistiquement) sont les maladies du tissu conjonctif, l'administration tardive d'antibiotique, l'importance de la durée de l'intervention chirurgicale.
La probabilité de survenue d'une infection nosocomiale n'est pas significative statistiquement, ce qui ne remet pas en cause les trois premières estimations.
Le coût moyen supplémentaire attribuable à l'infection nosocomiale est de 14 211 $.
Si les patients présentant un risque plus important de contracter une infection nosocomiale sont plus coûteux, la différence n'est pas statistiquement significative.
LIMITES :
Etude monocentrique.
|
Titre : The impact of adverse patient occurrences on hospital costs in the pediatric intensive care unit Auteurs : TE Dominguez, R Chalom, AT Costarino Jr Revue : Critical Care Medicine, 29(1), 169-174 Année : 2001 |
PRÉSENTATION MÉTHODOLOGIQUE
Type d'étude : analyse rétrospective d'une étude de cohorte (1 376 enfants admis en réanimation dans un centre hospitalier universitaire entre le 1 er juillet 1993 et le 30 juin 1994).
Pays étudié : Etats-Unis (Philadelphie)
Coûts analysés : analyse du coût supplémentaire attribuable aux complications respiratoires, aux complications vasculaires ou aux complications infectieuses.
Les coûts sont exprimés en $ de l'année courante.
Les coûts sont estimés du point de vue de l'établissement.
PRÉSENCE D'UN CHAPITRE MÉTHODOLOGIQUE DÉTAILLÉ :
L'estimation des coûts :
Les services financiers de l'hôpital ont fourni pour chaque patient les consommations journalières de ressources durant le séjour en réanimation. Les charges étaient ventilées entre différents postes de coûts, pour lesquels les services financiers ont fourni le ratio coûts / factures (« charges »).
Trois estimations ont été réalisées :
Une première estimation à partir d'une analyse univariée.
Les variables du modèle étaient l'âge, la sévérité de la maladie, la mortalité, la durée de séjour, et les coûts.
Une deuxième estimation à partir d'une analyse multivariée.
Les variables du modèle étaient l'âge, la sévérité de la maladie, l'organe en défaillance, le diagnostic, la présence d'une maladie chronique, l'assistance respiratoire, la pose d'un cathéter, et le sexe.
Une troisième estimation uniquement sur les infections nosocomiales à partir de deux cohortes de cas - témoins appariées avec ajustement des variables.
L'ajustement des variables :
L'ajustement se fait sur l'âge, le risque de mortalité, l'assistance respiratoire et la présence d'un cathéter.
RÉSULTATS ET DONNÉES CHIFFRÉES :
Sur les 1 376 admissions, on dénombre :
23 complications respiratoires
35 complications vasculaires sur 29 patients
40 infections nosocomiales sur 30 patients.
Résultats de l'analyse univariée :
Les auteurs constatent une augmentation des coûts pour tous les types de complications à l'exception des complications respiratoires.
Les coûts supplémentaires les plus importants sont ceux consécutifs à une infection nosocomiale.
Le coût total d'un enfant sain est de 5 281$ contre 53 517$ pour un enfant ayant contracté une infection nosocomiale.
Les durées de séjour augmentent également pour tous les types de complications à l'exception des complications respiratoires.
L'augmentation des durées de séjour la plus importante est également due aux infections nosocomiales.
La durée médiane de séjour d'un patient sain est de 2 jours contre 17,5 jours pour les enfants ayant contracté une infection nosocomiale.
Résultats de l'analyse multivariée :
L'infection nosocomiale était associée à une augmentation du coût total de 50 362$ et une augmentation de séjour de 15,6 jours.
Les complications respiratoires et vasculaires n'étaient pas associées à une augmentation du coût ou de la durée de séjour.
Résultats de l'analyse des deux cohortes appariées :
Le coût médian chez les témoins est de 25 388$ contre 47 946$ chez les cas, soit un coût supplémentaire attribuable à l'infection nosocomiale de 22 558 $.
Le coût total chez les témoins était de 742 688 $ contre 1 471 329 $ chez les cas, soit un coût supplémentaire attribuable aux infections nosocomiales de 736 925 $ ( 32 040 $ en moyenne par patient ).
La durée médiane de séjour était également plus importante de 6,5 jours ( 9 jours chez les témoins contre 15,5 jours chez les cas ).
LIMITES :
L'estimation n'est réalisée qu'à partir d'un seul site.
L'estimation des coûts ne porte que sur la partie du séjour en réanimation.
RÉFÉRENCES
FICHES DE LECTURE :
Adrie C, Chaix Couturier C, de Lassence A, Meshaka P, Thuong M, Garrouste-Orgeas M, Timsit JF. Epidemiology and economic evaluation of severe sepsis in France: age, severity, infection site, and place of acquisition (community, hospital, or intensive care unit) as determinants of workload and cost. Journal of critical care 2005, 20(1): 46-58.
Brun-Buisson C, Roudot-Thoraval F, Girou E, Grenier-Sennelier C, Durand-Zaleski I. The costs of septic syndromes in the intensive care unit and influence of hospital acquired sepsis. Intensive care med (2003), 29(9), 1464-1471.
CCECQA, ANAES. Les coûts de la qualité et de la non-qualité des soins dans les établissements de santé : états des lieux et propositions. ANAES Juillet 2004.
Chaix C, Durand-Zaleski I, Alberti C, Brun Buisson C. Cost of Endemic Methicillin-Resistant Staphylococcus Aureus : A Cost Benefit Analysis in an Intensive Care Unit. JAMA 1999, 282(18), 1745-1751.
Coello R, Charlett A, Wilson J, Ward V, Pearson A, Borriello P. Adverse impact of surgical site infections in english hospitals, Journal of Hospital Infection, 2005, 60, 93-103
Dietrich ES, Demmler M, Schulgen G, Fekec K, Mast O, Pelz K, Daschner FD. Nosocomial pneumonia: a cost of illness analysis. Infection 2002, 30(2), 61-67.
DiGiovine B, Chenoweth C, Watts C, Higgins M. The attributable mortality and costs of primary nosocomial bloodstream infections in the intensive care unit. American Journal Respir Crit Care Med 1999, 160, 976-981.
Dominguez TE, Chalom R, Costarino Jr AT. The impact of adverse patient occurrences on hospital costs in the pediatric intensive care unit. Critical Care Medicine 2001, 29(1), 169-174.
Elward AM, Hollenbeak CS, Warren DK, Fraser VJ. Attributable cost of nosocomial primary bloodstream infection in pediatric intensive care unit patients. Pediatrics 2005, 115(4), 868-872.
Hollenbeack CS, Murphy D, Dunnagan WC, Fraser VJ. Nonrandom selection and the attributable cost of surgical-site infections. Infection control and hospital epidemiology 2002, 23(4), 177-182.
Lauria FN, Angeletti C. The impact of nosocomial infections on hospital care costs. Infection 2003; 31(Suppl2):35-43.
Lopman BA, Reacher MH, Vipond IB, Hill D, Perry C, Halladay T, Brown DW, Edmunds WJ, Sarangi J. Epidemiology and cost of nosocomial gastroenteritis Avon, England, 2002-2003. Emerging Infectious Diseases 2004, 10(10), 1827-1834.
McGarry SA, Engemann JJ, Schmader K, Sexton SJ, Kaye KS. Surgical-site infection due to staphylococcus aureus among elderly patients : mortality, duration of hospitalization, and cost. Infection control and hospital epidemiology, 2004, 25 (6), 461-467
Orsi GB, Di Stefano L, Noah N. Hospital-acquired, laboratory-confirmed bloodstream infection: increased hospital stay and direct costs. Infection control and hospital epidemiology 2002, 23(4), 190-197.
Payne NR, Carpenter JH, badger GJ, Horbar JD, Rogowski J. Marginal increase in cost and excess length of stay associated with nosocomial bloodstream infections in surviving very low birth weight infants. Pediatrics 2004, 114(2), 348-355.
Piednoir E, Bessaci K, Bureau-Chalot F, Sabouraud P, Brodard V, Andréoletti L, Bajolet O. economic impact of healthcare associated rotavirus infection in a pediatric hospital. The journal of hospital infection 2003, 55(3), 190-195
Pirson M, Dramaix M, Struelens M, Riley TV, Leclercq P. Costs associated with hospital-acquired bacteraemia in a Belgian hospital. The Journal of Hospital Infection 2005, 59(1): 33-40.
Plowman R, Graves N, Griffin MAS, Roberts JA, Swan AV, Cookson B, Taylor L. The rate and cost of hospital-acquired infections occurring in patients admitted to selected specialties of a district general hospital in England and the national burden imposed. The Journal of Hospital infection 2001, 47(3), 198-209.
Roberts RR, Scott RD, Cordell R, Solomon SL, Steele L, Kampe LM, Trick WE, Weinstein RA. The use of economic modelling to determine the hospital costs associated with nosocomial infections. Clin Infect Dis 2003, 36, 1424-1432
Saint S, Veenstra DL, Lipsky BA. The clinical and economics consequences of nosocomial central venous catheter-related infection: are antimicrobial catheters useful ? Infection control and hospital epidemiology 2000, 21(6), 375-380.
Slonim AD, Kurtines HC, Sprague BM, Singh N. The costs associated with nosocomial bloodstream infections in the pediatric intensive care unit. Pediatric Crit Care Med. 2001; 2: 170-174.
Tambyah PA, Knasinski V, Maki DG. The direct costs of nosocomial catheter-associated urinary tract infection in the era of managed care. Infection control and hospital epidemiology 2002, 23(1), 27-31
Whitehouse JD, Friedman ND, Kirkland KB, Richardson WJ, Sexton DJ. The impact of surgical-site infections following orthopedic surgery at a community hospital and a university hospital : adverse quality of life, excess length of stay, and extra cost. Infection control and hospital epidemiology, 2002, 23 (4), 183-189.
ETUDES CITÉES
Abramson MA, Sexton DJ. Nosocomial methicillin-resistant and methicillin-susceptible Staphylococcus aureus primary bacteremia: at what costs? Infect Control Hosp Epidemiol 1999; 20 : 408-411.
Bientz M, Gayet S, Marcillou P, Krencher C. Etude coût-efficacité d'une campagne de prévention des infections urinaires nosocomiales au CHRU de Strasbourg. Hygiènes 1994 ; 4 : 33-8.
Chaix C, Durand-Zaleski I, Alberti C, Brun-Buisson C (1999) A model to compute the medical cost of intensive care patients. Pharmacoeconomics 15: 573-582.
Coello R, Glenister H, Fereres J, Bartlett C, Leigh D, Sedgwick J et al. The cost of infection in surgical patients: a case-control study. J Hosp Infect 1993; 25(4): 239-50.
French GL, Cheng AF. Mesaurement of the costs of hospital infection by prevalence surveys. J Hosp Infect 1991, 18 Suppl A : 65-72.
Garo B, Boles JM. Le coût de l'infection nosocomiale en réanimation : une évaluation médicale et économique [abstract]. Réan Urg 1995 ; 2 : 109-22.
Gray JE, Richardson DK, McCormick MC, Goldmann DA. Coagulase-negative staphylococcal bacteremia among very low birth weight infants: relation to admission illness severity, resource use, and outcome. Pediatrics 1995;95(2): 225-30.
Haley RW. Measuring the costs of nosocomial infections: methods for estimating economic burden on the hospital. Am J Med 1991;91(Suppl.):32S-38S.
Jarvis WR. Selected aspects of the socioeconomics impact of nosocomial infections: morbidity, mortality, cost and prevention. Infect Control Hosp Epidemiol 1996; 17(8): 552-7
Kappstein I, Schulgen G, Beyer U, Geiger K, Schumacher M, Daeschner FD. Prolongation of hospital stay and extra costs due to ventilator-associated pneumonia in an intensive care unit. Eur J Clin Microbiol Infect Dis 1992; 11(6): 504-8.
Leroyer A, Bedu A, Lombrail P, Desplanques L, Diakite B, Bongen E et al. Prolongation of hospital stay and extra costs due to hospital-acquired infection in a neonatal unit. J Hosp Infect 1997; 35(1): 37-45.
Li LY, Wang SQ. Economic effects of nosocomial infections in cardiac surgery. J Hosp Infect 1990; 16(4): 339-41.
Mehtar S. Infection control programmes - are they cost-effective? J Hosp Infect 1995; 30(Suppl): 26-34.
Meynet R, Fabry J, Sepetjan M. Micro-économie de l'infection nosocomiale. Fondation Marcel Mérieux ; 1991.
O'Donoghue MA, Allen KD. Costs of an outbreak of wound infections in an orthopaedic ward. J Hosp Infect 1992; 22(1): 73-9.
Pemberton LB, Ross V, Cuddy P, Kremer H, Fessler T, McGurk E. No difference in catheter sepsis between standard and antiseptic central venous catheter. A pospective randomized trial. Arch Surg. 1996;131:986-989.
Pittet D, Tarara D, Wenzel RP. Nosocomial bloodstream infection in critically ill patients. Excess length of stay, extra costs, and attributable mortality. JAMA 1994; 271(20): 1598-1601.
Plowman RM, Graves N, Griffin M, Roberts JA, SwanAV, Cookson B, Taylor I. The socio-economic burden of hospital acquired infection. Public Health Laboratory Service, London 1999.
Riley TV, Codde JP, Rouse IL. Increased length of hospital stay due to Clostridium difficile associated diarrhoea [Letter]. Lancet 1995; 345(8947): 455-6.
Rogowski JA, Horbar JD, Plsek PE, et al. Economic implications of neonatal intensive care unit collaborative quality improvement. Pediatrics 2001; 107: 14-22.
Rogowski JA, Harrison E; Treatment costs for very low birthweight infants: the california medicaid experience. Arlington, VA: The Rand Corporation; 1995 (MR-451-AHCPR).
Rogowski JA. Measuring the costs of neonatal and perinatal care. Pediatrics. 1999; 103 (suppl.): 329-355.
Shulkin DJ, Kinosian B, Glick H, GlenPuschett C, Daly J, Eisenberg JM. The economic impact of infections. An analysis of hospital costs and charges in surgical patients with cancer. Arch Surg 1993; 128(4): 449-52.
Stone PW, Larson E, Kawar LN. A systematic audit of economic evidence linking nosocomial infection and infection control interventions: 1990-2000. Am J Infect Control 2002; 30:145-152.
Vegas AA, Jodra VM, Garcia ML. Nosocomial infection in surgery wade : a controlled study of increased duration of hospital stays and direct cost of hospitalization. Eur J Epidemiol 1993; 9(5):504-10.
Wenzell RP. Hospital acquired pneumonia: orverview of the current state of the art for prevention and control. Eur J Clin Microbiol 1989;8: 56-60.
ARTICLES ÉCARTÉS
EVALUATION DU COÛT DES INFECTIONS COMMUNAUTAIRES
Reed SD, Friedman JY, Engemann JJ, Griffiths RI, Anstrom KJ, Kaye KS, Stryjewski ME, Szczech LA, Reller LB, Corey GR, Schulman KA, Fowler VG. Costs and outcome among hemodialysis-dependant patients with methicillin-resistant or methicillin-susceptible staphylococcus aureus bacteriema. Infection control and hospital epidemiology 2005, 26(2), 175-183.
PÉRIODE D'ÉTUDE TROP ANCIENNE :
Kollef MH, Sharpless L, Vlasnik J, Pasque C, Murphy D, Fraser VJ. The impact of nosocomial infections on patient outcomes following cardiac surgery. CHEST 1997, 112(3), 666-675.
Macartney KK, Gorelick MH, Manning ML, Hodinka RL, Bell LM. Nosocomial respiratory syncytial virus infections: the cost effectiveness and cost benefit of infection control. Pediatrics 2000, 106(3), 520-526.
McNulty C, Logan M, Donald IP, Ennis D, Taylor D, Baldwin RN, Bannerjee M, Cartwright KAV. Successful control of clostridium difficile infection in an elderly care unit through use of a restrictive antibiotic policy. Journal of Antimicrobial Chemotherapy 1997, 40, 707-711.
PAYS NON EUROPÉEN OU NORD AMÉRICAIN
Graves N, Nicholls TM, Morris A. Modeling the costs of Hospital-acquired infections in New Zealand. Infection Control and Hospital Epidemiology 2003, 24(3), 214-223.
ABSENCE DE CHAPITRE MÉTHODOLOGIQUE
Foxman B. Epidemiology of urinary tract infections: incidence, morbidity and economic costs. Disease a month 2003, 49(2): 53-70.
Graves N. Economics and preventing hospital acquired infection. Emerging infectious diseases 2004, 10(4) : 561-566.
ABSENCE D'ANALYSE DE COÛTS
Diekema DJ, Beekmann SE, Chapin KC, Morel KA, Munson E, Doern GV. Epidemiology and outcome of nosocomial and community -onset bloodstream infection. Journal of Critical Microbiology 2003, 41(8) : 3655-3660.
Fiel S. Guidelines and critical pathways for severe hospital acquired pneumonia. CHEST 2001, 119 :412-418.
Stone PW, Larson E, Kawar LN. A systematic audit of economic evidence linking nosocomial infections and infection control interventions: 1999 - 2000. American Journal of Infection Control 2002, 30(3): 145-152.
ANNEXE 10 : Questionnaires utilises dans l'enquête IPSOS
ENQUETE SUR LES INFECTIONS NOSOCOMIALES
CIBLE PROFESSIONNEL DE SANTE
Coder la cible :
1. Médecins généralistes libéraux n=50
2. Médecins spécialistes hospitaliers n=75
3. Infirmières hospitalières n=75
Question 1 : Selon vous, parmi les éléments suivants, quels sont ceux qui inquiètent le plus les patients hospitalisés ?
Enquêteur citer, plusieurs réponses possibles ,ordre aléatoire des sous questions, poser en OUI/NON
1. Les risques d'infection
2. L'anesthésie
3. Les erreurs médicales
4. L'isolement
5. Le risque que l'on découvre une autre maladie
6. Les examens médicaux
7. Les piqûres
8. (NSP)
Question 2 : Selon vous, quelle proportion de français âgés de 15 ans et plus ont déjà entendu parler des infections nosocomiales ?
Enquêteur citer, une seule réponse possible
I___I___I___I % (prévoir nsp)
Question 3 : Vous sentez-vous très bien informé, plutôt bien informé, plutôt mal informé ou très mal informé sur les infections nosocomiales ?
Enquêteur citer
1. Très bien informé
2. Plutôt bien informé
3. Plutôt mal informé
4. Très mal informé
5. (NSP)
Question 4 : Et à votre avis, les français sont-ils très bien informés, plutôt bien informés, plutôt mal informés ou très mal informés sur les infections nosocomiales ?
Enquêteur citer
1. Très bien informé
2. Plutôt bien informé
3. Plutôt mal informé
4. Très mal informé
5. (NSP)
Question 5 : Selon vous, sur 100 patients hospitalisés combien acquièrent une infection nosocomiale (en %) ?
I___I___I___I % (prévoir nsp)
Question 6 : Et pour vous-même, si vous deviez être hospitalisé, pensez-vous que ces infections nosocomiales représentent une probabilité extrêmement importante, très importante, assez importante, peu importante ou pas du tout importante ?
Enquêteur citer
1. Extrêmement importante
2. Très importante
3. Assez importante
4. Peu importante
5. Pas du tout importante
6. (NSP)
Question 7 : Pensez-vous qu'il y a aujourd'hui en France davantage, autant ou moins d'infections nosocomiales...?
Enquêteur citer, une seule réponse possible
• Qu'il y a une dizaine d'années
• Que dans les autres pays européens
1. Davantage
2. Autant
3. Moins
4. (NSP)
Question 8 : A votre avis, lorsqu'une infection nosocomiale est constatée, le patient en est-il informé ?
Enquêteur citer, une seule réponse possible
1. Oui, systématiquement
2. Oui, parfois
3. Non
4. (NSP)
Question 9 : Connaissez-vous le nouveau mécanisme de réparation des infections nosocomiales introduit par la loi Kouchner du 4 mars 2002 (mise en place d'un fonds spécifique géré par l'Office National d'Indemnisation des accidents médicaux) ?
Enquêteur citer, une seule réponse possible
1. Oui
2. Non
3. (NSP)
Question 10 : Souhaiteriez-vous disposer d'une information sur les taux d'infections nosocomiales par établissement ?
Enquêteur citer, une seule réponse possible
1. Oui
2. Non
3. (NSP)
Question 11 : Selon vous, le risque d'infection nosocomiale est plus fréquent lors...?
Enquêteur citer, une seule réponse possible
1. D'une hospitalisation courte en médecine
1. D'une hospitalisation prolongée en médecine
2. D'une intervention chirurgicale
3. D'un séjour en réanimation
4. (NSP)
Question 12 : Selon vous, les germes impliqués le plus fréquemment sont ...?
Enquêteur citer, une seule réponse possible
1. Présents dans les locaux hospitaliers
2. Présents parmi le personnel hospitalier
3. Présent chez les autres malades
4. Présents chez le malade lui-même
5. (NSP)
Question 13 : Pensez-vous que la prescription inappropriée d'antibiotiques accroît...?
Enquêteur citer, une seule réponse possible
• L'incidence des infections nosocomiales
• La difficulté de traiter les infections nosocomiales
1. Oui
2. Non
3. (NSP)
Question 14 : Craignez-vous qu'un patient engage votre responsabilité ou celle d'un médecin devant le juge pour obtenir réparation des conséquences dommageables d'une infection nosocomiale ?
Enquêteur citer, une seule réponse possible
1. Oui
2. Non
3. (NSP)
ENQUETE SUR LES INFECTIONS NOSOCOMIALES
CIBLE GRAND PUBLIC 15 ANS ET PLUS
Question 1 : Quand vous-même ou l'un de vos proche doit être hospitalisé pour une opération ou un séjour long d'au moins quelques jours, parmi les éléments suivants, quels sont ceux qui vous inquiètent ?
Enquêteur citer, plusieurs réponses possibles, ordre aléatoire des sous question, poser en OUI/NON
4. Les risques d'infection
5. L'anesthésie
6. Les erreurs médicales
7. L'isolement
8. Le risque que l'on découvre une autre maladie
9. Les examens médicaux
10. Les piqûres
11. (NSP)
Question 2 : A l'hôpital, on peut acquérir des infections que l'on n'avait pas avant d'entrer à l'hôpital. Savez-vous comment on appelle ce type d'infections ?
Enquêteur citer, une seule réponse possible
9. Oui, « infections nosocomiales »
10. Oui, autre réponse (préciser :......................................................................................................)
11. Non
12. (nsp)
Question 3 : En fait, ces infections qui s'appellent infections nosocomiales sont des maladies infectieuses contractées pendant une hospitalisation. En avez-vous déjà entendu parler ?
Enquêteur citer, une seule réponse possible
1. Oui
2. Non
3. (NSP)
Si Oui (Q3 = 1)
Question 4 : Comment en avez-vous entendu parler ?
Enquêteur citer, une seule réponse possible
1. Par les grands médias (télé, radio, presse)
2. par Internet
3. Par le bouche à oreille (amis, relations)
4. Par un membre de votre famille
5. Vous y avez été vous-même confronté
6. Par votre médecin traitant
7. Par un médecin spécialiste
8. Par un pharmacien
9. Par un autre professionnel de santé (infirmière, dentiste, kiné,...)
10. (NSP)
Question 5 : Selon vous, sur 100 patients hospitalisés combien acquièrent ces infections nosocomiales (en %) ?
I___I___I___I % (prévoir nsp)
Question 6 : Selon vous, lorsqu'une infection nosocomiale est déclarée, le patient en est-il informé ?
Enquêteur citer, une seule réponse possible
1. Oui, systématiquement
2. Oui, parfois
3. Non
4. (NSP)
Question 7 : Vous sentez-vous très bien informé, plutôt bien informé, plutôt mal informé ou très mal informé sur les infections nosocomiales ?
Enquêteur citer
6. Très bien informé
7. Plutôt bien informé
8. Plutôt mal informé
9. Très mal informé
10. (ne sait pas ce que c'est - non suggéré)
11. (NSP)
Question 8 : Et pour vous-même, si vous deviez être hospitalisé, pensez-vous que ces infections nosocomiales représentent un risque extrêmement important, très important, assez important, peu important ou pas du tout important ?
Enquêteur citer
7. Extrêmement important
8. Très important
9. Assez important
10. Peu important
11. Pas du tout important
12. (NSP)
Question 9 : Pensez-vous qu'il y a aujourd'hui en France davantage, autant ou moins d'infections nosocomiales...?
Enquêteur citer, une seule réponse possible
5. Davantage
6. Autant
7. Moins
8. (NSP)
• Qu'il y a une dizaine d'années
• Que dans les autres pays européens
Question 10 : Voici des affirmations sur les infections nosocomiales. Pour chacune, vous me direz si vous êtes tout à fait d'accord, plutôt d'accord, plutôt pas d'accord ou pas du tout d'accord ?
Enquêteur citer, une seule réponse possible, ordre aléatoire des sous questions
1. Tout à fait d'accord
2. Plutôt d'accord
3. Plutôt pas d'accord
4. Pas du tout d'accord
5. (NSP)
• On peut mourir d'une infection nosocomiale
• L'hygiène est le principal moyen de diminuer le risque d'infections nosocomiales
• Ce n'est pas parce qu'on est malade qu'on a plus de risque d'avoir une infection nosocomiale
• Les personnes qui rendent visite à leur proche à l'hôpital peuvent aussi avoir une infection nosocomiale
• Plus on reste longtemps à l'hôpital, plus on a de risque d'avoir une infection nosocomiale
• La plupart des infections nosocomiales se soignent facilement
• Les infections nosocomiales constituent le principal danger lié à la fréquentation des hôpitaux
Question 11 : Si vous étiez vous-même directement concerné par une infection nosocomiale, seriez-vous prêt à aller devant un juge (un tribunal) pour être dédommagé ?
Enquêteur citer
1. Oui
2. Non
3. (NSP)
ANNEXE 11 : Résultats détaillés de l'enquête IPSOS
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
* 1 « Du bon usage des psychotropes » Rapport n° 422 (2005-2006) de Maryvonne Briot, députée.
* 2 Cf. rapport d'information n° 298 (2005-2006) d'Alain Vasselle, au nom de la commission des Affaires sociales « La tarification à l'activité à l'hôpital : la réforme au milieu du gué ».
* 3 Enquête Raisin menée en 2004 dans 133 services de réanimation.
* 4 Enquête du centre interrégional de lutte contre les infections nosocomiales de Paris-Nord menée en 2000 et 2001 dans seize hôpitaux.
* 5 P.Michel et al. Les événements indésirables graves liés aux soins observés dans les établissements de santé : premiers résultats d'une étude nationale. DREES, Etudes et Résultats n°398, mai 2005.
Etaient considérés comme graves les événements susceptibles d'entraîner une hospitalisation, une prolongation d'hospitalisation d'au moins un jour, un handicap ou une incapacité à la fin de l'hospitalisation, ou associés à une menace vitale ou un décès.
* 6 citons quelques revues ou articles faisant le point : Coello R et al., Journal of hospital Infection, 2005, McGarry SA et al. Infection control and Hospital Epidemiology, 2004, Whitehouse JD et al., Infection Control and Hospital Epidemiology, 2002
* 7 Bootsma MCJ. Et al. Controlling methicillin-resistant Staphylococcus aureus : quantifying the effects of interventions and rapid diagnostic testing. Proceed. Nat. Acad. Sciences, édition avancée en ligne (www.pnas.org/cgi/doi.10.1073/pnas.0510077103)
* 8 www.cdc.gov/ncidod/dhqp/nnis-pubs.html
* 9 Cette extrapolation a été calculée à partir des chiffres suivants : d'après les statistiques 1999, 250 534 patients sont décédés dans les hôpitaux français (taux brut de mortalité de 1,61%), dont 63 431 en CHU (1,87%) et 126 235 en CH (2,44%) qui représentent les ¾ des décès hospitaliers.
* 10 Branger B, Durand C, Jarno P, Chaperon J, Delattre-Maillot I, Mortalité hospitalière imputable aux infections nosocomiales, Méd Mal Inf 2002, 32 :98-106.
* 11 Bailly P, Haore, HG, Crenn D, Talon D, Mortalité hospitalière imputable aux infections nosocomiales : mise en place d'un observatoire dans un centre hospitalier universitaire, Médecines et maladies infectieuses, 2004
* 12 ICU, « Intensive Care Unit » en anglais, correspond en France à réanimation et soins intensifs.
* 13 Qui en outre donnent parfois la moyenne, parfois la médiane des coûts.
* 14 Le programme complet est accessible sur :
http://www.sante.gouv.fr/htm/pointsur/nosoco/tab_bord/circ04_599.pdf
* 15 A noter par exemple que la grille du NHQR (National Healthcare Quality Report) retient 179 indicateurs, dont 12 sont liés aux IN.
* 16 McKibben et al., Guidance on public reporting of Healthcare-associated infections : Recommendations of the Healthcare Infection Control Practices Advisory Committee. Am J Infect Control 2005, 33:217-226.
* 17 La responsabilité n'est pas engagée dans deux situations :
- Pour les infections contractées dans des établissements de santé, la structure de soins a apporté la preuve de la cause étrangère.
- Pour les infections survenues consécutivement à une prise en charge libérale dans un cabinet de ville, le professionnel de santé n'a pas commis de faute.
* 18 Sont seules recensées les déclarations de sinistre ayant fait l'objet d'une réclamation auprès de l'assureur.
* 19 L'indemnisation financière de toutes les infections nosocomiales, quelle que soit leur gravité, était alors entièrement à la charge des assureurs.
* 20 Quelques études existent. Par exemple, une étude lyonnaise récente menée chez 50 médecins généralistes a indiqué la présence de germes pathogènes chez 10 d'entre eux. 31 ne sont pas équipés d'essuie-mains à usage unique, 14 n'ont pas de savon antiseptique, et le temps de frictionnement n'est pas toujours respecté.
* 21 Tirésias, volume III, Prévention des infections en chirurgie orthopédique : 02 Comportements humains en salle d'opération, pp 15-17.
* 22 Tirésias, vol III, déjà cité.
* 23 Source PMSI, bases publiques et privées 2004, sur les 3 GHM suivants : 08C02Z, 08C03V, 08C03W
* 24 L'indice NNIS, utilisé en chirurgie permet de classer les patients en 4 catégories de risque croissant (0 à 3) pour l'infection du site opératoire. Il est construit à partir de la somme de 3 facteurs : la durée opératoire, le score ASA, la classe de contamination du type de chirurgie.
* 25 Alerte au SRAS, vérification et mesures de santé publique dans l'après-flambée, OMS, 14 août 2003. http://www.who.int/csr/sars/postoutbreakfr/en/print.html
* 26 http://www.invs.sante.fr/recherche/index2.asp?txtQuery=SRAS
* 27 http://www.sante.gouv.fr/htm/dossiers/pneumapathies/sommaire.htm
* 28 Pittet et al., 1994, Shulkin et al., 1993, Coello et al., 1993, O'Donoghue et al., 1992, Ly et al., 1990, Gray et al., 1995, Vegas et al., 1993, Kappstein et al., 1992, Riley et al., 1995, Jarvis et al., 1996.
* 29 Chaix et al. 1999, Leroyer et al., 1997, Meynet et al., 1991, Bientz et al., 1994, Haley et al., 1991, Garo et al., 1995.
* 30 Rogowski et al., 2001, Rogowski et al., 1995, Gray et al., 1995.