TROISIÈME
PARTIE :
L'AFSSAPS ET LA SÉCURITÉ DES PRODUITS DE
SANTÉ
Le positionnement de l'évaluation
L'AFSSAPS est parmi les agences et les entités autonomes créées par les loi du 1 er juillet 1998 et du 9 mai 2001, celle qui a été soumise au plus grand nombre d'examens par les instances administratives et parlementaires.
En effet, la Cour des Comptes a établi un relevé de constatations définitives le 25 février 2003 qui portait essentiellement sur les conditions de mise en place de l'Agence ; elle a également abordé « les conditions de fonctionnement des agences sanitaires » dans le chapitre X de son rapport sur l'application des lois de financement de la sécurité sociale en septembre 2002.
De leur côté, à la demande de la Direction générale de la santé, un audit de l'AFSSAPS a été établi conjointement en décembre 2002 par l'inspection générale des finances et l'inspection générale des affaires sociales ; les sept inspecteurs en charge de cet audit ont détaillé leurs travaux à travers douze rapports particuliers et un rapport de synthèse.
Enfin, la commission des finances du Sénat a chargé notre collègue, M. Adrien Gouteyron, d'un rapport d'information sur l'AFSSAPS qui a été adopté par cette commission le 16 juillet 2003. Les informations abondantes ainsi réunies récemment sont non seulement précises, mais encore permettent d'étayer une évaluation à l'aide de travaux que seules des instances juridictionnelles et d'inspection ont les moyens de mener.
Dans ces conditions, l'analyse de l'AFSSAPS à laquelle il est procédé ici se situe dans la perspective de l'évaluation telle qu'elle est prescrite par la loi du 1 er juillet 1998 et des enseignements que l'on peut concrètement tirer. Toutefois, les développements intervenus récemment dans le domaine du médicament et plus particulièrement dans celui de l'expertise obligent à envisager comment les structures actuelles peuvent faire face à ces nouveaux défis.
Deux observations préalables doivent être faites pour éclairer l'orientation de cette analyse. D'une part, des dispositions réglementaires et législatives nouvelles prises récemment vont modifier une partie, certes limitée, du cadre préalablement défini par la loi de 1998 et les textes d'application. D'autre part, la survenance d'événements spectaculaires ou de développements factuels qui n'avaient pas été envisagés il y a cinq ans amènent, au-delà de la stricte évaluation de la loi et des instances et mécanismes qu'elle a crée, à se demander si la sécurité sanitaire ne risque pas d'être mise en cause alors que ces textes et instances paraîtraient atteindre les objectifs qui leur ont été assignés il y a quelques années.
Enfin, une observation liminaire doit être formulée s'agissant de l'appréciation de la valeur de l'expertise qui par définition est un volet important de l'activité de l'AFSSAPS. Il ne saurait être question d'évaluer la qualité du travail scientifique car la tâche n'est pas plus accessible à l'Office qu'elle ne l'est aux deux inspections générales qui ont réalisé l'audit. Celles-ci ont précisé dans leur rapport que « cet examen a porté essentiellement sur l'organisation et les procédures internes, la mission ne pouvant se prononcer sur la qualité scientifique de la production de l'Agence ».
Le Directeur général de la santé, M. Lucien Abenhaïm, dans sa réponse (24 juin 2003) aux deux inspections générales avait fait sur ce point l'observation suivante :
« En premier lieu, le rapport indique que les auteurs ne sont pas en mesure de juger de la qualité scientifique des travaux menés par l'agence. Vous comprendrez que, dans la mesure où il s'agit du fondement même de la mission de l'agence, ce constat me rende perplexe. Le rapport porte donc plus sur des aspects de gestion que de fond, ce qui, sans diminuer son intérêt, limite sa portée et les conséquences que l'on peut en tirer pour l'avenir. La seule remarque sur la qualité globalement satisfaisante des travaux de l'agence dans ses missions de sécurité sanitaire étant celle du directeur général de la santé, je tiens à ce qu'elle apparaisse dans le rapport ».
Quelques mois plus tard, le 17 novembre 2003, en vue de l'évaluation de la loi du 1 er juillet 1998, les quatre inspections générales étaient saisies par une lettre de mission dans laquelle il était précisé notamment :
« Nous demandons aussi à la mission d'apprécier la qualité scientifique et technique de l'activité des établissements : la pertinence scientifique de leurs actions, qu'elles résultent de leur initiative propre ou qu'elles répondent à une commande de l'administration, sera évaluée tant sous un angle individuel que sous celui d'une participation globale au renforcement de la veille et de la sécurité sanitaire ».
Le rapport d'évaluation de mai 2004 comprend sur ce point, en forme de réponse, la précision suivante :
« La deuxième interrogation a porté sur le contenu de « l'évaluation de la qualité scientifique et technique des établissements » demandée dans la lettre de mission. Les experts scientifiques associés à la mission ont estimé, au terme d'une réflexion partagée avec les membres des inspections générales, qu'il ne leur était pas possible dans les délais impartis et dans le format prévu, de procéder à une évaluation de l'activité scientifique des établissements selon les méthodes et standards qui gouvernent ce type de processus ».
Le problème peut se résumer simplement dans la question « qui peut expertiser l'expertise et comment ? ». C'est l'une des difficultés qui caractérise de manière récurrente ce domaine.
On rappellera tout d'abord l'ampleur des missions de l'AFSSAPS et la structure qui a été conçue et développée pour les remplir. Les difficultés de la montée en puissance, déjà largement analysées précédemment, seront précisées et remises en perspective.
La stabilisation en vue sera appréciée en elle-même, mais aussi à la lumière des modifications institutionnelles qui peuvent la remettre en cause.
Enfin, deux aspects plus factuels déjà évoqués constitueront les deux derniers développements : d'une part les interrogations sur la position de l'Agence face à des dossiers d'actualité particulièrement sensibles, notamment au sujet de médicaments ayant fait l'objet d'un retrait, d'autre part les risques émergents.
I. UNE STRUCTURE AUX MISSIONS ÉTENDUES
L'Agence du médicament, préfiguration de l'AFSSAPS, créée par la loi n° 93-5 du 5 janvier 1993 témoignait déjà d'une volonté de conférer une autonomie certaine et des moyens importants à la hauteur des défis passés et à venir. A ces défis, identifiés, la direction de la pharmacie et l'Inspection du ministère de la santé ainsi que le laboratoire national de la santé ne pouvaient plus faire face.
On doit souligner que cette nouvelle forme d'organisation et d'exercice des compétences de l'Etat a essaimé dans d'autres champs de la sécurité sanitaire en 1998 avec l'AFSSA et l'InVS. Elle constitue donc une innovation, un précédent et un cas d'école.
1.1. Un domaine étendu
L'expérience de l'Agence du médicament s'est en effet révélée positive : dans leur rapport, MM. Claude Huriet et Charles Descours 30 ( * ) intitulaient en effet ainsi le paragraphe sur le médicament : « la sécurité sanitaire du médicament à usage humain : le bilan et les perspectives sont satisfaisants ». Cette remarque a d'autant plus de portée que les critiques faites dans d'autres domaines étaient à la fois rigoureuses et sévères (cf. supra).
Dans le cas des dispositifs médicaux précisément, l'analyse de la situation amènerait à des conclusions inquiétantes dont certaines, malheureusement, restent actuelles en raison de la faiblesse du dispositif européen qui perdure. Il s'agit d'un des domaines dont le transfert à la nouvelle agence, l'AFSSAPS, illustre l'extension des compétences par rapport à l'Agence du médicament.
L'agence sanitaire qu'est l'AFSSAPS a vu ses compétences inclure désormais, au-delà du médicament : (art. L. 5311-1 du code de la santé publique, liste non limitative) :
-- les biomatériaux et dispositifs médicaux : sous ce dernier terme, on désigne des éléments très nombreux : prothèses, orthèses, matériels et produits de diagnostic, matériel médical et hospitalier (cas de lits d'hôpital pour lesquels un grave problème de sécurité s'est notamment posé).
-- les produits contraceptifs et contragestifs,
-- les produits sanguins labiles, l'EFS (Etablissement français du sang) étant l'opérateur dans ce domaine,
-- les organes, tissus et cellules sous réserve des dispositions nouvelles contenues dans la loi du 6 août 2004 relative à la bioéthique,
-- les produits de thérapie génique et cellulaire,
-- les produits thérapeutiques annexes,
-- les réactifs de laboratoire,
-- les produits insecticides et antiparasitaires à usage humain,
-- les aliments diététiques destinés à des fins médicales spéciales,
-- les produits cosmétiques et d'hygiène corporelle.
Les travaux parlementaires et l'ensemble de la réflexion qui ont eu lieu sur la problématique de la sécurité sanitaire entre 1993 et 1998 ont convergé vers le choix d'une agence unique pour tous les produits de santé ; on verra que l'expérience ultérieure a validé à nouveau cette option qu'il convient encore de confirmer aujourd'hui. L'approche par produit dans un domaine large, mais bien défini et cohérent, parcellisant l'action de l'Etat reste donc à éviter, pour ne pas dire à proscrire. Cette remarque a d'autant plus d'intérêt que des modifications du périmètre de l'AFSSAPS ont pu être envisagées ou ont été dans certains cas réalisées.
1.2. Des pouvoirs renforcés
L'AFSSAPS étant chargée non seulement de l'évaluation du risque en matière de produits de santé, mais encore de sa gestion (ce qui la différencie fondamentalement de l'AFSSA), elle est investie de pouvoirs importants en rapport avec cette responsabilité générale. Ainsi la majorité des décisions dans son domaine de compétences exclusives sont prises par le directeur général au nom de l'Etat et non par le ministre sur avis de l'Agence. Le ministre dispose toutefois d'un pouvoir d'opposition 31 ( * ) :
« Les décisions prises par le directeur général en application du présent article ne sont susceptibles d'aucun recours hiérarchique. Toutefois, en cas de menace grave pour la santé publique, le ministre chargé de la santé peut s'opposer, par arrêté motivé, à la décision du directeur général et lui demander de procéder, dans le délai de trente jours, à un nouvel examen du dossier ayant servi de fondement à ladite décision. Cette opposition est suspensive de l'application de cette décision ».
* L'extension du champ d'intervention de l'AFSSAPS par rapport à l'Agence du médicament s'est accompagnée d'un renforcement de ses prérogatives dans les domaines nouveaux par rapport à celles que détenaient jusque là les entités administratives qui en étaient chargées.
Ainsi, un régime déclaratoire est prévu pour les établissements de fabrication, d'importation ou de distribution de matières premières destinées à l'usage pharmaceutique (avec imposition des règles de bonnes pratiques), de dispositifs médicaux et de dispositifs de diagnostic in vitro.
Le régime d'autorisation s'applique aux produits thérapeutiques annexes et aux essais cliniques portant sur les thérapies génique et cellulaire.
Il y a lieu de rappeler également que la réforme des essais cliniques qui vient d'être adoptée avec la transposition de la directive européenne sur ce sujet, confère de nouvelles compétences assez lourdes à l'AFSSAPS (cf. infra partie III). Certaines de ces nouvelles prérogatives seront d'ailleurs évoquées dans les développements relatifs à la montée en puissance et à l'objectif de stabilisation. Enfin, on n'oubliera pas que l'Agence est chargée du contrôle de la publicité de tous les produits, objets, appareils et méthodes revendiquant une finalité sanitaire.
* L'AFSSAPS dispose par la loi de 1998 de pouvoirs de police étendus qui visent tous les produits de santé qu'ils soient ou non soumis à autorisation (déclaration etc ...), et qui peuvent être mis en oeuvre dès lors qu'un produit présente ou est soupçonné de présenter, dans des conditions normales d'emploi, un danger pour la santé. Le cadre de sa fonction, donc de ses pouvoirs de police sanitaire, est très large puisqu'il va, pour tous les produits de santé, des essais cliniques à l'évaluation médico-technique et de la mise sur le marché à la vigilance sanitaire.
L'AFSSAPS a donc le pouvoir :
-- d'interdire ou de suspendre, en cas de danger pour la santé humaine, toute activité relative à un produit de santé non soumis à une procédure d'autorisation ou d'enregistrement préalable (produits cosmétiques, préparations magistrales, dispositifs médicaux, produits sanguins labiles, organes, etc),
-- d'interdire une activité illégale lorsqu'un produit est mis sur le marché sans avoir obtenu l'autorisation, la certification ou l'enregistrement préalable exigé pour ce produit,
-- de faire procéder, en cas de décision d'interdiction ou de suspension, au retrait, voire à la destruction, de tout produit dangereux.
* Les fonctions d'inspection qui préexistaient à la création de l'AFSSAPS ont été sensiblement renforcées et étendues dans le temps (suppression de toute plage horaire) et dans l'espace (tous locaux, lieux, installations et véhicules) et tout type de données. Les pouvoirs de consignation et de saisie ont été accrus, mais semblent encore insuffisants (exigence pour la saisie d'une autorisation du président du tribunal de grande instance).
1.3. Les structures de l'AFSSAPS
Pour faire face aux compétences étendues et aux responsabilités importantes qui sont les siennes, l'AFSSAPS a été dotée de moyens importants (cf. infra) sachant que son effectif atteint maintenant 940 personnes (730 en 1999) dont les deux tiers environ sont médecins, pharmaciens, scientifiques et techniciens.
* La structure interne de l'Agence a été logiquement calée à partir des catégories de produits d'une part (médicaments, dispositifs) et de fonctions d'autre part (direction des laboratoires et des contrôles, de l'inspection et des établissements, de l'administration et des finances). Toutefois, des changements substantiels ont été opérés depuis 1999 et aussi au cours des deux dernières années. Ces changements s'expliquent principalement par deux facteurs.
D'une part, la structure d'origine avait une empreinte historique qui appelait des retouches, mais plus grave, certains dysfonctionnements constatés par les inspections, en ce qui concerne l'administration générale, les finances et les systèmes d'information exigeaient une remise en ordre selon une structure plus opérationnelle. C'est ce qui a été réalisé au cours de l'année écoulée et semble répondre aux demandes des inspections et audits.
D'autre part, certains changements sont directement le produit de modifications des liens juridiques, (responsabilité du secrétariat de la transparence à la DGS en septembre 2003), y compris au niveau de la loi avec le transfert de la Commission de la transparence à la nouvelle HAS (Haute Autorité de Santé).
C'est pourquoi l'organigramme ci-après, qui est celui d'août 2004, comporte des différences sensibles avec celui du début 2003, mais il va également être modifié pour tenir compte du changement qui vient d'être évoqué (sur les conséquences éventuelles de ce changement. cf. infra partie III).
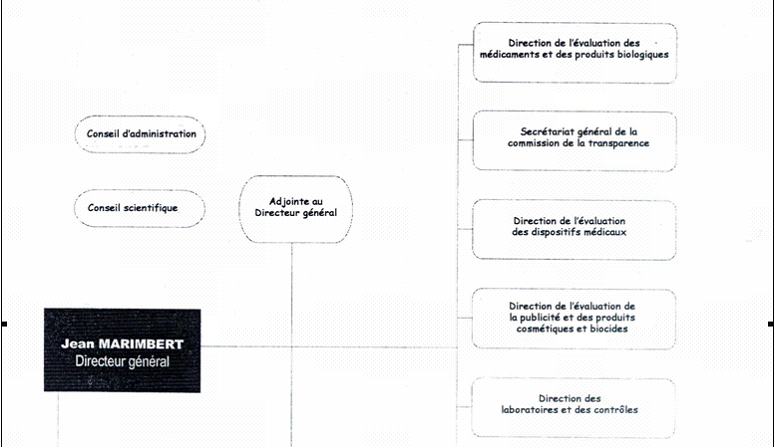
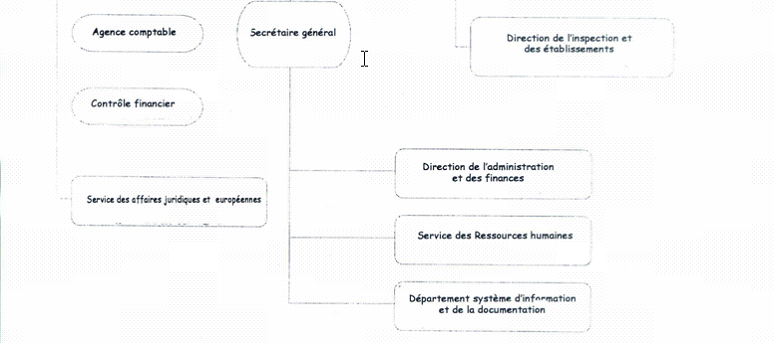
* Par rapport à la précédente structure, plusieurs remarques peuvent être faites :
-- le poste de directeur auprès du directeur général dont la justification de principe et l'efficacité dans les faits avait été contestée, a été supprimé.
-- Les trois unités de logistique administrative sont désormais sous l'autorité directe du secrétaire général. D'autres modifications importantes sont intervenues dans ce domaine : ainsi une cellule d'audit interne est en prise directe avec le secrétaire général. Seul désormais le service des affaires juridiques et européennes relève du directeur général.
-- les directions opérationnelles par produits et fonctions qui constituent en quelque sorte le coeur de métier de l'AFSSAPS ont été peu ou pas concernées par les modifications :
• évaluation des médicaments et
des produits biologiques,
• évaluation des dispositifs
médicaux,
• laboratoires et contrôles ; au
sujet de cette direction, l'audit IGF/IGAS notait (page 39) :
« Globalement, les modalités actuelles de pilotage et de
management de la DLC sont satisfaisantes »,
• inspections et établissements. L'audit
indiquait au sujet de cette dernière : « Si
l'organisation de la direction n'appelle pas d'observation, en revanche elle a
connu des difficultés en matière de recrutement. La
spécificité et les sujétions du métier d'inspecteur
ne permettent pas d'attirer de nombreux candidats en l'absence de statut
adapté ».
La direction des études médico-économiques et de l'information scientifique (DEMEIS) avait précédemment en charge le secrétariat de la commission de la transparence et donc l'interface médico-économique du médicament en particulier. La Transparence faisant depuis l'automne 2003 l'objet d'une structure qui lui est exclusivement dédiée, la DEMEIS a été transformée pour devenir la direction de l'évaluation de la publicité et des produits cosmétiques et biocides. Le secrétariat de la CEPP (commission d'évaluation des produits et prestations) a pour sa part rejoint la direction de l'évaluation des dispositifs médicaux. Les missions sur les recommandations de bonnes pratiques qui étaient partagées entre la DEMEIS et la direction de l'évaluation des médicaments et des produits biologiques (DEMEB) sont désormais toutes regroupées au sein de cette dernière.
La DEMEB avait elle-même été réorganisée dans une perspective appréciée par l'audit IGF/IGAS qui a eu lieu alors que celui-ci était en cours (op. cit. page 36-37) :
« Désormais, la DEMEB sera composée de 6 départements et de 3 services rattachés au directeur. Cette nouvelle organisation vise à donner plus de cohérence aux différentes fonctions :
-- la suppression du département des vigilances, par l'intégration des différentes unités la composant aux départements spécialisés dans l'évaluation du médicament est une mesure cohérente et pertinente.
La création d'un département de l'évaluation des produits hors AMM répond aussi à ce souci de cohérence interne en regroupant les unités en charge des ATU, des essais cliniques, des préparations hospitalières et les médicaments orphelins.
La création d'un département de l'information, de la communication et de la gestion des risques sur le médicament humain, intégrant la coordination des vigilances est encore plus nécessaire.
Actuellement, avant même la réorganisation, la coopération entre les unités de la DEMEB est de bon niveau. En effet, la synergie des travaux est assurée dans une participation croisée des différentes unités aux divers groupes de travail constitués au sein de la DEMEB. Cependant, la réorganisation envisagée devrait permettre une plus grande transversalité interne à la direction ».
Il est à souhaiter que cette structure réaménagée, qui correspond aux besoins identifiés et aux évolutions nécessaires liées aux réalités de terrain, ne soit pas rapidement remise en cause par des décisions extérieures à l'AFSSAPS.
1.4. Des moyens importants
Afin de concrétiser la volonté politique forte qui est à l'origine de la création des agences sanitaires en général, et de l'AFSSAPS en particulier, l'Etat a doté largement ces nouveaux acteurs de moyens financiers.
1.4.1. Les apports budgétaires
* Les dépenses inscrites au compte financier de l'AFSSAPS ont cru de la manière suivante :
Evaluation des charges de l'AFSSAPS (compte financier)
(en millions d'€)
|
1999 |
2000 |
2001 |
2002 |
2003 |
2004 |
|
|
Charges de fonctionnement |
44,6 |
55,8 |
56,5 |
70,6 |
86,4 |
92,16 |
|
Charges d'investissement |
50,44 |
53,2 |
60,1 |
12,4 |
4,1 |
4,56 |
Source : Direction du budget - Données du budget primitif
Il faut souligner qu'il y a eu surestimation systématique des dépenses de l'Agence dans le budget primitif, mais que cette tendance est en réduction après avoir dépassé les 20 % lors des premiers exercices significatifs. Ces surestimations ont été dues entre autres aux lenteurs du recrutement de nouveaux personnels, et à la suspension d'une opération immobilière. Les excédents d'exploitation constatés à la fin de chaque exercice ont entraîné la constitution d'un fonds de roulement considérable qui en 2002 à 37,4 millions d'euros représentait 6,4 fois le niveau jugé incompressible. La baisse des charges d'investissement témoigne de la correction opérée.
Cette situation a entraîné des remarques et des critiques tant de la part de la Cour des Comptes que des inspections générales et de la Commission des finances du Sénat (rapport d'information de M. Adrien Gouteyron n° 404 (2002-2003) du 16 juillet 2003. L'AFSSAPS : sortir de la crise de croissance (pages 49 et 50) :
« Il paraît de meilleure gestion de ramener le fonds de roulement de l'Agence à un niveau plus raisonnable, les établissements publics n'ayant pas à se constituer de telles réserves de trésorerie. (...)
Votre rapporteur croit néanmoins que l'aisance financière de l'AFSSAPS a pu, en partie, expliquer l'absence de comptabilité analytique en son sein, lui faisant négliger les réformes à entreprendre pour atteindre une réelle performance dans sa gestion ».
Enfin, le poids important de la gestion dans le domaine immobilier est également noté en des termes dépourvus d'ambiguïté :
« Or, les ambitions immobilières de l'Agence ont été contrariées, en grande partie en raison des carences de ses propres services administratifs et juridiques, et ont dû être, sinon abandonnées, du moins repoussées à une échéance inconnue. L'IGF et l'IGAS ont d'ailleurs indiqué à votre rapporteur que « toute la politique immobilière de l'Agence est à revoir ! »
Ces difficultés s'inscrivent dans le cadre de l'insuffisance de la gestion administrative et financière qui est abordée dans la partie II de la partie du présent rapport consacré à l'AFSSAPS (cf. infra).
1.4.2. L'apport des industriels
* La part des taxes, droits et redevances dans les recettes de l'AFSSAPS est un élément spécifique à cette Agence qui doit entrer en ligne de compte dans l'appréciation de sa situation financière passée, actuelle et surtout à venir (les dispositions relatives aux domaines nouveaux pour elle sont entrés en vigueur progressivement (2002). La part de l'ensemble de ces taxes en pourcentage des recettes de fonctionnement s'est élevée de 50,8 % en 2000 à 51 % en 2002 et à 82 % en 2003. Corrélativement, l'ensemble des subventions d'exploitation du budget de l'Etat à l'AFSSAPS a évolué ainsi en pourcentage des recettes de fonctionnement :
|
1999 |
2000 |
2001 |
2002 |
2003 |
|
35,1 % |
40,5 % |
24,5 % |
22,1 % |
8 % |
Cette évolution est quelque peu chaotique, mais s'explique clairement par les facteurs qui viennent d'être évoqués auxquels s'ajoute en 2003 « la volonté des tutelles d'assécher le fonds de roulement de l'établissement » (rapport précité de M. Adrien Gouteyron au nom de la Commission des finances du Sénat (juillet 2003). Evoquant le niveau de ces subventions de l'Etat à l'AFSSAPS, le rapport des quatre inspections précité (mai 2004) note (volume I, page 16) :
« Pour l'AFSSAPS, cette part varie considérablement, de 8 à 40 % sur la période, au rythme des régulations budgétaires et des augmentations des tarifs de redevance. Le niveau de 8 % est sans doute, en tendance, excessivement bas, sauf à installer l'idée que l'AFSSAPS a plus de comptes à rendre à l'industrie qui la finance qu'à l'Etat ».
Il apparaît clairement qu'il serait malsain que le financement de l'AFSSAPS relève complètement des industries concernées au-delà de ce que la logique administrative et même politique voudrait. Un certain nombre de tâches d'expertise générale de veille scientifique et technologique, à commencer par la pharmacovigilance et la totalité des inspections relèvent de la responsabilité de l'Etat et à ce titre celui-ci doit y participer à due concurrence.
Cette très rapide évocation des moyens consacrés à l'AFSSAPS illustre déjà la nécessité de ne pas changer, encore moins bouleverser, le périmètre de compétences, ce que les quatre inspections ont désigné par l'expression « un paysage institutionnel en continuelle évolution ». C'est là une analyse qui s'est rapidement imposée dès le début de l'évaluation à laquelle il est procédé ici pour tous les domaines couverts par la loi de 1998. On verra plus loin que cette mise en garde est pour le moins fondée.
* 30 Renforcer la sécurité sanitaire en France - Sénat 1996-1997 n° 196 page 22.
* 31 Art. 5322-2 du Code de la santé publique.







