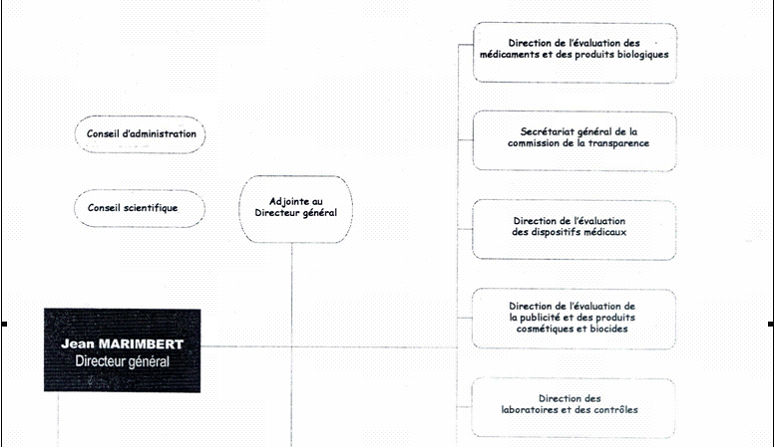
2. La commission de la transparence
Le ministère de la santé a souhaité rationaliser cette organisation et un choix a été exprimé par un décret de septembre 2003 qui a transformé la direction des études médico-économiques et de l'information scientifique (DEMEIS) de l'AFSSAPS en créant un secrétariat général à la commission de la transparence (le titulaire de la DEMEIS a lui-même été nommé à ce nouveau poste) et lui rattachant le FOPIM.
L'un des principes de cette réforme était « d'autonomiser » le secrétariat de la commission de la transparence, conformément à sa spécificité qui la distinguait nettement des autres commissions. Son caractère scientifique exclusif a été affirmé et maîtrisé ; les 20 membres titulaires ayant voix délibérative sont désormais des scientifiques, les huit membres représentant les administrations, les représentants des organismes d'assurance maladie et de l'industrie pharmaceutique siégeant désormais à titre consultatif.
Ce réaménagement des structures répond à un souci de cohérence en mettant fin à une complexité excessive, elle-même génératrice de pertes d'énergie et de frictions ; toutefois, elle contredisait une observation faite par les inspections générales (page 58) :
« Il existe un lien entre l'appréciation du service médical rendu effectué par la commission de la transparence et les compétences médico-scientifiques de l'Agence. Pour cette raison, le rattachement de cette commission à l'Agence est justifié. En revanche, les décisions relatives à l'admission du remboursement ne relèvent pas de l'AFSSAPS ».
On touche la difficulté liée à l'ambivalence de travaux d'analyse scientifique, y compris le rapport bénéfice/risque et l'analyse économique au sens du service médical rendu.
* Cette nouvelle structuration des compétences n'aura pu être vraiment appréciée puisqu'une nouvelle organisation est mise en place avec le transfert de la commission de la transparence au sein de la Haute Autorité de Santé crée par la loi relative à l'assurance maladie du 13 août 2004 et la suppression de l'ANAES intégrée au sein de la nouvelle HAS. L'approche économique a ainsi entraîné l'instance qui a aussi en charge l'appréciation médico scientifique du médicament en dehors du périmètre de l'AFSSAPS.
En outre, la nouvelle HAS accueillera en son sein la CEPP (commission d'évaluation des prestations et des produits).
Le nouvel article L. 161-37 du code de la sécurité sociale (art. 35 de la loi du 13 août 2004) précise ainsi les compétences de la nouvelle HAS :
« Art. L. 161-37 - La Haute autorité de santé, autorité publique indépendante à caractère scientifique dotée de la personnalité morale, est chargée de :
1°) Procéder à l'évaluation périodique du service attendu des produits, actes ou prestations de santé et du service qu'ils rendent, et contribuer par ses avis à l'élaboration des décisions relatives à l'inscription, au remboursement et à la prise en charge par l'assurance maladie des produits, actes ou prestations de santé ainsi qu'aux conditions particulières de prise en charge des soins dispensés aux personnes atteintes d'affections de longue durée. A cet effet, elle émet également un avis sur les conditions de prescription, de réalisation ou d'emploi des actes, produits ou prestations de santé et réalise ou valide des études d'évaluation des technologies de santé.
2°) Elaborer les guides de bon usage des soins ou les recommandations de bonne pratique, procéder à leur diffusion et contribuer à l'information des professionnels de santé et du public dans ces domaines, sans préjudice des mesures prises par l'Agence française de sécurité sanitaire des produits de santé dans le cadre de ses missions de sécurité sanitaire.
3°) Etablir et mettre en oeuvre des procédures d'évaluation des pratiques professionnelles et d'accréditation des professionnels et des équipes médicales mentionnées à l'article L. 1414-3-3 du code de la santé publique ; (...)
En outre, d'autres dispositions précisent les prérogatives de la nouvelle HAS en matière « d'évaluation de service attendu d'un produit, d'un acte ou d'une prestation de santé » à laquelle elle peut procéder, mais prévoit également que :
« Sans préjudice des mesures prises par l'Agence française de sécurité sanitaire des produits de santé dans le cadre de ses missions de sécurité sanitaire et notamment celles prises en application du 2° de l'article L.5311-2 du code de la santé publique, la Haute autorité de santé fixe les orientations en vue de l'élaboration et de la diffusion des recommandations de bonne pratique de l'Agence française de sécurité sanitaire des produits de santé mentionnée à l'article L. 5311-1 du même code et procède à leur diffusion ».
Dans ce domaine des référentiels de bonne pratique, l'AFSSAPS verra donc « ses orientations en vue de l'élaboration et de la diffusion des recommandations de bonne pratique » fixées par la Haute Autorité de Santé, autorité publique indépendante à caractère scientifique tout en continuant à être sous la tutelle de la Direction générale de la santé du ministère.
Un schéma publié le 27 janvier 2005 par le journal « Le Monde » illustre bien le positionnement du « nouvel organisme dans la galaxie du contrôle de la santé ».
Un nouvel organisme dans la galaxie du contrôle de la santé
Source : Le Monde du 27 janvier 2005
La simplification souhaitée des différents côtés ne semble pas trouver ici la concrétisation que l'on pouvait espérer. La situation inédite dans laquelle ce domaine va se trouver nécessitera certainement de nouvelles clarifications.
IV. UNE ACTUALITÉ LOURDE D'INTERROGATIONS
Au-delà de l'évaluation du fonctionnement de l'AFSSAPS, ainsi que des mécanismes auxquels elle participe avec d'autres acteurs français et européens, des interrogations se posent dans son « coeur de métier », essentiellement sur la iatrogénie médicamenteuse et les essais cliniques dont l'expertise est dépendante. L'ampleur des problèmes qui rentrent dans ce cadre dépasse largement non seulement l'AFSSAPS elle-même, mais toutes les agences et administrations compétentes en matière de médicaments. Il ne s'agit donc en aucun cas d'une mise en cause ciblée de l'AFSSAPS qui, n'a guère à craindre les comparaisons internationales, mais de la présentation d'une vaste question qui constitue le fondement même de la sécurité des produits de santé, en l'occurrence des médicaments.
Dans le cadre limité de cette évaluation, on rappellera d'abord la nécessité de la pharmacovigilance renforcée par les accidents iatrogènes et on indiquera les inquiétudes pointées par les praticiens. Plusieurs cas de médicaments soulevant de véritables crises au niveau mondial depuis 2000 constitueront ensuite des illustrations de cette problématique difficile.







