B. LES POUVOIRS PUBLICS AURONT LA MISSION ESSENTIELLE DE FAÇONNER LE CADRE APPLICABLE À CETTE TECHNOLOGIE
1. Partout dans le monde, la commercialisation requiert une autorisation de mise sur le marché fondée sur une évaluation de la sécurité sanitaire des produits
a) Au sein de l'Union européenne, l'autorisation de mise sur le marché des aliments cellulaires devra suivre une procédure règlementaire déjà clairement définie
(1) L'autorité européenne de sécurité des aliments (EFSA) procède à l'évaluation scientifique des « nouveaux aliments » au prisme de leur sécurité sanitaire
Dans l'Union européenne, le règlement dit « novel food41(*) » (nouveaux aliments) 2015/2283 du 25 novembre 2015 décrit précisément la procédure d'autorisation de mise sur le marché des nouveaux aliments, qui sont définis comme ceux « dont la consommation humaine est restée négligeable au sein de l'Union avant le 15 mai 1997 », soit la date d'entrée en vigueur du premier règlement42(*).
Lorsque le règlement de 2015 a remplacé celui, plus succinct, de 1997, six nouvelles catégories ont été introduites pour tenir compte de « l'évolution scientifique et technologique depuis 1997 ». C'est à cette occasion qu'ont été incluses « les denrées alimentaires qui se composent de cultures cellulaires ou tissulaires dérivées d'animaux, de végétaux, de micro-organismes, de champignons ou d'algues ou qui sont isolées ou produites à partir de cultures cellulaires ou tissulaires dérivées d'animaux » (article 3(2)(vi) du règlement). Dans l'ordre juridique de l'Union, les aliments cellulaires existent exclusivement sous ce vocable générique de « nouvel aliment ».
Les deux catégories aliments et ingrédients contenant des organismes génétiquement modifiés (OGM) ou produits à partir d'OGM ont en revanche été retirés de ce régime après 1997 pour être assujettis à une règlementation spécifique (règlement n° 1829/2003 du 22 septembre 200343(*)). Par conséquent, les aliments cellulaires fabriqués à partir d'OGM n'entrent pas dans le champ d'application du règlement « nouveaux aliments », mais dans celui du règlement « OGM », la procédure d'autorisation étant a priori plus longue.
Dix catégories, n'ayant d'autre lien que celui de « la consommation humaine négligeable avant 1997 », relèvent donc du règlement.
Source : EFSA
Concrètement, les exemples de nouveaux aliments pour lesquels une mise sur le marché a été autorisée ces dernières années témoignent du caractère générique de cette catégorie et de l'hétérogénéité des produits la composant.
Source : EFSA
À l'instar de l'ensemble de ces denrées, les aliments cellulaires seront soumis à un examen scientifique rigoureux, qui prend nécessairement du temps :
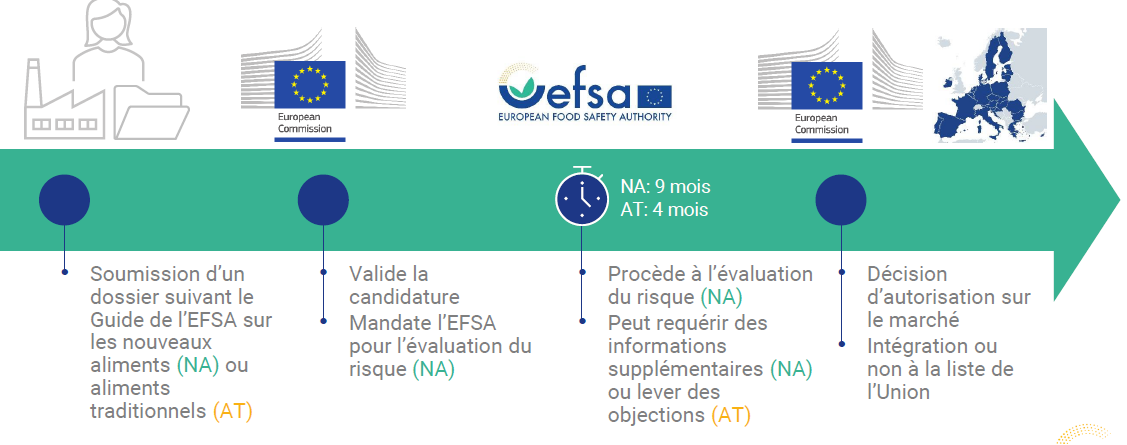
· l'initiative relève soit d'une entreprise souhaitant commercialiser un nouvel aliment et soumettant un dossier à la Commission européenne, soit, en théorie, de la Commission elle-même. Cette dernière vérifie simplement la complétude du dossier, s'appuyant pour ce faire depuis 2016 sur un guide de l'EFSA44(*), régulièrement mis à jour et destiné à aiguiller les candidats dans la constitution du dossier ;
· le dossier est ensuite mis à disposition des États membres et, au plus tard un mois après sa validation, la Commission peut donner mandat (article 11) à l'autorité européenne de sécurité alimentaire (EFSA) pour procéder à une évaluation scientifique de la sécurité sanitaire du produit dans un délai de neuf mois - ce délai pouvant être prolongé pour solliciter des informations supplémentaires auprès du demandeur. Au sein de l'EFSA, un groupe de travail est chargé d'établir une première version de l'évaluation, qui est relue par un panel de seize experts, avant d'être rendue publique dans le journal de l'EFSA.
Les entreprises produisant des « aliments cellulaires » ou de la caséine par fermentation de précision déplorent l'absence d'un dialogue formel entre elles et les autorités européennes en amont du dépôt du dossier, qui serait une singularité de l'Union, par contraste avec le processus itératif existant, selon elles, avec d'autres autorités dans le monde. L'EFSA a rappelé les progrès réalisés dans la suite du règlement (UE) 2019/1381 dit « transparence45(*) », et notamment la mise en place progressive de conseils de pré-admission46(*), tout en soulignant l'impératif d'égalité de traitement entre les candidats.
D'après les services de la DG Santé de la Commision et de l'EFSA, il est en effet très probable que l'évaluation des aliments cellulaires, produits très innovants, prenne davantage que neuf mois. Pour justifier la durée de la procédure, ces services ont rappelé en audition être « ouverts à l'innovation, tout en étant garants de la sécurité sanitaire de l'alimentation ». Par le passé, plusieurs organisations non gouvernementales ont mis en doute la bonne application du principe de précaution par les autorités règlementaires, dont l'EFSA, à l'occasion de certaines controverses sur le recours à des substances phytosanitaires, comme le glyphosate, ou encore à des additifs dans l'alimentation. Pour l'entreprise Gourmey la procédure fixée dans le règlement « nouveaux aliments » est, « en soi, une application du principe de précaution47(*) ».
Pour ajouter un nouvel aliment à la liste des produits autorisés, il n'est pas nécessaire de prouver ses bienfaits ; il suffit de respecter trois conditions générales48(*) :
· le nouvel aliment doit être aussi sûr qu'une denrée alimentaire (...) comparable déjà mise sur le marché de l'Union ;
· la composition et les conditions d'utilisation du nouvel aliment ne doivent présenter aucun risque en matière de sécurité pour la santé humaine ;
· un nouvel aliment destiné à remplacer un autre aliment ne doit pas différer de cet aliment d'une manière telle que sa consommation normale serait désavantageuse pour le consommateur sur le plan nutritionnel.
Plus en détail, l'évaluation par l'EFSA impose aux entreprises de transmettre des informations précises sur le procédé de fabrication - et donc, dans le cas des « aliments cellulaires », sur le milieu de culture -, l'identité chimique, les qualités nutritionnelles du produit, mais aussi les spécifications et conditions d'utilisation - par exemple, la forme prévue du produit ou le circuit de distribution - ainsi que les doses toxicologiques associées à ces conditions49(*).
L'autorisation peut être générique, mais uniquement si les caractéristiques de fabrication ou du produit sont similaires. Or, chaque entreprise ayant des méthodes différentes, il est probable que les entreprises doivent demander au cas par cas des autorisations. De même, si l'échelle de production implique des changements trop importants de ces caractéristiques, la Commission pourrait exiger une nouvelle autorisation.
(2) Une procédure centralisée au niveau de la Commission européenne, dans laquelle la France n'est pas décisionnaire
En définitive, c'est la Commission européenne sur avis de l'EFSA, et non l'EFSA elle-même, qui autorisera ou non la mise sur le marché des aliments cellulaires. La décision est donc politique et non purement technique, bien qu'elle s'appuie sur une expertise technique.
Une fois l'avis de l'EFSA publié, la Commission européenne a sept mois pour présenter un projet d'acte d'exécution autorisant la mise sur le marché50(*) aux États membres de l'Union, dans le cadre de la procédure de « comitologie51(*) ». En l'espèce, la section dédiée aux nouveaux aliments52(*) du comité permanent des végétaux, des animaux, des denrées alimentaires et des aliments pour animaux53(*), présidée par un chef d'unité de la DG Santé de la Commission et réunissant les fonctionnaires compétents de chaque État membre54(*), est compétente.
Le processus de décision par la Commission européenne associe donc bien, collectivement, les États membres, qui donnent un avis conforme à la majorité qualifiée55(*).
Il faut toutefois souligner que les refus d'autorisation après avis favorable de l'EFSA sont rares. En outre, ils ne sont pas irréversibles juridiquement, la Commission pouvant présenter un nouveau projet sous deux mois ou soumettre son projet à un comité d'appel56(*).
Surtout, la procédure de « comitologie » ne garantit pas à un État membre qui aurait voté contre l'autorisation que son marché domestique soit exempt du produit.
Une fois l'acte d'exécution publié au journal de l'Union européenne, l'autorisation est valable sur l'ensemble du marché intérieur, comme d'ailleurs généralement le droit de l'alimentation, qui relève pour l'essentiel de règlements européens, d'application directe. En effet, la finalité du règlement « nouveaux aliments » est explicitement d'« assurer le bon fonctionnement du marché intérieur tout en garantissant un niveau élevé de protection de la santé humaine et des intérêts des consommateurs » (article 1(2)).
Du reste, il ne serait pas possible d'appliquer un cadre national différent en raison du principe de libre circulation des marchandises inscrit dans les traités européens57(*) et sur lequel veille attentivement la Cour de justice de l'Union européenne.
La seule dérogation à ce principe pourrait provenir de mesures conservatoires de suspension de mise sur le marché qui seraient prises par un État membre pour prévenir « un risque sérieux pour la santé humaine, la santé animale ou l'environnement » et pallier l'inaction de la Commission. Ces « mesures d'urgence58(*) » nécessitent de l'État membre qui les prend une information officielle de la Commission et des autres États membres. S'agissant des nouveaux aliments en tant que tels, qui font l'objet d'une évaluation poussée de l'EFSA au regard de la sécurité sanitaire, cette hypothèse semble toutefois très peu probable et, de fait, il n'existe aucun précédent à ce jour.
Si des produits d`aliments cellulaires ne sont pas autorisés au sein de l'Union, l'importation de ces produits sera bel et bien interdite et le marché intérieur en sera par conséquent exempt, sous réserve que les contrôles à l'importation soient effectifs.
b) Un niveau d'exigence réglementaire moins élevé dans le reste du monde
Hormis dans les États « faillis », aucun État au monde ne permettrait la commercialisation des « aliments cellulaires » sans approbation préalable après évaluation de la sécurité sanitaire du produit.
En revanche, de l'avis des spécialistes entendus par la mission, le niveau d'exigence réglementaire n'est pas homogène d'une autorité réglementaire à l'autre, ce qui peut s'expliquer autant par des considérations culturelles, et notamment un rapport au risque différent.
Aucun dossier n'a été déposé en Europe à ce jour59(*). L'ensemble des personnes entendues par la mission soulignent que le processus d'autorisation de mise sur le marché européen est plus long et plus strict que celui en vigueur aux États-Unis et, a fortiori, à Singapour.
L'État de Singapour, connu pour son environnement favorable fiscal et réglementaire à l'innovation, est regardé par tous les spécialistes comme le plus accessible. La majorité des entreprises européennes interrogées déclarent viser ce marché en priorité.
L'annonce d'une pré-approbation aux États-Unis en novembre 2022, et d'une seconde en mars 2023, est toutefois, de l'avis des entreprises du secteur, plus significative que les autorisations données à Singapour, en raison du degré d'exigence plus élevé des autorités réglementaires américaines et de la taille plus significative du marché américain. Le marché américain est ciblé car l'attention portée à l'alimentation et à la protection des consommateurs y serait culturellement moins forte qu'en Europe.
L'EFSA rappelle qu'il n'existe pas de séparation entre risk management et risk assessment aux États-Unis60(*) et distingue « l'approche américaine, selon laquelle un produit qui n'est pas réputé dangereux est autorisé, de l'approche européenne, qui requiert la preuve que le produit est complètement inoffensif ».
La procédure d'autorisation aux États-Unis
La philosophie du règlement européen « nouveaux aliments » est inspirée de celle qui existe aux États-Unis depuis 1958. Dans ce pays, aux termes des sections 201(s) et 409 de la loi fédérale sur les aliments, les médicaments et les cosmétiques, la Food and Drug Administration (FDA) est compétente pour évaluer scientifiquement que de nouveaux aliments - non consommés avant 1958 - sont « généralement reconnus comme sûr (« generally recognized as safe », GRAS).
Aux États-Unis, où la mise sur le marché des « aliments cellulaires » n'a pas encore été définitivement approuvée, les régulateurs ont créé un cadre réglementaire spécifique aux aliments cultivés à partir de cellules animales.
Comme le rappelle Cellular Agriculture Europe, la procédure d'autorisation de mise sur le marché est seulement établie provisoirement dans un protocole d'accord61(*) entre les services compétents de la FDA et de l'USDA (U.S. Department of Agriculture, ministère de l'agriculture).
Il semble que dans ce cadre les entreprises « négocient » une à une avec les autorités réglementaires. C'est en suivant cette procédure que l'entreprise Upside Foods a obtenu en novembre 2022, après transmission d'informations complémentaires, une approbation de la FDA (« no questions ask letter ») sur les questions de sécurité sanitaire. La commercialisation ne sera toutefois possible qu'après l'approbation du ministère américain de l'agriculture (USDA) compétent en matière de règles d'inspection et d'étiquetage.
2. Le manque d'anticipation des pouvoirs publics et des filières en France contraste avec les initiatives en cours ailleurs dans le monde.
Outre la compétence, en tant que telle, d'autoriser ou non la mise sur le marché, les pouvoirs législatif et exécutif disposent d'autres leviers ayant une influence, directe ou indirecte, sur la manière dont la production et la consommation des aliments cellulaires peuvent ou non se développer.
a) En France, l'absence de stratégie concertée des pouvoirs publics et des filières présage un « stop-and-go » contre-productif
(1) La ferme opposition des ministres chargés de l'agriculture n'a pas empêché le soutien public à l'innovation en ce domaine
Les prises de position des pouvoirs publics sur le développement des aliments cellulaires sont très tranchées, mais contradictoires.
Ministre de l'agriculture et de l'alimentation en exercice entre juillet 2020 et mai 2022, M. Julien Denormandie, a déclaré très clairement et publiquement, à l'occasion de la première autorisation de mise sur le marché donnée dans le monde, son opposition à la « viande artificielle62(*) ».
Capture d'écran du compte https://twitter.com/J_Denormandie (27/02/2023)
Le Parlement s'est lui aussi rapidement fait l'écho de craintes sur les « aliments cellulaires », et a souhaité mettre rapidement des barrières symboliques à l'entrée de ces produits sur le marché français.
L'amendement « L'aile ou la cuisse »
Sur fond de polémiques sur les menus végétariens dans la restauration publique, l'article 254 de la loi Climat et résilience63(*), issu d'un amendement de l'ancien député LR Julien Aubert, interdit de façon préventive « les denrées alimentaires issues de cultures cellulaires ou tissulaires dérivées d'animaux » dans l'ensemble de la restauration publique : cantines scolaires, restaurants administratifs, prisons, EHPAD...
Extrait du compte rendu intégral des débats de la commission spéciale chargée d'examiner le projet de loi portant lutte contre le dérèglement climatique et renforcement de la résilience face à ses effets, 18/03/2164(*)
Plus récemment, alors que les travaux de la mission d'information de la commission des affaires économiques du Sénat venaient d'être lancés, l'actuel ministre de l'agriculture et de la souveraineté alimentaire, M. Marc Fesneau, a, lui aussi, présenté une position extrêmement réservée sur les aliments cellulaires65(*).
Extrait de l'entretien du ministre de l'Agriculture à Valeurs Actuelles (12 janvier 2023)
Que répondez-vous à ceux qui veulent interdire le sucre ou qui investissent, à l'image de Xavier Niel, pour substituer à la viande des aliments de synthèse ?
« Au-delà des moyens financiers impressionnants qui sont parfois mis sur la table, il y a quelque chose de l'ordre de l'apprenti sorcier, sans recul scientifique pour le développement de la viande cellulaire. Cela ne gêne pas certains au motif qu'il faudrait crier haro sur l'élevage naturel. Les mêmes qui ont critiqué les OGM vous disent qu'on peut manipuler les cellules pour fabriquer de la viande. Et cela ne pose pas de problème éthique ? La viande cellulaire est pourtant une réelle manipulation du vivant : on reconstitue un aliment qui existe naturellement.
C'est plonger avant les temps préhistoriques, dans des temps qui n'ont jamais existé. Les mêmes qui vous parlent de "renaturation" veulent faire un monde sans activité humaine et sans animal. Au-delà, je suis gêné par la démarche d'injonction, de jugement binaire opposant des gentils et des méchants, ceux qui mangent de la viande et ceux qui n'en mangent pas... Je suis frappé par ceux qui prônent la tolérance mais ne respectent pas les majorités, et pas même les minorités qui ne pensent pas comme eux. Il ne faut pas chercher l'innovation pour l'innovation : elle doit aider les agriculteurs, à un coût acceptable, et non pas jouer contre eux, et assurer une réelle souveraineté. »
Compte tenu des moyens financiers colossaux déployés, comment défendre un modèle traditionnel d'alimentation ?
« Il faut connaître le sens profond qui se cache derrière ces démarches. Le monde risque de
se mettre dans les mains de quelques industriels qui décideront un jour de ne plus vous fournir, s'ils le veulent, en protéines animales. C'est pour cela qu'il faut défendre notre agriculture et notre élevage, à taille humaine et diversifiés. C'est une force et un atout pour les consommateurs, et la garantie de la qualité de l'alimentation produite. Ne croyons pas que ces nouveaux industriels déploieront des petites usines de production, ce seront des mastodontes ! Les mêmes qui critiquaient Monsanto laissent accréditer la thèse selon laquelle nous pourrions tous être nourris par des multinationales qui vont faire de la manipulation du vivant.
Cela ne vous surprendra pas qu'en tant que ministre de l'Agriculture et de la Souveraineté alimentaire, je vous affirme que ce n'est pas la vision que je défends ni le modèle que je soutiens ! L'avenir et l'orientation de l'agriculture méritent mieux qu'un débat sur la viande cellulaire. Il faut parler formation, installation des jeunes, transition et capacité de penser la ferme France en 2030. C'est ma feuille de route. »
Dans le même temps, la banque de soutien à l'innovation Bpifrance a indiqué à la mission avoir dépensé 15 M€ d'aides au total au bénéfice de Gourmey et de Vital Meat, qui développent ce produit en France. Il semble que Gourmey, en tant que start-up, ait reçu davantage que Vital Meat, filiale d'un grand groupe. Ces diverses aides, qui se sont échelonnées en plusieurs financements, ont pris la forme de prêts, d'avances remboursables ou de subventions.
Justifiant ces investissements par la recherche d'autonomie protéique et la nécessité de rester à la frontière technologique (dans le cadre du plan deeptech), le pôle agriculture et agroalimentaire de Bpifrance s'est tout de suite senti obligé de relativiser l'effort financier que cela représentait pour la banque. Il a ainsi comparé ces 15 M€ aux 200 M€ dépensés chaque année dans les domaines de l'agriculture et de l'agroalimentaire, et aux 7 Md€ destinés à ces mêmes secteurs sur l'ensemble de la programmation de France 2030.
L'opérateur a en outre précisé que les fonds employés relevaient d'une enveloppe de la Commission européenne et non de crédits gouvernementaux des plans France Relance ou France 2030, laissant entendre que le ministère de l'agriculture et de la souveraineté alimentaire aurait été moins favorable, voire aurait pu faire obstacle, à de tels financements.
Les services de la direction générale de la performance économique ont insisté sur la différence à leurs yeux entre le nécessaire soutien à la recherche, dans la tradition cartésienne et des Lumières de la France, et le soutien à l'application industrielle de cette recherche, qui peut susciter des réserves éthiques et qui devra faire l'objet d'une décision politique.
Après les financements sollicités au stade de l'amorçage et de l'incubation, les entreprises du secteur cherchent des aides à l'application industrielle. Ainsi, l'entreprise Gourmey a candidaté fin 2022 à l'appel à projets « première usine66(*) », dans le cadre du plan France 2030.
Si, conformément à la doctrine France 2030, les ministères ne sont pas décisionnaires pour les projets de moins de 10 millions d'euros de budget, dans ce cas présent, le ministère de l'agriculture et de la souveraineté alimentaire a demandé et obtenu du comité de pilotage ministériel opérationnel du 9 février le rejet de ce dossier pour deux motifs :
- d'abord, en raison de l'absence d'autorisation réglementaire Novel Food à ce jour ;
- ensuite, en raison du manque d'incitativité financière, dans la mesure où l'entreprise a récemment levé 48 millions d'euros.
Pour ajouter à ces contradictions, en mars 2023, un projet de rapport de la commission Agriculture et développement rural du Parlement européen, sur la stratégie de l'UE en matière de protéines, présente « l'agriculture et les produits de la mer cellulaires » comme « des solutions prometteuses et innovantes67(*) ». Enfin, le cabinet du commissaire européen à l'agriculture a indiqué dans un courrier que le programme Horizon Europe finançait, via deux programmes (Giant Leaps et Like A Pro), la recherche sur cette technologie, à hauteur de 25 millions d'euros, pour « mieux connaître et comprendre la capacité des protéines de substitution à contribuer aux objectifs de la stratégie De la ferme à la fourchette et à représenter une source viable de protéines », tout en précisant qu'il ne s'agit pas de « contribuer au développement du marché de ce type de produit ».
(2) Une doctrine interministérielle cohérente, conciliant ces deux approches contradictoires des « aliments cellulaires », fait encore défaut
Parmi les propos tenus par M. Marc Fesneau dans Valeurs Actuelles pendant la conduite des travaux, il faut regretter en particulier l'idée, caricaturale, selon laquelle « l'avenir et l'orientation de l'agriculture méritent mieux qu'un débat sur la viande cellulaire ».
Les auditions et déplacements sur le terrain ont au contraire permis de mesurer l'intérêt des débats soulevés par ce sujet, qui vont bien au-delà de ce seul sujet.
Cette prise de position apparaît caractéristique de ce que l'étudiant Paul Margaron et le directeur de l'École de Guerre Christian Harbulot pointent dans leur rapport :
- le manque d'anticipation des pouvoirs publics et des filières agricoles, qui ont donné l'impression de voir dans les « aliments cellulaires » un problème lointain et marginal ;
- et le manque de concertation entre niveaux de décisions (collectivités, État, UE) et thématiques (agriculture, innovation, transition écologique, industrie)
b) Par contraste, d'autres pays hésitent de moins en moins à appuyer l'innovation en ce domaine
La cartographie des investissements dans ce secteur fait apparaître les États-Unis (699 millions de dollars investis) et Israël (475 M$), ainsi que dans une moindre mesure l'Union européenne (76 M$), Singapour (41 M$) et le Royaume-Uni (36 M$) comme les pôles de maîtrise de cette technologie.
Source : Good Food Institute, Rapport sur l'état du secteur, 202168(*).
(1) Le rôle précurseur de pays disposant de faibles surfaces agricoles utiles
Parmi les précurseurs en matière de production d'« aliments cellulaires », figurent plusieurs pays limités par de fortes contraintes sur leur production agricole, tels que les Pays-Bas, Singapour ou Israël.
Les Pays-Bas, sur fond de crise de leur modèle agricole, soutiennent la structuration d'une filière d'« aliments cellulaires », devenant, de fait, l'acteur principal dans ce domaine en Europe. Le Gouvernement a débloqué en 2022 une enveloppe de 60 millions d'euros, dans le cadre de son fonds national de croissance, pour financer une plateforme publique de recherche fondamentale. Par ailleurs, l'industrie cellulaire est explicitement l'un des cinq piliers de la stratégie néerlandaise pour l'autonomie protéique.
En Israël, l'Autorité de l'innovation a inauguré en avril 2022 le plus grand consortium au monde pour les aliments cellulaires, composé de 14 entreprises69(*) et de 10 universités et centres de recherche. Destiné à favoriser le passage à l'échelle du processus de production et la réduction des coûts de production, ce consortium bénéficie d'un financement de 17 millions d'euros sur trois ans70(*).
En Corée du Sud, un protocole d'accord a été signé entre des entreprises, des universités et des collectivités territoriales, prévoyant notamment un centre de recherche et une zone exempte de réglementation, à Uiseong, afin de présenter le produit plus facilement au public71(*).
(2) L'opportunisme de grandes puissances agricoles
Le ministère de l'agriculture des États-Unis (USDA) a accordé en octobre 2021 une subvention de 10 millions de dollars sur 5 ans à l'université Tufts (Massachusetts) pour lancer en son sein un centre de recherche dédié aux « aliments cellulaires », le National Institute for Cellular Agriculture72(*). Précédemment, l'État de Californie avait accordé 5 millions de dollars à trois campus de l'Université de Californie (Berkeley, UC Davis et UCLA).
Les entreprises du secteur interprètent également un décret du président des États-Unis de septembre 2022, demandant à son administration un rapport sous six mois sur les perspectives des biotechnologies73(*), y compris par la perspective de « cultiver des sources alimentaires alternatives », comme un soutien à l'industrie cellulaire - celle-ci n'est toutefois pas mentionnée explicitement.
En Chine, le « plan national de développement des sciences et technologies agricoles et rurales74(*) » (2021-25), présenté en janvier 2022 par le ministère de l'agriculture et des affaires rurales, mentionne l'« agriculture cellulaire ».
* 41 https://eur-lex.europa.eu/legal-content/FR/TXT/PDF/ ?uri=CELEX :32015R2283
* 42 https://eur-lex.europa.eu/LexUriServ/LexUriServ.do ?uri=OJ :L :1997 :043 :0001 :0006 :FR :PDF
* 43 https://eur-lex.europa.eu/legal-content/FR/TXT/ ?uri=CELEX %3A02003R1829-20 210 327
* 44 https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/sp.efsa.2021.EN-6488
* 45 https://www.anses.fr/fr/content/le-r %C3 %A8glement-europ %C3 %A9en-sur-la-transparence-un-nouveau-cadre-pour-l %E2 %80 %99 %C3 %A9valuation-des-risques-et
* 46 https://www.efsa.europa.eu/en/applications/about/services
* 47 Ce principe figure à l'article 191 du traité sur le fonctionnement de l'Union européenne et s'impose donc au sein de l'UE dans le domaine de l'environnement, comme le rappelle cette étude du Parlement européen : https://www.europarl.europa.eu/RegData/etudes/IDAN/2015/573 876/EPRS_IDA %282 015 %29 573 876_FR.pdf
* 48 Article 7 du règlement 2015/2283.
* 49 Article 10(2) du même règlement.
* 50 Article 12 du règlement « nouveaux aliments ».
* 51 Définie par le règlement (UE) n° 182/2011, la « comitologie » désigne la façon par laquelle les administrations des États membres, réunies en comités, sont associées à l'élaboration par la Commission européennes des actes délégués et des actes d'exécution résultant de règlements ou de directives. En fonction de l'importance de ces textes, ces comités peuvent rendre soit un avis simple à la majorité simple (art. 4) soit un avis conforme à la majorité qualifiée (art. 5).
* 52 « Nouveaux aliments et sécurité toxicologique de la chaîne alimentaire ». https://food.ec.europa.eu/horizontal-topics/committees/paff-committees/novel-food-and-toxicological-safety_en
* 53 Le PAFF committee en anglais, pour « plants, animals, food and feed », institué par le règlement “alimentation” de 2002. https://food.ec.europa.eu/horizontal-topics/committees/paff-committees_en
* 54 La France est représentée par la DGAL, au sein du ministère chargé de l'agriculture, et non plus par la DGCCRF, du ministère chargé de l'économie, depuis la mise en place d'une police unique de la sécurité sanitaire entièrement assurée par la DGAL, à partir de 2022.
* 55 La majorité qualifiée est atteinte, selon la règle de la « double majorité », lorsqu'au moins 55 % des États membres représentant 65 % de la population de l'Union européenne sont favorables à un acte. Pour mémoire, la France représente 3,7 % des États membres et moins de 15 % de la population de l'Union.
* 56 Article 5 du règlement n° 182/2011. Il semble cependant improbable que la Commission européenne autorise la mise sur le marché d'aliments cellulaires sans l'accord des États membres, sur ce sujet sensible politiquement. De façon encore moins plausible, tant juridiquement que politiquement, les articles 7 (circonstances exceptionnelles) et 8 (mesures immédiatement applicables, pendant 6 mois) du même règlement pourraient en théorie fonder une autorisation de mise sur le marché en dépit du refus des États membres.
* 57 Articles 26 et 28 à 37 du traité sur le fonctionnement de l'Union européenne.
* 58 Article 54 du règlement (CE) n° 178/2002 du 28 janvier 2002, dit règlement « alimentation » : https://eur-lex.europa.eu/LexUriServ/LexUriServ.do ?uri=CONSLEG :2002R0178 :20 080 325 :FR :PDF
* 59 Les services de la Commission européenne indiquent « s'attendre à des demandes, potentiellement dès le deuxième trimestre de cette année ». Cependant, ils avaient déjà anticipé des demandes en 2022, ce qui n'a finalement pas eu lieu. La plupart des acteurs entendus par la mission s'accordent à dire que les entreprises ont eu tendance à se montrer optimistes dans leur communication, notamment pour faciliter les levées de fonds. Les entreprises elles-mêmes se montrent désormais plus prudentes, certaines se refusant à des pronostics.
* 60 Comme cela était du reste le cas en Europe avant l'épizootie d'encéphalopathie spongiforme bovine (ESB) ou « crise de la vache folle ».
* 61 https://www.usda.gov/media/press-releases/2019/03/07/usda-and-fda-announce-formal-agreement-regulate-cell-cultured-food
* 62 Le ministre avait également déclaré, lors des débats sur le futur article 254 de la loi Climat et résilience : « Que les choses soient claires : je m'oppose formellement à la consommation de viande cellulaire - cette viande de paillasse, de laboratoire », laissant même entendre que la France pourrait enfreindre volontairement le droit de l'Union européenne : « À l'heure actuelle, la Commission européenne ne l'autorise pas. Si elle venait un jour à le faire - mais la France marquerait son opposition -, quelle solution légistique pourrions-nous trouver ? Il faudrait que, sur la base d'autres considérants, la loi française émette une interdiction. »
* 63 Modifiant l'article L. 230-5 du code rural et de la pêche maritime.
* 64 https://www.assemblee-nationale.fr/dyn/15/comptes-rendus/csldcrre/l15csldcrre2021 040_compte-rendu
* 65 https://www.valeursactuelles.com/clubvaleurs/economie/entretien-marc-fesneau-retrouver-la-souverainete-agricole
* 66 https://www.bpifrance.fr/nos-appels-a-projets-concours/appel-a-projets-france-2030-premiere-usine
* 67 https://agenceurope.eu/fr/bulletin/article/13138/11
* 68 Avant, donc, la levée de fonds de Gourmey de 48 M€ en 2022.
* 69 Dont l'entreprise agroalimentaire Tnuva, qui co-dirige le consortium, mais aussi des entreprises de biotechnologies.
* 70 https://www.diplomatie.gouv.fr/fr/politique-etrangere-de-la-france/diplomatie-scientifique-et-universitaire/veille-scientifique-et-technologique/israel/article/subvention-de-plus-de-17-millions-d-euros-pour-le-consortium-israelien-de-la
* 71 https://www.greenqueen.com.hk/south-koreas-cultivated-meat-stakeholders-sign-mou/
* 72 https://cellularagriculture.tufts.edu/
* 73 https://www.whitehouse.gov/briefing-room/presidential-actions/2022/09/12/executive-order-on-advancing-biotechnology-and-biomanufacturing-innovation-for-a-sustainable-safe-and-secure-american-bioeconomy/
* 74 http://www.moa.gov.cn/govpublic/KJJYS/202 112/P020220106615 353 271 383.pdf