III. UN ENVIRONNEMENT RÉGLEMENTAIRE COMPLEXE ET CONTRAINT : DES FREINS À LEVER
Complexe, voire excessive ou même aberrante, contraignante, parfois inadaptée mais aussi, à de nombreux égards, nécessaire : de manière quasi-unanime, les personnes entendues par votre mission d'information ont relevé le poids de la réglementation entourant la commercialisation des plantes médicinales et des produits à base de plantes , qu'elle soit issue de normes françaises ou européennes.
Cette complexité révèle d'une certaine façon les mutations de l'herboristerie et de l'usage traditionnel des « simples » : la plante n'est plus abordée comme un tout, un élément à part entière, mais segmentée en divers statuts en fonction de ses usages, qui sont multiples (non seulement thérapeutique mais également alimentaire, aromatique ou encore cosmétique), et de ses différents degrés de transformation.
La réglementation actuelle est guidée par un objectif impérieux : protéger la sécurité des consommateurs et la santé publique .
Elle se heurte néanmoins à des limites aux effets parfois contreproductifs au regard de cette finalité essentielle, notamment pour apporter au consommateur une information complète sur le bon usage des plantes. Enfin, en dépit d'évolutions récentes, l'environnement juridique est ressenti, par plusieurs acteurs et pour différents aspects, comme un frein : un frein à l'innovation pour les industriels du secteur, mais aussi un frein au développement d'une activité de vente directe pour les petits producteurs ou de conseil en herboristerie « traditionnelle » en dehors du circuit pharmaceutique, alors même que la distribution des produits à base de plantes dépasse de plus en plus le seul cadre de l'officine.
A. UNE RÉGLEMENTATION STRICTE, COMPLEXE ET SEGMENTÉE, DESTINÉE À PROTÉGER LA SÉCURITÉ DES CONSOMMATEURS
1. Une même plante, différents statuts, des normes distinctes
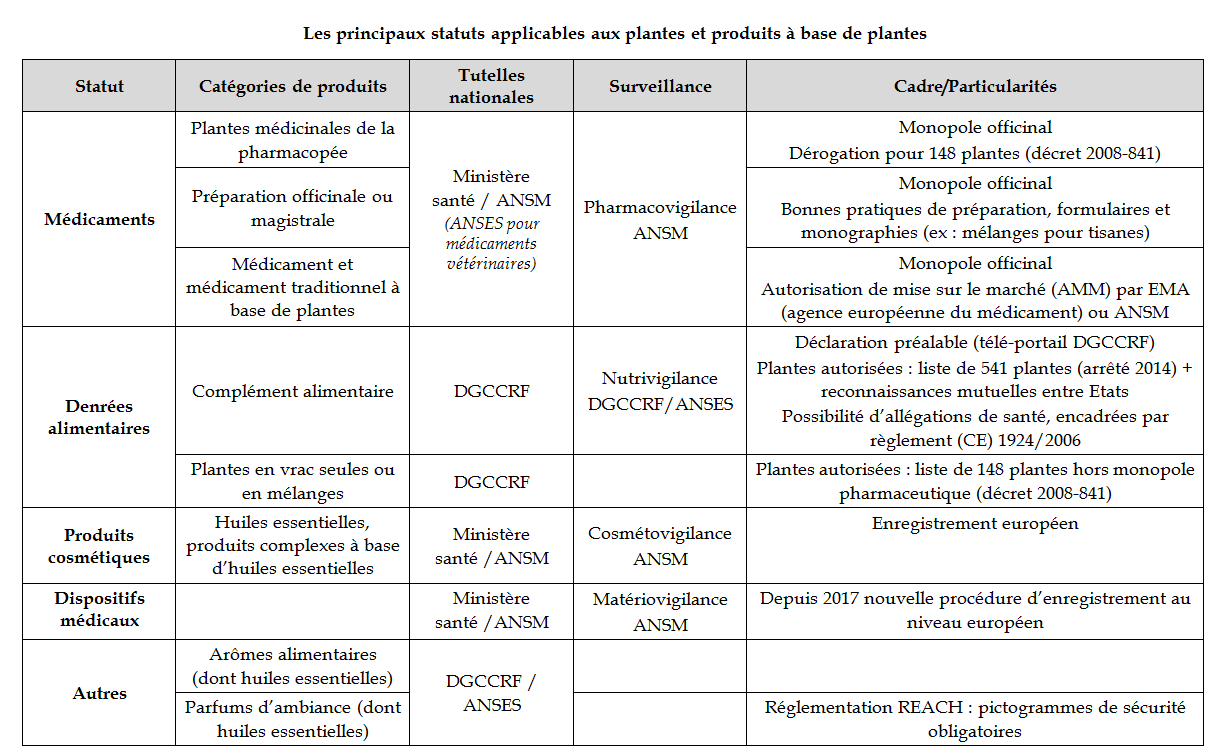
Du fait de leurs usages variés, les plantes peuvent appartenir à différentes catégories de produits, en fonction de leur destination. A chaque catégorie correspondent des statuts divers - principalement ceux de médicament, de denrée alimentaire ou de produit cosmétique - et des normes distinctes, qui relèvent de différentes autorités de contrôle et de systèmes de vigilance stricts mais eux-mêmes distincts.
Comme l'ont souligné les représentants de la DGCCRF, « la réglementation européenne a défini des cadres réglementaires spécifiques par catégorie de produit et a interdit quasiment toute forme de superposition. »
Cette diversité de statuts, qui sont ainsi exclusifs l'un de l'autre, forme un paysage éminemment complexe voire confus . Les grandes lignes en sont résumées dans le tableau de synthèse ci-après.
a) Le statut de médicament : la plante, un médicament presque comme les autres
• Le code de la santé publique donne une définition large du médicament, entendu comme « toute substance ou composition présentée comme possédant des propriétés curatives ou préventives à l'égard des maladies humaines ou animales, ainsi que toute substance ou composition pouvant être utilisée chez l'homme ou chez l'animal (...) en vue d'établir un diagnostic médical ou de restaurer, corriger ou modifier leurs fonctions physiologiques en exerçant une action pharmacologique, immunologique ou métabolique. » 60 ( * )
La catégorie spécifique des médicaments à base de plantes 61 ( * ) recouvre plusieurs formes retracées dans l'encadré ci-après : des médicaments stricto sensu (spécialités pharmaceutiques), des préparations pharmaceutiques (magistrale ou officinale) ou des drogues végétales.
Le médicament fait l'objet de procédures strictes d'autorisation et de contrôle. Depuis 2004 62 ( * ) , une procédure simplifiée d'autorisation de mise sur le marché (AMM) concerne les médicaments traditionnels à base de plantes . Celle-ci demeure toutefois peu utilisée : d'après les données transmises par l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), sept demandes ont été déposées sur la période 2016-2018.
Pour les laboratoires, la procédure demeure en effet encore lourde , soumise à des délais d'examen qui peuvent s'avérer dissuasifs. Certains ont souligné les limites de l'harmonisation européenne, les exigences requises par l'ANSM pouvant s'avérer plus contraignantes que celles requises par les agences sanitaires dans d'autres pays.
|
Les différentes catégories de médicaments à base de plantes • Les spécialités pharmaceutiques Une spécialité pharmaceutique est un médicament préparé à l'avance, présenté sous un conditionnement particulier et caractérisé par une dénomination spéciale. Il existe, pour les spécialités pharmaceutiques à base de plantes, trois procédures d'accès au marché : - demande d'autorisation de mise sur le marché (AMM) sur la base d'un dossier complet : la sécurité et l'efficacité du médicament sont démontrées sur la base d'essais non cliniques et cliniques comme pour tout autre médicament ; - demande d'autorisation de mise sur le marché sur la base de l'usage médical bien établi : le demandeur démontre, par référence à une documentation bibliographique appropriée, que la ou les substances actives présentent une efficacité reconnue (sur la base de l'usage, démontré depuis au moins 10 ans en France ou dans l'Union européenne) ainsi qu'un niveau acceptable de sécurité ; - demande d'enregistrement des médicaments traditionnels à base de plantes : la procédure d'autorisation est simplifiée ; l'ANSM délivre un enregistrement, sur la base non pas d'essais cliniques mais d'éléments bibliographiques et de rapports d'experts établissant que le médicament a fait l'objet d'un usage médical depuis au moins 30 ans au moment de la demande , dont au moins 15 ans dans l'Union européenne ou l'Espace économique européen, une étude bibliographique des données de sécurité accompagnée d'un rapport d'expert, et le cas échéant les données nécessaires à l'évaluation de la sécurité du médicament. Dans ce dernier cas, l'efficacité est considérée comme plausible sur la base de la longue utilisation et de l'expérience. La sécurité est documentée sur la base d'un rapport d'expert et de données de sécurité. Le cas échéant des essais supplémentaires peuvent être demandés. • Les préparations magistrales et officinales Ces préparations, qui ont le statut de médicament, sont réalisées et délivrées sous la responsabilité d'un pharmacien dans le respect des bonnes pratiques de préparation. - Une préparation magistrale est préparée par le pharmacien (en pharmacie d'officine ou hospitalière) sur prescription médicale et destinée à un patient déterminé en l'absence de spécialité pharmaceutique adaptée ou disponible. - Une préparation officinale est un médicament inscrit à la pharmacopée ou au formulaire national, préparé en pharmacie d'officine et destiné à être dispensé directement aux patients de cette pharmacie. Les mélanges pour tisanes s'inscrivent dans ce cadre : ils peuvent être réalisés par les pharmaciens d'officine selon les conditions décrites dans une monographie du formulaire national. • Les drogues végétales Il s'agit des plantes médicinales, en vrac, ou encore des huiles essentielles, pour un emploi à visée thérapeutique. |
• Le contrôle de la conformité des produits (contaminations microbiennes ou recherche d'alcaloïdes pyrrolizidiniques, falsifications, conformité des étiquetages ...) relève de l'ANSM, qui peut prendre des mesures de police sanitaire (retrait de produits ou de lots).
• La surveillance relève du dispositif de pharmacovigilance qui impose le signalement par les professionnels de santé ou les laboratoires de tout effet indésirable suspecté d'être dû à un médicament ; les patients peuvent également procéder à une telle déclaration.
b) Le statut de denrée alimentaire : l'essor des compléments alimentaires
• Un autre statut possible pour les plantes ou produits à base de plantes est celui de denrée alimentaire.
Sont compétents, au niveau national, la direction générale de la concurrence, de la consommation et de la répression des fraudes (DGCCRF) et l'Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail (ANSES).
C'est par exemple le cas des plantes en vrac ou en mélange (boissons, tisanes) : 148 plantes médicinales de la pharmacopée ont été sorties du monopole pharmaceutique 63 ( * ) en raison de leur usage alimentaire ou condimentaire et peuvent ainsi être vendues avec le statut alimentaire.
• Les compléments alimentaires à base de plantes relèvent de cette catégorie.
Le concept est relativement récent. Comme l'a relevé la présidente du Synadiet, le syndicat national des compléments alimentaires, le marché est apparu en France à la fin des années 1980, en concernant d'abord les vitamines et minéraux, puis s'est élargi aux plantes à la fin des années 1990, ce secteur connaissant une forte croissance.
Le décret n° 2006-3524 du 20 mars 2006, qui a transposé la directive 2002/46/CE du Parlement européen, en donne la définition suivante : il s'agit des « denrées alimentaires dont le but est de compléter le régime alimentaire normal et qui constituent une source concentrée de nutriments ou d'autres substances ayant un effet nutritionnel ou physiologique seuls ou combinés, commercialisés sous forme de doses » (à savoir les gélules, pastilles, comprimés, sachets de poudre, ampoules, flacons munis d'un compte-gouttes ou toute autre forme de préparation destinée à être prise en unités mesurées de faible quantité).
Comme l'ont souligné plusieurs intervenants, la frontière avec le médicament est parfois ténue : elle repose sur la distinction entre un effet physiologique (à savoir maintenir l'état d'équilibre naturel de l'organisme), faisant l'objet d'une « allégation de santé » (telles que « améliore le transit », « contribue à renforcer les défenses naturelles de l'organisme », « contribue à améliorer la densité osseuse », etc.) et un effet pharmacologique (qui consiste quant à lui à rétablir cet équilibre en corrigeant un état pathologique), assorti d'une « allégation ou indication thérapeutique ». La communication sur les caractéristiques nutritionnelles des aliments et leurs bénéfices pour la santé s'inscrit dans un cadre réglementaire très strict défini au niveau européen 64 ( * ) : en entend ainsi par « allégation de santé », « toute allégation qui affirme, suggère ou implique l'existence d'une relation entre, d'une part, une catégorie de denrées alimentaires, une denrée alimentaire ou l'un de ses composants et, d'autre part, la santé ». Comme l'a résumé la présidente du Synadiet, les compléments alimentaires « s'adressent aux personnes en bonne santé, pour leur apporter un confort de vie » .
Quoique présentant un cadre réglementaire bien plus souple que celui du médicament, ce qui confère à ce statut une certaine attractivité pour les industriels, leur mise sur le marché relève d'une procédure strictement encadrée afin de garantir la sécurité des consommateurs :
- en amont, les produits doivent faire l'objet d'une déclaration , au moyen d'une téléprocédure dédiée, auprès de la DGCCRF qui assure un contrôle de conformité ; près de 13 000 déclarations ont été enregistrées en 2017, en croissance de 5,8 % par rapport à l'année précédente ;
- en aval, ils font l'objet d'une surveillance dans le cadre du dispositif de nutrivigilance suivi par l'ANSES, permettant de faire remonter les effets secondaires recensés par les professionnels de santé, les patients ou les laboratoires. La DGCCRF contrôle par ailleurs la présentation et la composition des produits, leur sécurité en matière d'hygiène et la conformité des allégations santé (environ 3 500 actions de contrôle par an, avec un taux de non-conformité sur les allégations de 20 à 30 %, principalement sur internet).
c) Le statut de produit cosmétique et les autres catégories
• Les produits cosmétiques 65 ( * ) sont régis au niveau européen par le règlement n° 1223/2009 CE qui encadre leurs modalités de mise sur le marché. Celle-ci se fait sous la responsabilité du fabricant , sans autorisation préalable, sous réserve de ne pas nuire à la santé humaine dans les conditions normales ou raisonnablement prévisibles d'emploi, en faisant mention de leur composition pour l'information des consommateurs.
Les opérateurs sont tenus de constituer un dossier comprenant une évaluation de la sécurité pour la santé humaine du produit fini, mis à la disposition des autorités compétentes à savoir l'ANSM et la DGCCRF qui assurent la surveillance des produits dans le cadre du système de cosmétovigilance et peuvent prendre des mesures de police sanitaire.
• D'autres statuts peuvent s'appliquer selon la catégorie de produit : celui propre au dispositif médical , qui sont des produits de santé, ou encore ceux propres aux substances chimiques (produits en vaporisation par exemple). S'applique, dans ce dernier cas, le règlement REACH 66 ( * ) entré en vigueur en 2007 en vue d'une meilleure connaissance des effets des substances chimiques utilisées dans l'industrie européenne sur la santé humaine et sur l'environnement.
2. Le monopole pharmaceutique : une finalité sanitaire, une réalité disputée
a) Un objectif essentiel : protéger la santé publique
• Le monopole des pharmaciens sur la vente et la dispensation au public des médicaments est inscrit à l'article L. 4211-1 du code de la santé publique.
Ce monopole s'applique à l'ensemble des médicaments à base de plantes. Il s'étend, « sous réserve de dérogations fixées par décret » , à la vente des 546 plantes médicinales inscrites à la pharmacopée , dont la liste se décline en deux parties :
- la liste A ( 416 plantes , dites drogues végétales) comprend des plantes utilisées traditionnellement, quoique certaines peuvent être toxiques comme l'a relevé Pierre Champy, professeur de pharmacognosie ; 148 d'entre elles 67 ( * ) , présentant des usages alimentaire ou condimentaire, peuvent être vendues en dehors du circuit officinal, sous le statut de denrée alimentaire, sans revendication possible, toutefois, d'une indication thérapeutique ;
- la liste B ( 130 plantes ) comprend des plantes qui peuvent être utilisées traditionnellement en thérapeutique mais dont les effets indésirables potentiels sont supérieurs au bénéfice thérapeutique attendu, par exemple en raison de leur toxicité. Ces plantes ne peuvent être vendues en l'état, y compris par des pharmaciens.
• Le monopole pharmaceutique concerne par ailleurs la vente d' huiles essentielles présentant une certaine dangerosité, dont la liste est fixée par décret : elles sont actuellement au nombre de quinze 68 ( * ) , parmi lesquelles on compte les huiles essentielles de grande et petite absinthe, de cèdre feuille, d'hysope ou encore de sauge officinale.
• Comme l'a rappelé Pierre Champy, professeur de pharmacognosie, ce monopole pharmaceutique répond à une finalité sanitaire , et non à une logique économique.
D'une part, le circuit pharmaceutique permet de garantir, par l'application des contrôles stricts sur l'ensemble de la chaîne (approvisionnement, préparation, délivrance), un haut niveau de traçabilité et de sécurité des produits , en particulier pour prévenir les falsifications, contrefaçons et risques de contamination.
D'autre part, il permet d'encadrer la dispensation au public des médicaments par des professionnels disposant d'un haut niveau de formation médicale, dont le maillage sur l'ensemble du territoire assure par ailleurs une équité d'accès. Ce cadre, parfois remis en question, permet de prévenir le risque d'une banalisation du médicament .
Enfin, il vise à protéger les plus vulnérables contre des risques de dérive thérapeutique ou de charlatanisme , consistant à parer certains produits ou des plantes parfois interdites à la vente en dehors des pharmacies, toxiques ou dangereuses, de vertus « miracles » non confirmées par la littérature scientifique, censés guérir le cancer, le VIH ou encore la sclérose en plaques.
L'ordre des pharmaciens a indiqué avoir déjà engagé des actions en justice, pouvant conduire jusqu'à des peines d'emprisonnement 69 ( * ) . Ces cas demeurent fort heureusement rares.
b) Ce qui est naturel n'est pas sans danger
• De nombreux intervenants ont souligné que les plantes médicinales n'échappaient pas à la nécessaire vigilance sanitaire : alors que l'on peut avoir tendance à associer le produit naturel à un produit sain, sans danger, il faut rappeler que les premiers poisons sont dans la nature ; cependant, comme l'ajoute le père de la toxicologie au XVI è siècle, Paracelse, « c'est la dose qui fait le poison » .
Des professionnels de santé ont mis en avant, en particulier, des risques de iatrogénie , c'est-à-dire d' interaction entre plantes et médicaments . Certains sont bien connus : c'est le cas du millepertuis, plante indiquée comme antidépresseur léger, qui peut bloquer l'action d'autres traitements, dont celui de la pilule contraceptive 70 ( * ) ; des plantes ultramarines d'usage traditionnel ont en outre des propriétés abortives.
D'autres sont plus complexes et parfois moins bien identifiés en raison de la technicité croissante des médicaments : les représentants des ordres des médecins et des pharmaciens, comme le docteur Laurent Chevallier, ont relevé des interactions entre phytothérapie et certaines chimiothérapies , alors même que de nombreux patients atteints de cancer ont recours aux plantes - parfois sans le dire à leur médecin - pour aider à supporter les effets secondaires de leurs traitements.
Enfin, du fait de leur concentration, les huiles essentielles peuvent présenter des risques plus importants, certaines - relevant en l'occurrence du monopole pharmaceutique - ayant des propriétés neurotoxique (thuya, sauge officinale), phototoxique (rue) ou irritante (sabine, moutarde). L'essor de leur consommation s'est accompagné d'une augmentation des remontées aux centres antipoison : celui des Hauts de France a recensé 141 cas en 2017 contre 18 en 2000, principalement le fait d'exposition accidentelle pédiatrique 71 ( * ) . D'après les données communiquées par l'ANSES, on note 19 000 cas d'exposition à des huiles essentielles rapportés au réseau des centres antipoison entre le 1 er janvier 2012 et le 31 juillet 2017, dont environ 6 000 cas symptomatiques ; leur nombre a quasiment doublé entre 2012 et 2017.
Il faut noter qu'aucun intervenant n'a suggéré de revenir sur le monopole pharmaceutique qui s'applique à quinze huiles essentielles présentant des risques élevés de toxicité.
• Si l'usage des plantes médicinales n'est pas anodin, sa « dangerosité » mérite, pour votre rapporteur, d'être précisée et nuancée .
D'après les indications qui lui ont été transmises, les plantes seraient à l'origine de l'ordre de 5 % des signalements aux centres antipoison , en raison de l'ingestion de plantes toxiques du monopole comme l'aconit, l'if, la belladone ou la datura ou de confusion de plantes. Cela n'est pas nul mais les place toutefois loin derrière les signalements dus aux médicaments ou encore aux produits ménagers.
Le président du groupe Arkopharma a ainsi relevé que « les signalements pour les médicaments de phytothérapie sont dans 98 % des cas non graves et s'élèvent à deux cas par million d'unités vendues, à comparer aux 27 signalements par million d'unités vendues des autres médicaments » .
Laurence Fenouillet-Mulon, toxicologue, a souligné par ailleurs que les risques d'interaction médicamenteuse ne sont pas le seul fait des plantes : des aliments peuvent aussi être en cause ; par exemple, le jus de pamplemousse ralentit la métabolisation de nombreux médicaments.
• Pour votre rapporteur, ces différents constats ne sauraient conduire à rejeter a priori l'usage de telle ou telle plante, ce qu'aucune personne entendue par votre mission n'a d'ailleurs préconisé.
Cela plaide en revanche pour approfondir la recherche sur les interactions, positives comme négatives , entre allopathie et phytothérapie , ainsi que sur les conditions d'emploi des plantes et leurs éventuelles contre-indications. Ces constats mettent également en évidence le besoin d'encadrer l'usage des plantes par un conseil avisé et une information complète afin de garantir la sécurité des consommateurs.
c) Un réseau de distribution des produits à base de plantes qui dépasse toutefois le seul cadre de l'officine
En dépit d'un cadre juridique strict, les plantes disposent, dans les faits, d'un réseau de distribution large et qui tend à s'élargir.
Les conditions de commercialisation des produits à base de plantes sont, selon les statuts, à géométrie variable : peuvent être vendus hors des officines 148 plantes sèches de la pharmacopée, l'ensemble des huiles essentielles (sauf quinze d'entre elles), mais également les compléments alimentaires (y compris quand ils comprennent des plantes qui ressortent du monopole pharmaceutique, hors celles de la liste B de la pharmacopée 72 ( * ) ) et les produits cosmétiques à base de plantes.
Les consommateurs peuvent donc se procurer ces produits en dehors des pharmacies ou parapharmacies qui restent toutefois en tête sur le marché de la phytothérapie (74 % des parts de marché d'après les données d'Arkopharma), devant les grandes et moyennes surfaces (8,6 %), Internet (5,8 %) et les magasins diététiques (4,3 %).
Toutefois, les situations sont variables selon les types de produits.
S'agissant des compléments alimentaires , les pharmacies demeurent le premier réseau de distribution (51 %, et 57 % en y ajoutant les parapharmacies) ; la vente à distance ou vente directe représente 17 % des ventes, devant les circuits spécialisés comme les magasins bio et diététiques (15 %) et les grandes et moyennes surfaces (11 %).
D'après des données communiquées par FranceAgriMer, la commercialisation des plantes pour infusions se situe très majoritairement dans les grandes et moyennes surfaces (3 378 tonnes en 2014, contre 117 en pharmacies et parapharmacies).
En outre, seules 10 % environ des huiles essentielles sont vendues en pharmacie 73 ( * ) , les magasins de produits biologiques en étant le premier distributeur (57 % de parts de marché), devant Internet.
• Les boutiques de produits biologiques et diététiques se positionnent comme des acteurs importants sur ce marché avec une attention portée aux circuits courts. Le président du réseau Biocoop, auditionné par votre rapporteur, a indiqué que les produits à base de plantes (plantes aromatiques, huiles essentielles, infusions, plantes séchées...) représentaient 10 millions d'euros de chiffre d'affaires, en croissance de plus de 5 %.
• Nombre d'intervenants ont souligné l'importance croissante d'Internet et des ventes en ligne , qui peuvent être le fait de pharmacies (dans le cadre de la même réglementation que celle qui s'applique à la vente en officine), d'herboristes, de producteurs en vente directe ou de coopératives mais aussi d'autres acteurs moins clairement identifiables.
L'attention de votre mission d'information a été attirée sur la qualité et la conformité des produits qui y circulent : pour la DGCCRF, qui en assure le contrôle s'agissant des compléments alimentaires, le taux de non-conformité des allégations santé serait de 80 % sur internet, « le principal point d'alerte » concernant des produits importés, souvent falsifiés, présentés comme des « produits miracles, avec des allégations farfelues » . La difficulté de ce contrôle tient à la volatilité d'opérateurs souvent installés dans des pays tiers, non européens 74 ( * ) .
Internet est également le lieu d'une information omniprésente sur les plantes, leurs usages et leurs vertus réelles ou supposées, accessible à tous mais non contrôlée et non canalisée . Il est ainsi difficile pour le consommateur de s'y retrouver et de distinguer les acteurs sérieux de tous les autres.
* 60 Article L. 5111-1 du code de la santé publique (reprenant la définition donnée par la directive 2001/83/CE du Parlement européen et du Conseil du 6 novembre 2001 instituant un code communautaire relatif aux médicaments à usage humain).
* 61 L'article L. 5121-1, 16° du code de la santé publique définit un médicament à base de plantes comme « tout médicament dont les substances actives sont exclusivement une ou plusieurs substances végétales ou préparations à base de plantes ou une association de plusieurs substances végétales ou préparations à base de plantes ».
* 62 Directive 2004/24/CE du 31 mars 2004.
* 63 Décret n° 2008-841 du 22 août 2008 (cf. ci-après).
* 64 Règlement (CE) 1924/2006 (cf. ci-après).
* 65 L'article L. 5131-1 du code de la santé publique en donne la définition suivante : « On entend par produit cosmétique toute substance ou mélange destiné à être mis en contact avec les parties superficielles du corps humain (l'épiderme, les systèmes pileux et capillaire, les ongles, les lèvres et les organes génitaux externes) ou avec les dents et les muqueuses buccales, en vue, exclusivement ou principalement, de les nettoyer, de les parfumer, d'en modifier l'aspect, de les protéger, de les maintenir en bon état ou de corriger les odeurs corporelles. »
* 66 Règlement n° 1907/2006 concernant l'enregistrement, l'évaluation et l'autorisation des substances chimiques (Registration, Evaluation and Autorisation of CHemicals, REACh).
* 67 Cf. B ci-après.
* 68 Décret n° 2007-1198 du 3 août 2007.
* 69 Cela a été par exemple le cas dans une affaire jugée en 2014 par le tribunal de Bobigny, qui a conduit à la condamnation d'un établissement délivrant un produit amaigrissant composé de plantes chinoises mais qui étaient en fait des plantes toxiques.
* 70 L'ordre des pharmaciens a précisé que 65 interactions médicamenteuses étaient référencées pour cette plante dans le thesaurus 2018 de l'ANSM et 100 dans la base Hedrine (herbal drug interaction database) développée par l'Université de Grenoble.
* 71 D'après des données communiquées par Laurence Fenouillet-Mulon, toxicologue.
* 72 Le décret n° 2008-839 du 22 août 2008 a autorisé la vente des compléments alimentaires par des personnes autres que des pharmaciens lorsque l'emploi de plantes médicinales inscrites à la pharmacopée a été autorisé, dans les conditions prévues par le décret n° 2006-352 du 20 mars 2006 relatif aux compléments alimentaires. Cela ne s'applique pas à ceux contenant des plantes figurant à la liste B de la pharmacopée française.
* 73 Ces données sont issues d'une enquête réalisée pour Biolinéeaires.
* 74 Dans le cadre de l'Union européenne, il existe un protocole d'échanges et de signalement rapide des infractions (réseau « foodfraud »).