II. QUEL PÉRIMÈTRE DE PRISE EN CHARGE POUR QUEL USAGE ?
Environ 2 800 substances actives différentes, correspondant à plus de 11 000 spécialités, sont disponibles sur le marché français . Du point de vue de leur financement, elles se répartissent entre médicaments pris en charge et non pris en charge par l'assurance maladie.
En 2013, 85 % des médicaments vendus en France étaient remboursables . Cette proportion s'élevait à 97 % s'agissant des spécialités soumises à prescription médicale obligatoire (que l'on raisonne en valeur ou en volume). D'après l'ANSM, cette situation « résulte de ce que les pathologies graves, et prises en charge par les régimes d'assurance maladie, sont traitées par des médicaments qui impliquent obligatoirement une prescription médicale » 23 ( * ) .
Un médicament peut faire l'objet d'une prise en charge intégrale par la sécurité sociale soit en raison de l'intérêt qu'il présente 24 ( * ) , soit parce qu'il est prescrit à une personne pour traiter une pathologie correspondant aux critères de l'affection de longue durée (ALD) dite « exonérante » c'est-à-dire d'une affection « dont la gravité et/ou le caractère chronique nécessitent un traitement prolongé et une thérapeutique particulièrement coûteuse, et pour lesquelles le ticket modérateur est supprimé » 25 ( * ) .
Mais certains ne sont remboursés que partiellement, soit en taux, soit seulement pour certaines populations ou pour certaines indications.
La différenciation des taux de remboursement tient au service médical rendu par le médicament tel qu'il est évalué par la commission de la transparence de la Haute Autorité de santé (HAS) . Cette commission, qui existe depuis 1967, est chargée par le code de la sécurité sociale de rendre un avis sur :
- les demandes d'inscription et de renouvellement de l'inscription des médicaments sur la liste des médicaments remboursables ;
- la modification des conditions d'inscription d'un médicament.
La commission doit également réévaluer le service médical rendu des médicaments inscrits sur cette liste. La réévaluation a lieu par classe pharmaco-thérapeutique ou pour tous les médicaments à même visée thérapeutique.
Cette réévaluation a lieu notamment lorsque la commission propose l'inscription sur ces listes ou l'une de ces listes d'un médicament apportant une amélioration du service médical rendu (ASMR) majeure, susceptible de modifier substantiellement les stratégies thérapeutiques antérieures ou lorsque le contexte scientifique qui a fondé l'avis rendu précédemment a évolué de façon significative ou notoire.
Nombre d'avis rendus par la Commission de la transparence
|
Nombre d'avis rendus par type de demande |
2010 |
2011 |
2012 |
2013 |
2014 |
|
Primo-inscriptions |
296 |
219 |
216 |
169 |
190 |
|
Extensions d'indications |
29 |
22 |
32 |
31 |
45 |
|
Renouvellements et réévaluation
|
269 |
557 |
459 |
276 |
269 |
|
Autres avis rendus (radiations, modifications des conditions d'inscriptions...) |
201 |
194 |
163 |
144 |
126 |
|
Total des avis rendus |
795 |
992 |
870 |
620 |
630 |
Source : Rapport d'activité HAS
En 2011, d'après le syndicat des entreprises du médicament (Leem), les médicaments pris en charge à 100 % par l'assurance maladie représentent environ deux tiers des dépenses de remboursement par l'assurance maladie, le tiers restant se répartissant entre les médicaments remboursés aux autres taux 26 ( * ) .
Par ailleurs, les médicaments en libre accès, médicaments dits d'automédication, ne sont pas remboursés par la sécurité sociale 27 ( * ) .
Dans un contexte qui impose la meilleure allocation des financements sociaux aux traitements les plus efficaces, il convient de s'interroger sur la pertinence du périmètre actuel de prise en charge des médicaments. Ceci suppose d'étudier les raisons pour lesquelles certains médicaments ne sont pas remboursés, et de déterminer si les mécanismes d'ajustement du coût des médicaments remboursés garantissent la pérennité du système de prise en charge.
A. LE MÉDICAMENT NON PRIS EN CHARGE
Trois types de médicaments ne font pas l'objet d'une prise en charge par la sécurité sociale : les médicaments d'automédication, les médicaments prescrits en dehors de leur autorisation de mise sur le marché ou d'une indication spécifique, enfin les médicaments déremboursés.
1. L'automédication : liberté des prix et choix du patient
Le choix de faire figurer un médicament sur la liste des spécialités en automédication relève du titulaire de l'autorisation de mise sur le marché . L'ANSM contrôle cependant que le médicament ne relève pas du champ de la prescription médicale obligatoire et que le conseil pharmaceutique peut suffire au bon usage 28 ( * ) . Si les médicaments en automédication n'ont pas vocation à apporter des réponses thérapeutiques aux pathologies les plus graves, il n'y a pas de lien juridique entre leur service médical rendu et le fait qu'ils soient en accès libre.
Les industriels tendent le plus généralement à demander à ce qu'un de leur produit fasse l'objet d'un remboursement en raison de l'impact de la prise en charge sociale sur le chiffre d'affaires. Mais une autre stratégie industrielle peut consister à privilégier la liberté de fixation du prix, qui est le corollaire de l'accès direct, indépendamment du service médical rendu . Ainsi un laboratoire commercialisant un médicament dont la notoriété est établie peut faire le choix d'en assurer la vente en automédication, surtout si l'effet « marque » se trouve limité, en cas de remboursement, par la substitution au profit d'un générique, ou au moins le risque d'une telle substitution. Les débats récents autour du remboursement du Doliprane sont un exemple de l'évolution des stratégies industrielles par rapport au remboursement d'une spécialité, sans que le choix du laboratoire soit lié à l'efficacité du médicament.
L'automédication renvoie à plusieurs concepts dont les définitions reflètent les différences de point de vue des acteurs : producteurs, autorité sanitaire ou acteurs de santé. L'essentiel est cependant de déterminer la motivation des patients qui recourent à l'automédication et son impact en matière de santé publique.
L'association française de l'industrie pharmaceutique pour une automédication responsable (Afipa), qui représente 38 laboratoires et 80 % du marché de l'automédication, s'appuie sur une définition attribuée à l'OMS en 2000 pour caractériser l'automédication responsable : « L'automédication responsable consiste, pour les individus, à soigner leurs maladies grâce à des médicaments autorisés, accessibles sans ordonnance, sûrs et efficaces dans les conditions d'utilisation indiquées ». La notion de responsabilité est essentielle car l'OMS souligne également que « l'automédication qui peut aussi avoir des aspects positifs est inévitablement associée (...) à l'usage rationnel des médicaments ; ce dernier est mis en danger, dans le secteur public comme dans le secteur privé, par les ordonnances surchargées (parfois de cinq à six médicaments), l'abus des antibiotiques, des injections, les «conseils» donnés par les vendeurs à la sauvette, les médicaments périmés, etc., mais aussi par le manque de médicaments ou de personnel qualifié. Il existe également d'autres causes comme celles de la non-conformité au traitement qui relève non seulement de l'ignorance mais aussi du souhait de contrôler sa propre vie en refusant certains effets des médicaments ou en supprimant la prise lors de la disparition des symptômes. »
Les autorités sanitaires utilisent pour leur part le terme de médication officinale afin de marquer que les médicaments acquis sans ordonnance peuvent, voire doivent, faire l'objet d'un conseil par le pharmacien 29 ( * ) .
Les médicaments en accès direct constituent une partie des médicaments disponibles sans ordonnance en pharmacie. Ils sont disponibles directement, sans donc qu'il soit besoin d'en faire la demande, « s'ils répondent à certains critères (indication, dosage, notice, boîte spécialement étudiés) pour (...) permettre [à chacun] de les choisir et de les utiliser sans une prescription médicale » 30 ( * ) . D'autres médicaments situés derrière le comptoir ne sont accessibles que sur demande faite au pharmacien en raison de l'obligation que la vente soit accompagnée d'un conseil pharmaceutique.
L'attitude des pouvoirs publics face à l'automédication est ambivalente. La volonté d'assurer la plus grande sécurité du patient tend à ce que l'ANSM privilégie le niveau d'encadrement le plus élevé. L'automédication reste peu développée en France par rapport au reste de l'Europe et son chiffre d'affaires a même eu tendance à se contracter ces deux dernières années d'après les chiffres fournis à vos rapporteurs par l'Afipa.
L'économiste Claude Le Pen attribue cette situation au fait qu'il « existe une alliance anti-automédication en France ». « Cette alliance , affirme-t-il, rassemble les acteurs de santé qui craignent surtout de perdre des rentes de situation ». Pour autant les raisons que présente l'économiste tiennent autant à la santé publique qu'au souci de maintenir des situations acquises : « Les médecins craignent une perte de patientèle, le mésusage des médicaments, le mélange de produits incompatibles, les pertes de chance en cas d'erreur d'appréciation d'une pathologie existante. L'Etat se méfie des patients rendus plus autonomes avec les risques que cela peut générer (...) Les patients eux-mêmes sont parfois réticents car le remboursement des soins n'est plus au rendez-vous . » 31 ( * )
Pour autant, l'automédication est une part intégrante des modes d'accès au médicament. L'anthropologue Sylvie Fainzang, auteure de L'automédication ou les mirages de l'autonomie 32 ( * ) , considère que les pouvoirs publics et l'industrie promeuvent une autonomie limitée du patient au travers de l'automédication. Après avoir étudié les motivations des comportements d'automédication, elle a résumé pour la revue de l'Ordre des médecins l'un de ses principaux constats : « L'automédication et la volonté d'autonomie qui va avec peuvent résulter soit de la confiance, soit de la méfiance envers le médecin. Dans le premier cas, le patient considère son médecin comme compétent et cherche à reproduire les prescriptions médicales (ou croit reproduire les prescriptions médicales) antérieures. Dans le deuxième cas, le médecin est jugé incompétent pour résoudre un problème donné et le patient décide de gérer lui-même son mal en faisant ses propres choix, en fixant ses posologies, en développant ses stratégies de réduction des risques médicamenteux... Dans tous les cas, l'automédication traduit la mise en acte d'une autonomie avec parfois la volonté de s'affranchir de l'autorité médicale. »
En outre, « la pratique de l'automédication repose sur une évaluation des médicaments, faite tout à la fois de la connaissance [que les patients] ont acquise auprès des professionnels de santé, de celle qu'ils ont retirée de leur propre expérience, et de représentations des médicaments dont la logique symbolique court-circuite parfois les logiques pharmacologiques ». Ainsi le rapport à l'automédication apparaît complexe. En outre ses représentations varient selon l'origine culturelle et religieuse des personnes.
L'anthropologue Daniela Cerqui, interrogée par la revue de l'ordre des médecins, rappelle pour sa part que « l'accès à l'information n'est pas synonyme d'accès au savoir », ce qui renforce la nécessité d'un accompagnement par le conseil des professionnels et par les campagnes d'information publiques.
Il paraît donc nécessaire à vos rapporteurs de traiter la question de l'automédication non comme une source d'économie potentielle, mais d'abord comme un enjeu de santé publique . Il paraît dès lors souhaitable que le Gouvernement définisse des orientations claires relativement au développement de l'automédication.
2. L'usage hors AMM, un mal nécessaire ?
Un médicament déjà sur le marché, mais prescrit hors du champ de son autorisation de mise sur le marché, ne doit pas être pris en charge par la sécurité sociale sauf, après avis de la HAS, s'il fait l'objet d'une recommandation temporaire d'utilisation (RTU) par l'ANSM . Cette exception est fondée sur la nécessité de permettre l'usage de traitements dont l'efficacité n'avait pas été établie au moment de la demande d'AMM 33 ( * ) .
Le mécanisme de RTU a également été récemment utilisé pour réduire les coûts liés à un traitement sans préjudice pour le patient 34 ( * ) en permettant l'utilisation de l'Avastin dans le traitement de la dégénérescence maculaire néovasculaire liée à l'âge (DMLA).
La prescription hors AMM d'un médicament relève de la responsabilité du praticien et a été décrite comme nécessaire pour la prise en charge de certaines pathologies à la mission d'information sénatoriale sur le Mediator. Néanmoins, si, comme l'impose l'article 8 du code de déontologie médicale, la prescription hors AMM s'appuie sur l'état de la science, elle devrait aboutir à l'élaboration d'une RTU. De fait lorsqu'un produit est autorisé dans une indication hors AMM par les autorités sanitaires de plusieurs pays européens il devrait faire l'objet d'une RTU en France. Or le cas du Mediator montre que parfois le hors AMM peut relever du mésusage du médicament et que certains praticiens prescrivent comme remboursables des médicaments dont ils savent qu'ils les prescrivent hors AMM. En conséquence, la loi du 29 décembre 2011 relative au renforcement de la sécurité sanitaire du médicament et des produits de santé a inscrit dans le code de la santé publique 35 ( * ) les conditions de la prescription hors AMM et l'obligation de porter sur l'ordonnance la mention « prescription hors autorisation de mise sur le marché ».
Cependant, le rapport sur la surveillance et la promotion du bon usage des médicaments remis en septembre 2013 à la ministre de la santé par Dominique Costagliola et Bernard Bégaud relève « la difficulté à identifier ce qui est réellement du hors-AMM ou du « hors-AMM justifié »» mais insiste sur le fait que l'absence de données précises ne doit « cependant pas occulter, comme cela est trop souvent fait, que la France est l'un des pays dans lequel les prescriptions et l'usage irrationnels sont les plus prévalents ». S'agissant du coût social du mésusage, le rapport fait l'estimation suivante : « on ne dispose pas non plus d'une estimation crédible sur le coût supporté chaque année par l'assurance maladie (toutes branches confondues) du fait des conséquences de la haute prévalence des prescriptions et des utilisations non conformes. Ce coût est considérable (probablement supérieur à dix milliards d'euros par an) car, comme mentionné ci-dessus, il inclut non seulement les remboursements non justifiés de médicaments et des consultations et actes biologiques que ces prescriptions induisent (le dosage du « cholestérol » pour les statines) mais surtout les coûts induits par les maladies mal ou non prises en charge ou non prévenues et par la iatrogénie évitable (conséquences immédiates, hospitalisations, séquelles, examens complémentaires, etc.) ».
Ainsi le hors AMM est justifié sur le plan médical, encadré sur le plan législatif, fait l'objet d'une procédure spécifique pouvant aboutir à sa prise en charge par la sécurité sociale, mais reste source de dérives coûteuses et dangereuses pour les patients .
Les recommandations de l'ANSM en matière de prescription n'ont qu'un effet limité sur la prescription hors AMM. Des mesures contraignantes peuvent néanmoins être mises en place dans le cadre des relations conventionnelles du comité économique des produits de santé (Ceps) avec l'industrie du médicament. Ce comité a en effet compétence pour déterminer les obligations liées à la visite médicale et signe avec les laboratoires des engagements sur le bon usage des médicaments. La lettre d'orientation adressée au président du Ceps par ses ministres de tutelle le 2 avril 2013 précise ainsi : « en cas d'usage constaté d'un produit en dehors des indications de son AMM et des recommandations des autorités sanitaires compétentes, ainsi que de non-respect des engagements conventionnels souscrits par l'industriel pour contribuer à son bon usage, vous prononcerez les sanctions financières prévues.
Lorsque le chiffre d'affaires d'un produit ou d'une famille de produits excède manifestement la population cible de son AMM et des recommandations des autorités sanitaires compétentes, ou lorsque le montant remboursé excède manifestement la population cible de ses indications remboursables, vous veillerez à ce que les industriels concernés contribuent activement à la restauration du bon usage de leur produit et vous engagerez des baisses de prix en cas de refus ou d'implication insuffisante de leur part .
Vous proposerez, chaque fois que nécessaire, aux autorités compétentes, la mise en place de dispositifs de sensibilisation des prescripteurs au bon usage, et vous y contribuerez par le biais du dispositif conventionnel, notamment dans les cas évoqués précédemment ».
La Cnam s'est également saisie de la question du bon usage depuis plusieurs années au travers du suivi des volumes de remboursements. Au travers de son Hackathon organisé entre décembre 2015 et mai 2016 sur le thème de l'usage du médicament, elle a également primé les applications tendant à permettre une meilleure observance et une comparaison des pratiques de prescription.
Il paraît utile à vos rapporteurs, pour favoriser le bon usage du médicament, de développer des partenariats entre le Ceps et la Cnam pour mieux suivre l'utilisation des médicaments et agir sur les comportements de promotion, de prescription et d'usage.
3. Le médicament non pris en charge, excepté dans des indications thérapeutiques spécifiques
A l'initiative du laboratoire et après examen par l'ANSM, un médicament est commercialisé dans le cadre d'une autorisation de mise sur le marché pour des indications thérapeutiques spécifiques.
Le remboursement du médicament ne porte pas nécessairement sur l'ensemble de ces indications thérapeutiques puisque l'article L. 162-17 du code de la sécurité sociale, relatif aux conditions de remboursement des médicaments dispose que : « La liste précise les seules indications thérapeutiques ouvrant droit à la prise en charge ou au remboursement des médicaments ».
Ainsi, les antiviraux à action directe (AAD), nouveaux traitements de l'hépatite C, qui entraînent une disparition du virus dans le sang des malades, font l'objet d'une prise en charge spécifique par la sécurité sociale.
En effet, l'arrêté du 18 novembre 2014 inscrivant le Sovaldi sur la liste des spécialités remboursables dispose, dans son article 2, que : « Compte tenu du caractère irremplaçable et particulièrement coûteux du médicament relevant du présent arrêté (...) la participation de l'assuré aux frais d'acquisition de ce médicament est supprimée ». Il est donc pris en charge intégralement par l'assurance maladie.
Néanmoins l'article 1 er renvoie à une annexe la détermination des « seules indications thérapeutiques ouvrant droit à la prise en charge ou au remboursement du médicament ». Cette annexe fixe cinq indications thérapeutiques, ainsi, « au vu des exigences de qualité et de sécurité des soins », qu'une condition « relative à l'organisation des soins ». En l'occurrence, « l'initiation du traitement est subordonnée à la tenue, dans les pôles de référence hépatites (devenus services experts de lutte contre les hépatites virales), d'une réunion de concertation pluridisciplinaire ». L'arrêté du 12 juin 2015 prévoit le même dispositif pour l'Harvoni, médicament ayant la même autorisation de mise sur le marché que le Sovaldi.
La limitation de la prise en charge à certaines indications thérapeutiques et la condition relative à l'organisation des soins ont fait l'objet de critiques sévères . Du côté des soignants, l'association française pour l'étude du foie (Afef) a, pour sa part, préconisé en février 2016 le traitement universel. Les « recommandations Afef sur la prise en charge des hépatites virales C » comportent le paragraphe suivant : « Un traitement antiviral doit être proposé à tous les patients qui ont une hépatite chronique C, naïfs ou en échec d'un précédent traitement, avec une maladie hépatique compensée ou décompensée, à l'exception de ceux qui ont une comorbidité limitant leur espérance de vie à court terme. L'hépatite chronique virale C n'est pas une maladie uniquement hépatique mais une maladie générale. Les critères d'indication de traitement uniquement liés à la sévérité de la fibrose hépatique sont obsolètes. L'accès à un traitement universel est un objectif à court terme dans le but d'une disparition de l'épidémie d'hépatite C avant 2025. Il n'y aucun argument médical pour refuser à un patient un traitement efficace et sans effet indésirable majeur. Ceci nécessite une ouverture des indications au traitement pour tous dès 2016 ». Quelques semaines auparavant, les organisateurs de la 9th Paris Hepatitis Conference, qui s'est tenue les 11 et 12 janvier 2016 « ont critiqué les restrictions de remboursements des nouvelles molécules, qui rendent l'accès au traitement problématique pour les patients aux stades F2 » 36 ( * ) .
Les associations ont également fait part de leur opposition à l'avis de la commission de la transparence de la HAS du 14 mai 2014 sur lequel se fonde l'arrêté du 18 novembre 2014 37 ( * ) . Dans son rapport de 2015 VIH/Hépatites, la face cachée des discriminations , l'association Aides critique le caractère restrictif des recommandations de la HAS, estimant qu'elles ne s'inscrivent pas « dans une perspective de ralentissement de l'épidémie ». Aides oppose les recommandations de la HAS à celles « issues d'un consensus d'experts » proposées en mai 2014 dans un rapport de recommandations sur la prise en charge des personnes infectées par les virus de l'hépatite B ou de l'hépatite C. Ce rapport a été commandé par la ministre de la santé en janvier 2013 à l'agence nationale de recherche sur le Sida et les hépatites (ANRS) et l'association française pour l'étude du foie (Afef), il a été élaboré sous la direction du Pr Daniel Dhumeaux.
Face à la perspective portée par le rapport dit « Dhumeaux » d'une éradication de l'hépatite C, les restrictions préconisées par la HAS n'ont été vues que comme une conséquence du coût élevé du traitement, malgré les baisses de prix et remises obtenues par la négociation avec le comité économique des produits de santé. L'acceptation du prix élevé d'un médicament a donc été condamnée comme entraînant un rationnement des soins. Le journal Le Parisien du 5 avril 2016 rapporte ainsi les propos de Yann Mazens, responsable de l'association SOS Hépatites : « La France compte 250 000 cas d'hépatite C, dont 140 000 ont un besoin pressant de traitement. Pour raisons financières, seuls 26 000 cas ont été traités à ce jour ».
Le Formindep a pour sa part critiqué les prises de positions de professionnels tendant à une prise en charge plus large au nom des conflits d'intérêts dont seraient entachées les positions des auteurs de ces recommandations 38 ( * ) .
L'accès de tous les malades aux traitements est un des fondements de notre politique d'assurance maladie , tels qu'ils ont été rappelés par le Président de la République lors de son allocution aux côtés du Président Jacob Zuma le 23 mars 2016 39 ( * ) : « Dans une démocratie, il ne peut pas être dit à une personne, quels que soient son niveau de revenus, ses origines, son parcours : vous ne pourrez pas être soigné et guéri parce que c'est trop cher. »
L'impossibilité d'accéder aux soins remboursés entraînerait des comportements de contournement du circuit du médicament français. L'éditorial du Parisien du 5 avril 2016 s'interroge : « Combien sont-ils en France à devoir se résoudre, parfois sur les conseils de leur propre médecin, de se fournir en médicaments à l'étranger ? » puis constate : « Certains patients dont le médicament n'a pas encore d'autorisation ou dont le coût, prohibitif, oblige les hôpitaux à choisir sur [sic] les malades qui en bénéficieront, franchissent le pas. » Le quotidien relate ensuite le cas d'Audrey dont l'infection par l'hépatite C ne correspondait pas aux indications et à laquelle un hépatologue de l'AP-HP aurait conseillé d'aller en Egypte pour trouver un générique du Sovaldi.
S'agissant de la prise en charge des traitements relatifs à l'hépatite C, le Gouvernement a fait valoir que la prise en charge des patients français était plus large que celle des autres pays européens et que les indications fixées par la Haute Autorité de santé correspondent à la capacité de prise en charge des patients par les services hospitaliers spécialisés. Il n'aurait donc pas été possible de prendre en charge plus de patients, quand bien même le remboursement aurait prévu des indications plus larges.
La stratégie de prise en charge tendait donc à ouvrir d'abord l'accès aux traitements aux personnes aux stades les plus avancés de la maladie pour l'étendre progressivement, une fois les cas les plus graves traités. Cette approche en terme thérapeutiques s'appuie par ailleurs sur l'entrée sur le marché de nouveaux AAD concurrents du Sovaldi et entrainant donc des baisses de prix. Ainsi les malades les plus nombreux devraient être pris en charge dans des délais compatibles avec l'évolution de leur pathologie et pour un coût inférieur.
Evolution des volumes de
Sovaldi®
consommés en France et en Europe en 2016
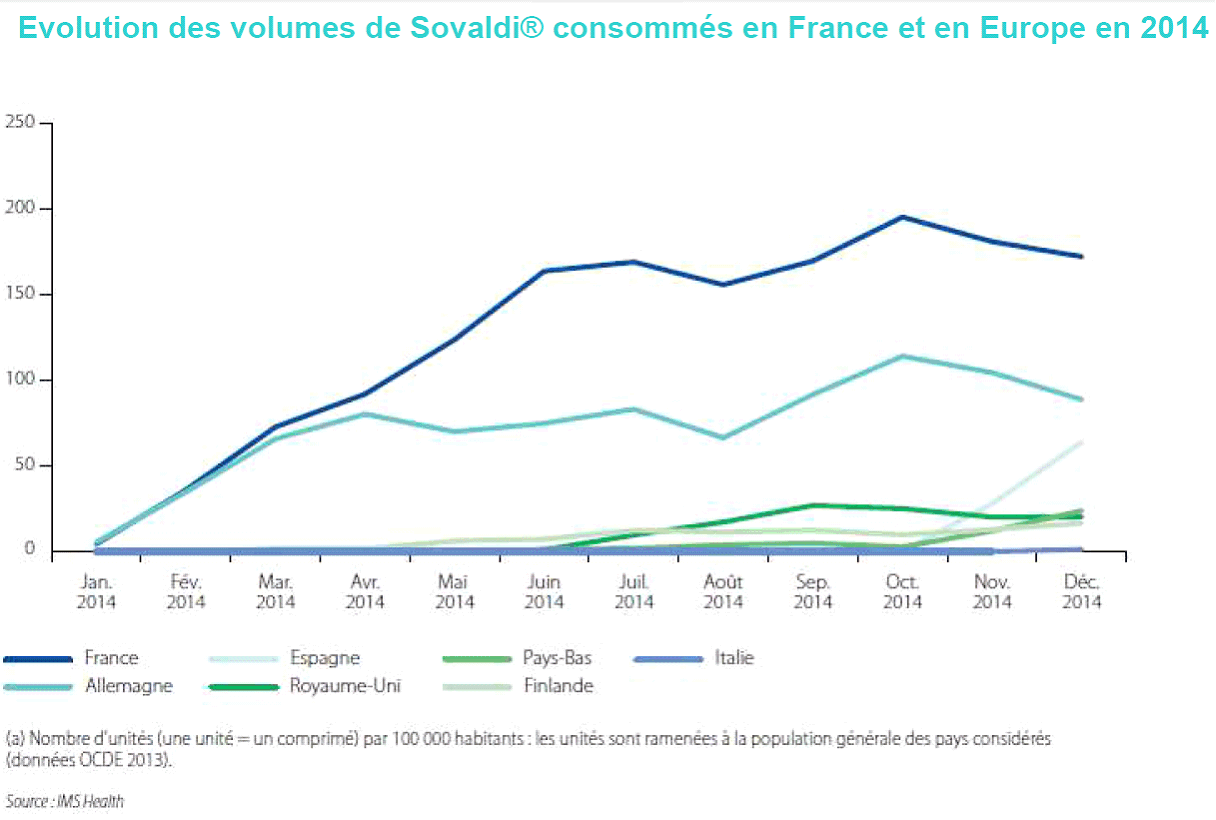
C'est donc logiquement que la ministre de la santé a saisi le 19 mai 2016 la commission de la transparence sur les modalités de prise en charge des AAD pour les patients au stade F2 de fibrose hépatique. L'avis ayant été rendu le 25 mai 2016, la ministre a annoncé l'extension de la prise en charge des traitements d'AAD a ces patients et la prise en charge des traitements pour tous les patients atteint de l'hépatite C à partir de septembre, suite à un nouvel avis de la commission de la transparence.
4. Des déremboursements mal perçus par l'opinion publique et parfois difficiles à intégrer à une stratégie médicale.
a) Le réexamen régulier du service médical rendu a remplacé les vagues successives de déremboursement
Depuis 1999 et la mise en place du plan « Aubry », plusieurs vagues de déremboursement ont été conduites afin de concentrer la dépense sociale sur les molécules les plus efficaces .
|
Chronologie établie par
l'Irdes
Juin 2001 : la Commission de la transparence, aujourd'hui rattachée à la Haute Autorité de santé (HAS), publie une liste de 835 médicaments jugés insuffisants sur 4 890 produits évalués. Le gouvernement décide d'étudier ces produits au cas par cas. Août 2003 : la première vague de déremboursement concerne 72 spécialités (60 médicaments). Il s'agit essentiellement de "vieux" produits, dont certains peuvent être dangereux. Beaucoup d'entre eux sont retirés du marché. Février-mars 2006 : la deuxième vague de déremboursement concerne 282 spécialités pharmaceutiques (156 médicaments) : des expectorants, des fluidifiants bronchiques, des produits de phytothérapie, des oligoéléments et des médicaments contre les troubles digestifs. Pour 105 médicaments veinotoniques, les pouvoirs publics créent un taux de prise en charge provisoire de 15 % (au lieu de 35 %) destiné à préparer leur déremboursement total. Janvier 2007 : la troisième vague de déremboursement ne se fait pas. Contre l'avis de la HAS, le gouvernement ne dérembourse pas 89 médicaments jugés insuffisants, dont des vasodilatateurs. Le taux de remboursement de certains médicaments passe de 35 % à 15 %, avant leur déremboursement total prévu pour janvier 2008. C'est par exemple le cas d'antidiarrhéiques et d'antitussifs. 1 er janvier 2008 : déremboursement total des phlébotoniques et des veinotoniques. Arrêté du 30 septembre 2011 : il liste les 26 spécialités pharmaceutiques déremboursées à compter du 1 er décembre 2011. Les radiations concernent 26 molécules (80 radiations au total en tenant compte des présentations et des génériques). |
Ces mesures d'ampleur portées par le Gouvernement ont été arrêtées depuis 2012 au profit d'une gestion des taux de remboursement au travers des saisines de la commission de la transparence .
En effet, l'article R. 163-2 du code de la sécurité sociale dispose que l'inscription d'une spécialité sur la liste des médicaments remboursables est prononcée pour une durée de cinq ans renouvelable 40 ( * ) . La commission de la transparence est donc saisie chaque année de demandes de renouvellement de l'inscription de médicaments : « À cette occasion, la commission se prononce sur le maintien ou la modification du service médical rendu des spécialités concernées en prenant en compte à la fois des nouvelles données d'efficacité et de tolérance disponibles et des données acquises, des évolutions des pratiques concernant les pathologies et les stratégies thérapeutiques des indications concernées ».
En dehors des demandes émanant des industriels, la commission de la transparence peut être saisie par le ministère, le collège de la HAS, ou s'autosaisir de la réévaluation d'un médicament ou d'une classe de médicaments.
Dans la majorité des cas, le réexamen confirme le niveau de SMR déjà reconnu. Dans quelques rares cas, le réexamen peut conduire à la reconnaissance d'un service médical rendu plus élevé. Surtout, plusieurs dizaines de décisions tendent à la réduction du SMR ou à sa déclaration comme insuffisant. Ceci entraîne la recommandation d'une baisse du taux de remboursement, voire d'un déremboursement.
|
Décisions du rapport annuel 2014 de la HAS 79 avis ont été rendus en 2014, dont 1 qui concernait une saisine de réexamen de population cible et donc ni le SMR, ni l'ASMR. Parmi ces avis, 13 ont été rendus en réponse à la saisine conjointe de la Direction générale de la santé, de la Direction de la sécurité sociale et de la Direction générale de l'offre de soins qui fait suite aux travaux menés par le Conseil de l'hospitalisation pour mettre à jour la liste des médicaments facturables en sus des prestations hospitalières. La HAS donc a été saisie en octobre 2013 pour se prononcer sur l'ASMR de 13 des spécialités figurant sur cette liste. Compte tenu de l'ancienneté des évaluations antérieures de certains de ces produits, la commission a reconnu : 8 SMR important, 4 SMR faible, 1 SMR insuffisant et 8 ASMR V, 1 ASMR IV, 3 ASMR II. Parmi les 65 autres avis rendus suite à une réévaluation, la commission a maintenu ses conclusions précédentes à 36 reprises. Parmi les 29 avis ayant vu une modification des conclusions de la commission : - 6 ont conclu à une baisse du SMR le plus élevé entraînant une recommandation de prise en charge du médicament à un taux plus bas ; - 19 ont conclu à l'octroi d'un SMR insuffisant dans une seule indication ou une population, recommandant ainsi la restriction du périmètre de prise en charge du médicament concerné ; - 4 ont conduit la commission à conclure à un SMR insuffisant pour la totalité des indications thérapeutiques et, de ce fait, à une recommandation d'arrêt de la prise en charge du médicament. |
En 2015, seize arrêtés ont été pris par la ministre en charge de la sécurité sociale sur le fondement des réévaluations conduites par la commission de la transparence. Ils ont exclu du remboursement 351 spécialités, plusieurs spécialités pouvant correspondre aux différents conditionnements et dosages d'un même médicament .
Les vagues de déremboursement de 2011 et 2012 ont conduit, d'après l'Irdes, à une économie respectivement d'environ 30 et 50 millions d'euros. (Les économies liées aux déremboursements depuis cette date n'ont pas été chiffrées.) Cependant l'impact à moyen terme de ces mesures est contesté.
b) Des déremboursements contestés
La contestation des déremboursements s'exprime tant au sein de la presse et de l'opinion publique que parmi les professionnels de santé qui soulignent le risque d'un report de prescription des spécialités déremboursées vers les médicaments qui le sont.
A titre d'exemple, en novembre 2013, la commission de la transparence a considéré que les antiarthrosiques symptomatiques d'action lente, précédemment remboursés à hauteur de 15 % par la sécurité sociale, ont un effet minime « sur la douleur et la gêne fonctionnelle liées à l'arthrose (...) et sont de pertinence clinique discutable. Ils ne permettent pas de réduire la consommation d'anti-inflammatoires non stéroïdiens (AINS). De ce fait, le service médical rendu par ces médicaments est insuffisant pour justifier leur prise en charge par la solidarité nationale ».
En conséquence, un arrêté du 16 janvier 2015 a radié à compter du 1 er mars 2015 ces spécialités pharmaceutiques de la liste des médicaments remboursables.
L'Association française de lutte anti-rhumatismale (Aflar), qui indique, sur son site, regrouper des associations de patients et de professionnels de santé, a contesté cette décision. Elle a lancé une pétition en ligne destinée à dire « Non au déremboursement des traitements de l'arthrose » présentée comme envisagée par le Gouvernement. Cette pétition, ouverte le 25 juillet 2014, se prévaut de 162 789 signatures 41 ( * ) .
Les laboratoires ont également saisi la presse pour relayer les positions de l'Aflar. Ainsi, le laboratoire Expanscience a publié le 8 septembre 2015 un communiqué de presse intitulé « Six mois après le déremboursement des antiarthrosiques symptomatiques d'action lente : des patients en attente d'une forte mobilisation ». Il comporte notamment la citation suivante attribuée au Pr Pascal Richette, chef de service de rhumatologie à l'hôpital Lariboisière : « les patients qui prennent ces anti-arthrosiques, même s'ils ont une efficacité modeste, pourraient consommer moins d'anti-inflammatoires et moins d'antalgiques ».
L'origine de cette citation n'est pas clairement identifiable, mais un entretien accordé par le Pr Richette au quotidien Metronews le 3 mars 2015 42 ( * ) comporte les développements suivants : « Si la Haute Autorité de santé dit dérembourser les médicaments les moins performants pour prendre en charge les plus efficaces, dans le cas de l'arthrose, "la pharmacopée est réduite ".
Or, « quand vous déremboursez un médicament, le volume des prescriptions diminue de 50 % ". Le risque, donc, "c'est que les patients et les prescripteurs se tournent vers les antalgiques (tramadol, codéine) et les consommations d'antiinflammatoires non stéroïdiens (aspirine, ibuprofène)" alors que leurs effets indésirables sur le plan digestif et cardiovasculaires sont plus rares mais plus graves, surtout chez le sujet âgé.
(...) Il serait alors plus sûr que les médecins continuent à prescrire ces cinq médicaments malgré le déremboursement. D'autant que service médical rendu insuffisant signifie "insuffisant pour justifier une prise en charge financière par la solidarité nationale" et non médicament dangereux ou inefficace. "L'arsenal thérapeutique à notre disposition a des effets secondaires et une efficacité modeste mais celle-ci reste supérieure au placebo". »
La contestation porte donc sur la manière dont la mesure sera perçue par les patients (le médicament déremboursé n'est pas nécessairement inefficace ou dangereux mais risque d'être vu comme tel) et par les médecins (il faut montrer au patient qu'on lui donne le meilleur traitement possible). Elle n'est pas véritablement celle du remboursement ou non-remboursement, celui-ci étant déjà au taux le plus faible.
De fait, d'après l'étude conduite par l'Irdes en 2005 comparant la prise en charge des médicaments en Allemagne, Angleterre et France, « ce sont les comportements de prescription et non le nombre de produits pris en charge qui expliquent les écarts de dépenses entre les pays » 43 ( * ) .
Le déremboursement est donc une action sur la conséquence (le remboursement) et pas sur la cause (la prescription) .
Il s'expose ainsi au risque de n'avoir qu'une efficacité limitée. Le rapport sur la surveillance et la promotion du bon usage du médicament en France, remis en septembre 2013 par Bernard Bégaud et Dominique Costagliola à la ministre en charge de la santé, détaille les risques liés au report de prescription et propose une évolution des avis de la HAS.
« En l'absence de messages clairs sur l'attitude à adopter par les praticiens, le retrait du marché ou le déremboursement (partiel ou total) d'une spécialité ou d'une classe induit généralement son « remplacement ». Les « alternatives » étant souvent plus coûteuses et parfois plus mal tolérées », « l'économie » ayant motivé le déremboursement correspond de fait a posteriori à un surcoût parfois important. Avant toute décision, les conséquences sanitaires et économiques devraient être anticipées et prises en compte, et une surveillance mise en place. Pour les déremboursements partiels ou totaux, l'avis de la HAS devrait être accompagné d'une information aux prescripteurs indiquant l'attitude thérapeutique à privilégier et les alternatives de remplacement s'il y a lieu. Cet avis ne devrait pas se limiter à signaler que le médicament ou la classe « n'a pas sa place dans la stratégie thérapeutique » mais, justement, indiquer quelle est cette stratégie thérapeutique et ce qu'il convient de faire, et ce qu'il convient de ne pas faire. L'exemple du déremboursement de l'Euphytose® (anxiolytique et hypnotique « doux » à base d'extraits de plantes) ayant entraîné un report de prescription massif vers les benzodiazépines, avec les conséquences que l'on connaît, est emblématique de ce phénomène. Celui du déremboursement des « anti-arthrosiques » (pratiquement 900 000 utilisateurs en général âgés ou très âgés) poserait le même problème (iatrogénie prévisible dans cette classe d'âge) si un report massif se faisait vers les anti-inflammatoires non stéroïdiens . »
Le rapport propose donc de combiner les avis de la commission de la transparence en cas de déremboursement avec des recommandations permettant d'assurer la meilleure prise en charge du patient tout en limitant le report de prescription.
On peut relever que la HAS s'efforce déjà de faire le point sur les meilleures prises en charge lorsqu'elle procède à un déremboursement. Ainsi lors de celui des anti-arthrosiques symptomatiques d'action lente elle a publié un article expliquant les raisons du déremboursement et faisant le point sur les modalités de prise en charge des patients. Cet article indique notamment que « La prise en charge d'un patient atteint d'une arthrose symptomatique des membres inférieurs repose d'abord essentiellement sur des mesures hygiénodiététiques (alimentation, sport, kinésithérapie...) » et en cas de douleur sur le paracétamol en première intention 44 ( * ) .
|
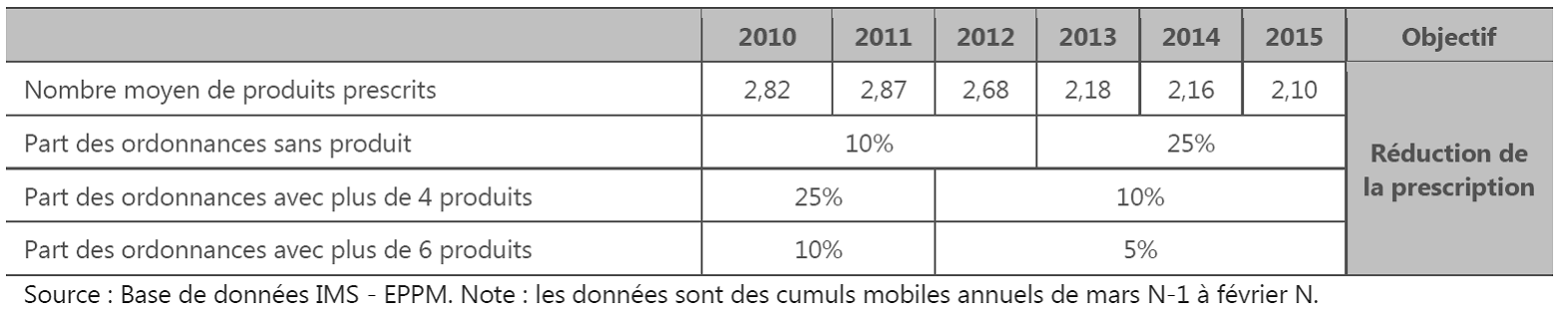
Le problème de la polymédication L'enjeu du nombre de médicaments prescrits est non seulement financier, mais d'abord médical car la polymédication peut être source de iatrogénie néfaste. Les effets néfastes de la polymédication sont en effet établis. Le rapport de Chloé Le Cossec pour l'Irdes 45 ( * ) précise que : « la polymédication est associée à une augmentation du risque de placement en établissement médico-social et à une augmentation des hospitalisations. Les événements iatrogéniques sont responsables de 5 à 25 % des admissions hospitalières et de 10 % des admissions aux urgences. Enfin, des études de cohortes prospectives ont permis d'identifier une surmortalité associée à la polymédication ». Néanmoins, la nécessité d'agir pour une meilleure prescription a été particulièrement soulignée s'agissant des cas de polymédication des personnes âgées. Que choisir santé a ainsi publié en février 2015 une enquête concluant que sur près de 350 ordonnances de plus de cinq lignes concernant des personnes de plus de 75 ans, 39,5 % comportaient un médicament a priori inadapté. Le rapport publié par l'Irdes en décembre 2015 relève les problèmes de définition des seuils de polymédication de la manière suivante : « Il n'y a actuellement pas de consensus sur le seuil à adopter pour définir la polymédication. Cela vient probablement du fait qu'il n'y ait pas de norme médicale permettant de définir ce qui serait un nombre trop important de médicaments ». Dans un objectif de mise en place et d'évaluation de politiques publiques, il semble plus opportun d'agir sur les individus les plus touchés par la polymédication. Un seuil à 10 médicaments, ciblant aux alentours de 30 % des 75 ans ou plus en ambulatoire, semble plus opérationnel qu'un seuil à cinq médicaments pour lequel 80 % des mêmes individus sont considérés polymédiqués. Cela ne signifie en aucun cas une absence de risque d'interaction ou même une absence de charge pour le patient en dessous de dix médicaments pris de façon chronique ; il a d'ailleurs été montré une association significative entre polymédication et fragilité, dépendance, mortalité et chutes dès cinq médicaments ». La prévention de la iatrogénie médicamenteuse fait partie des objectifs de l'assurance maladie qui dispose d'un indicateur de suivi du nombre moyen de médicaments prescrits par ordonnance. Le programme de qualité et d'efficience « Maladie » rattaché au PLFSS pour 2016 note que ce nombre a connu une baisse rapide.
|
* 23 ANSM, Analyse des ventes de médicament en France en 2013, juin 2014.
* 24 Ce sont les « médicaments irremplaçables pour affections graves et invalidantes ».
* 25 Définition du site ameli.fr de l'assurance maladie. Les ALD figurent sur une liste dont les critères sont fixés par un décret n° 2011-77 du 19 janvier 2011. Elles peuvent aussi être reconnues hors liste. Dans tous les cas, l'exonération du ticket modérateur a une durée limitée, en fonction de la pathologie.
* 26 62,15 % contre 37,85 %.
* 27 Décret n° 2008-641 du 30 juin 2008 relatif aux médicaments disponibles en accès direct dans les officines de pharmacie.
* 28 Sur son site, l'ANSM définit ainsi son rôle. « [L'agence établit] la liste des médicaments qui peuvent être présentés en accès direct dans les pharmacies selon des critères choisis pour garantir la sécurité sanitaire et la sécurité des patients : ces médicaments, du fait de leurs indications thérapeutiques, peuvent être utilisés sans intervention d'un médecin pour le diagnostic, l'initiation ou la surveillance d'un traitement ; de plus, ils présentent une posologie, une durée prévue de traitement et une notice adaptées. Le conditionnement correspond à la posologie et à la durée prévue de traitement. Pour des raisons de sécurité, certains médicaments ne sont pas éligibles, en particulier : les médicaments présentant des contre-indications majeures ou un risque important d'interactions médicamenteuses ; les médicaments destinés à la population pédiatrique, dont le niveau de sécurité ne serait pas suffisant pour une utilisation en automédication. »
* 29 « Le terme médication officinale désigne les médicaments destinés à traiter des symptômes courants et bénins, pour une durée limitée, sans l'intervention du médecin, avec l'aide du pharmacien ». Afssaps 2008.
* 30 Idem.
* 31 « Il faut un statut pour l'automédication », Espace social européen, 1090, du 20 mai au 2 juin 2016.
* 32 Presses universitaires de France, 2012.
* 33 L'ANSM note que deux conditions cumulatives doivent être réunies : « l'existence d'un besoin non couvert par une alternative médicamenteuse autorisée en France dans l'indication concernée et un rapport bénéfice/risque du médicament présumé favorable ».
* 34 Décision établissant la Recommandation Temporaire d'Utilisation d'Avastin (25/06/2015). Le Conseil d'Etat statuant en tant que juge des référés (ordonnance du 21 septembre 2015, société Roche SAS) a estimé qu'aucune des critiques formulées par la société Roche ne faisait sérieusement douter de la légalité de la décision.
* 35 Article L. 5121-12-1.
* 36 « Traitement de l'hépatite C : les patients pris en otage », Dr Chantal Guéniot, Egora, 18-24 janvier 2016.
* 37 Les considérants de l'arrêté comportent les mentions suivantes : « Considérant que, dans son avis du 14 mai 2014 susvisé, la commission de la transparence de la Haute Autorité de santé a précisé, au titre de ses recommandations, que, du fait de l'évolution lente de la pathologie, la mise sous traitement de certaines populations infectées par le virus de l'hépatite C pourrait être différée ;
Considérant que, dans sa recommandation de juin 2014 susvisée concernant la prise en charge de l'hépatite C par les médicaments antiviraux à action directe, le collège de la Haute Autorité de santé a précisé que la décision de mise sous traitement doit être adaptée au stade de fibrose hépatique concerné ainsi qu'à certaines caractéristiques des patients ;
Considérant que, s'agissant plus particulièrement des patients au stade de fibrose F2, le collège a estimé souhaitable une mise sous traitement, en recommandant toutefois de documenter au mieux le stade réel de fibrose avant de traiter et avec un degré de priorité moindre que pour les stades de fibrose plus avancés ; qu'ainsi il y a lieu de prendre en compte, dans les indications de prise en charge de ces médicaments, parmi ces patients, la sévérité constatée de la fibrose de stade 2 ;
Considérant que les ministres compétents, au regard notamment des appréciations concordantes susvisées de la Haute Autorité de santé et conformément à l'article L. 162-17, alinéas 2 et 3, du code de la sécurité sociale, estiment fondé de limiter la prise en charge du médicament relevant du présent arrêté aux indications thérapeutiques figurant en annexe et, au regard notamment de ces indications, de conditionner cette prise en charge au mode d'organisation des soins précisé dans cette même annexe.
* 38 « Quand l'hépatologie s'enhardit à propos de l'efficacité des nouveaux médicaments de l'hépatite C, mais reste muette sur les lourds liens d'intérêts qui l'unissent aux industriels », François Pesty, 10 juin 2015, www.formindep.org/Quand-l-hepatologie-s-enhardit-a.html#Propos-excessifs.
* 39 Déclaration du président de la République lors d'un déplacement à l'Hôpital Léon Bérard de Lyon.
* 40 Cette durée était de trois ans avant 1999.
* 41 www.stop-arthrose.org/petition
* 42 « Arthrose : 5 choses à savoir sur les médicaments déremboursés », www.metronews.fr/info/5-choses-a-savoir-sur-les-medicaments-contre-l-arthrose-qui-vont-etre-derembourses/mobA!MZjdDsIurtfk/ , consulté le 20 mai 2016.
* 43 « Les politiques de prise en charge des médicaments en Allemagne, Angleterre et France », Luc Nguyen-Kim, Zeynep Or, Valérie Paris, Catherine Sermet, Bulletin d'information en économie de la santé, n° 99 octobre 2005.
* 44 « Prise en charge de l'arthrose : le paracétamol en première intention lors des crises douloureuses »,
Actualités & Pratiques - N° 57 - Mars 2014.
* 45 La polymédication au regard de différents indicateurs de sa mesure : impact sur la prévalence, les classes thérapeutiques concernées et les facteurs associés, Chloé Le Cossec, Les rapports de l'Irdes, n° 562, décembre 2015.