4. En matière d'information et de communication
La
Cour des comptes avait considéré que l'information demeurait,
d'une manière générale, le point faible de l'AFSSAPS, la
culture de base de ses agents étant une culture scientifique
centrée sur la sécurité.
Elle estimait, d'une part, le système informatique n'était pas de
bon niveau. L'absence de schéma informatique et la coexistence de
différents systèmes hérités des différentes
administrations ayant abandonné certaines de leurs compétences au
profit de l'Agence ont conduit à un véritable
« bricolage », qui a, en partie, expliqué le retard
pris en matière d'indicateurs d'activité et de contrôle de
gestion.
D'autre part, le secrétariat de la commission de la transparence,
composé d'une douzaine de personnes, était, selon la Cour des
comptes, beaucoup trop insuffisant pour remplir ses missions. Or, le passage
d'un dossier devant la commission de la transparence constitue la
première étape de la procédure du remboursement d'un
médicament, après l'autorisation de mise sur le marché
mais avant la fixation du prix par le comité économique des
produits de santé (CEPS).
Cette lacune du secrétariat de la
commission de transparence serait une des causes de l'absence
d'évaluation des dépenses des médicaments ou des
dispositifs médicaux
31(
*
)
.
La Cour des comptes avait indiqué à votre rapporteur que, au
début 2002, l'AFSSAPS, selon une enquête d'opinion menée
auprès du corps médical, occupait la 16
ème
place, sur 20, en termes de source d'informations pour les
médecins !
De surcroît - et la Cour des comptes y voyait avec raison un
étrange paradoxe - l'Agence avait également été
chargée du secrétariat du Fonds de promotion de l'information
médicale et médico-économique (FOPIM), créé
par l'article 47 de la loi de financement de la sécurité sociale
pour 2001. Il peut paraître curieux de confier le secrétariat d'un
tel dispositif à un organisme dont le système d'information est
en soi lacunaire.
Or, sur chacun de ces trois points, votre rapporteur a pu constater que
l'AFSSAPS avait accompli des progrès notables, en particulier en
matière de plus grande transparence de ses décisions.
a) Un système informatique en cours d'amélioration
Au cours
des deux dernières années, l'Agence a consacré un effort
particulier au renforcement des moyens humains du département des
systèmes d'information et de la documentation (DSID).
En effet, comme l'Agence l'a elle-même noté, «
le
développement des projets informatiques
[...]
a été
fortement entravé dans les années 2000-2001 par les
difficultés de recrutement qui ont limité les possibilités
de structuration du DSID
».
En 2003, tous les recrutements du DSID devraient être effectifs. Un poste
de concepteur-développeur a été transféré de
l'unité projets à la cellule d'informatique médicale.
L'unité projets compte 13 agents en 2003.
Les concepteurs-développeurs intégrés en 2002, pour la
moitié des jeunes diplômés de MIAGE
32(
*
)
, sont aujourd'hui opérationnels
sur des projets concrets tels la migration CODEX, le développement de
l'Intranet, la rénovation de l'application ATU (Autorisation Temporaire
d'Utilisation) ou encore la mise en place de l'application NDS (
National
Database System
) pour la gestion des psychotropes et stupéfiants.
Deux chefs de projets seniors ont été recrutés pour
prendre en charge des projets prioritaires tels que la pharmacovigilance, en
juin 2003, le suivi de dossier et le référentiel
administrés. Un développeur-concepteur est venu renforcer
l'unité projet sur le pôle développement.
Selon l'Agence, «
cette structuration et le renforcement de ces
moyens étaient une étape indispensable pour maintenir et
développer le parc applicatif de l'AFSSAPS et consolider
l'infrastructure informatique et les réseaux
».
Concernant les moyens financiers et les marchés, le marché
d'infogérance bureautique, publié le 13 août 2002, a
été notifié le 31 décembre 2002. La prestation a
démarré le 3 mars 2003, et, d'après l'Agence, serait
appréciée par les utilisateurs qui sont satisfaits d'un accueil
téléphonique de 8 heures à 19 heures et qui
voient leurs demandes référencées et traitées dans
des délais raisonnables. Un bilan est prévu après trois
mois d'activité. Il mesurera le volume des appels, leur délai de
traitement et l'efficacité du service apporté.
L'Agence a estimé que «
la mise en place d'un marché
pour l'acquisition de matériels standards est à terme souhaitable
mais n'est pas une priorité
».
Concernant les équipements et infrastructures informatiques, l'Agence a
une politique de standardisation et d'industrialisation. Deux commandes par an
sont lancées pour garantir une homogénéité des
modèles achetés, ordinateurs et imprimantes. Cette
standardisation du parc permet de gérer un nombre limité de
configurations et de maîtriser les équipements acquis. Pour
optimiser les coûts de maintenance des matériels hors garantie
constructeur, le cycle de vie des équipements a été
fixé à trois ans.
Fin mars 2003, les liaisons informatiques de Lyon et de Vendargues ont
été modifiées pour passer à une puissance 15 fois
supérieure. Cette opération rend possible l'utilisation des
applications de l'Agence par les utilisateurs des sites
déconcentrés. Elle permet également d'offrir à tous
les agents, quelque soit leur localisation géographique, la même
qualité de service au niveau de l'accès à Internet et
Intranet, exception faite du site de Londres.
Le câblage du site Pleyel est terminé, les équipements
réseau du site ont été changés. Le réseau
local est maintenant disponible 24 heures sur 24, et sa bande passante
nominale a été multipliée par 10. Une nette
amélioration des temps de réponses serait constatée par
les utilisateurs et le SVP informatique ne recevrait plus d'appels liés
à la qualité du câblage et aux performances du
réseau local.
Une opération de remise à niveau de la configuration des serveurs
(standardisation des systèmes, mise à jour des versions
logiciels, rationalisation des configurations) a été
opérée sur tous les sites de février à mars 2003.
Une attention particulière a été portée au niveau
de la sécurité informatique pour préparer l'audit
sécurité qui sera conduit par les services du Premier ministre au
cours du second semestre.
Les projets informatiques ainsi qu'un calendrier de mise en oeuvre ont
été discutés au cours des comités directeurs
informatiques d'octobre 2002 et de l'année 2003. Ils
comprennent :
- des applications informatiques à moderniser : les applications
développées par les utilisateurs ont été
recensées et sont en cours de qualification par les correspondants
informatiques des directions. Elles seront graduellement prises en charge par
le DSID, en fonction des ressources disponibles et de l'avancement des projets.
Quelques applications seront totalement revues dans le cadre d'un projet plus
large. Le projet Pharmacovigilance est identifié comme prioritaire, un
chef de projet senior a été recruté en juin 2003 pour le
conduire ;
- une politique informatique globale pour l'Agence : lors du comité
de direction informatique du 30 avril 2003, le directeur général
a confirmé que la réflexion sur un schéma directeur des
systèmes d'information de l'Agence devrait être conduite en deux
temps : développement pragmatique d'applications
(pharmacovigilance, suivi de dossier, les référentiels...) puis
élaboration d'un schéma directeur. Il convient de noter que le
projet de migration de CODEX est en cours et devrait être terminé
pour la rentrée de septembre 2003. Les applications satellites sont
modifiées pour prendre en compte la nouvelle structure des tables de
référence et l'identifiant unique de spécialité
pharmaceutique (IUSP). La mise en oeuvre de l'IUSP dans CODEX a des enjeux
internes et externes : elle permettra de reconnaître de
manière univoque une spécialité pharmaceutique et
facilitera l'interopérabilité des systèmes de l'Agence
(pharmacovigilance, suivi de dossier, essais cliniques, outil de gestion des
analyses...) et des systèmes extérieurs à l'AFSSAPS
(prescription automatisée, pharmacovigilance...). Les applications
développées dans le cadre de nouveaux projets (pharmacovigilance,
suivi de dossier) utiliseront le référentiel CODEX. Cette
politique générale d'utilisation de référentiels
est renforcée par la construction progressive de nouvelles banques de
données (administrés, dispositifs médicaux,
réactifs, cosmétiques) garantissant l'unicité et la
cohérence des données du système d'information de
l'Agence ;
- la communication électronique avec l'extérieur : la mise
en place d'échanges électroniques bidirectionnels entre l'Agence
et les professionnels de santé au sens large (organismes nationaux,
instances européennes, industriels, associations, usagers...) se fait
progressivement avec l'évolution de la réglementation. Une
première étape a été franchie avec les fiches
d'incidents transfusionnels et avec la transmission des effets
indésirables à l'Agence européenne du médicament.
La mise en place d'échanges électroniques impose une modification
des outils mais surtout une adaptation de l'organisa
tion ;
- les référentiels électroniques : un projet
d'élargissement du référentiel CODEX aux données
cliniques a été examiné lors du comité de direction
informatique du 30 avril 2003. Son lancement est prévu début
2004. Par ailleurs, un projet de remise à jour de l'ensemble des
résumés des caractéristiques des produits des AMM de
médicaments est en cours de finalisation. L'objectif fixé par le
directeur général est de disposer des résumés au
début 2004. La réalisation de ce projet nécessitera le
recours à une prestation externe.
b) La politique de communication de l'AFSSAPS
La
mission de communication mise en oeuvre à la création de
l'AFSSAPS est devenue une cellule de communication en 2001. Cette cellule
comprend une équipe de 4 personnes.
Le budget global de communication s'est élevé en 2002 à
253.700 euros, dont 115.000 euros ont été
affectés au poste édition.
• La communication externe
La politique de communication externe de l'AFSSAPS repose sur une double
orientation : assurer la lisibilité de l'activité en
matière de sécurité sanitaire des produits de santé
et mieux faire connaître le rôle et les missions de l'Agence. Elle
se traduit par la diffusion d'informations sur le bon usage des produits de
santé (évolution du rapport bénéfice/risque),
l'élaboration et la diffusion de recommandations de bonnes pratiques
(synthèse de l'expertise sur un produit ou une classe de produits), la
diffusion de messages d'alertes sur les défauts de qualité (non
conformité des produits de santé) et l'organisation de
manifestations thématiques ou à vocation transversale sur les
dossiers traités et la démarche d'expertise.
Les publics concernés sont essentiellement les professionnels de
santé, médecins et pharmaciens, relais de l'information
auprès des patients et associations de patients, avec pour objectif la
lisibilité des mesures prises par l'Agence.
Dans le domaine du médicament, les professionnels de santé,
médecins et pharmaciens, sont régulièrement destinataires
de courriers d'information sur le bon usage des médicaments, faisant
notamment suite à l'actualisation des données de
pharmacovigilance.
En 2002, plus d'une trentaine de
Lettres aux prescripteurs
ont
été diffusées aux médecins ou pharmaciens
concernés, directement par l'AFSSAPS ou par le biais de l'industrie
pharmaceutique sur la base d'une information validée. Par ailleurs, des
mises au point sur des aspects ciblés de santé publique sont
élaborées chaque année et diffusées aux
professionnels de santé. Elles s'inscrivent dans le cadre de la
démarche d'information sur la iatrogénie médicamenteuse
issue des travaux d'expertise des sous-groupes de la commission nationale
d'autorisation de mise sur le marché et d'études
épidémiologiques menées avec le concours des CRPV
(antivitamines K, héparines de bas poids moléculaire...) ou font
la synthèse des travaux des groupes de travail de l'AFSSAPS (utilisation
de l'hydrate de chloral, expertise DHEA, psychoactifs et soumission chimique,
actualisation de l'information sur Distilbène...). Enfin, les
modifications apportées à l'autorisation de mise sur le
marché, à l'échelon européen, sont également
relayées aux professionnels de santé dans le cadre d'actions de
communication menées à une date arrêtée par
l'ensemble des Etats membres (contraceptifs oraux de
3
ème
génération...). Par ailleurs, les
recommandations de bonnes pratiques sont disponibles sur le site Internet de
l'Agence et font l'objet de publications dans des revues scientifiques.
Dans le domaine des dispositifs médicaux, les mesures prises par
l'Agence après évaluation des signalements de
matériovigilance sont régulièrement relayées aux
correspondants de matériovigilance implantés dans les
établissements de soins. Par ailleurs, une rubrique
matériovigilance, mise en place en 2000 sur le site Internet de
l'Agence, apporte des informations pratiques aux correspondants de
matériovigilance et fabricants de dispositifs médicaux, et
regroupe toutes les mesures de sécurité sanitaire prises par
l'Agence.
Celle-ci publie depuis trois ans des périodiques d'information
destinés aux réseaux de vigilance. Ces bulletins,
Vigilances
ou
Hémovigilance
, permettent d'assurer un
retour d'information et de répondre aux attentes de ces réseaux,
en rendant plus lisibles certaines des actions menées ou des
décisions prises par l'Agence. L'information sur les vigilances devrait
être renforcée en 2003 par la diffusion d'un bulletin
destiné au réseau de matériovigilance.
Outre ces publications, l'AFSSAPS organise régulièrement des
colloques et réunions d'information pour des publics externes, soit dans
le cadre de réunions d'experts (environnement sanitaire des tissus,
secrétariats nationaux de la pharmacopée européenne,
inspection des fabricants de dispositifs médicaux, DHEA...), soit dans
un but institutionnel d'information sur le rôle et les missions de
l'Agence (les Journées de l'AFSSAPS).
Par ailleurs, l'Agence est présente sur des congrès scientifiques
ou des salons professionnels, à la fois dans le cadre d'interventions,
par la production de posters scientifiques et par la présence de son
stand (Journées Internationales de Biologie, Congrès
Hémovigilance, Journées Françaises de Radiologie...).
Le domaine des relations avec les médias se caractérise par la
diffusion chaque mois, de deux à trois communiqués de presse sur
des sujets concernant au premier chef l'évolution du rapport
bénéfice/risque des médicaments. Parallèlement,
l'Agence organise chaque année trois à quatre conférences
de presse à l'issue de démarches d'évaluation (ESST et
produits de santé, risque musculaire des statines, traitement hormonal
substitutif de la ménopause...). Ces opérations de presse
interviennent systématiquement après l'information relayée
aux professionnels de santé.
Bilan 2001/2002 du site Internet de l'AFSSAPS
Le site
Internet de l'AFSSAPS (
www.afssaps.sante.fr
) avait
été créé en décembre 1998 pour l'Agence
du médicament.
Il a subi une
profonde mutation
pour fournir aux professionnels de
santé, aux usagers et aux industriels, une information de
référence sur les produits de santé, diffuser les alertes
de sécurité sanitaire et contribuer à la promotion du bon
usage des produits de santé. Il constitue un moyen incontournable de
communication pour l'AFSSAPS. Le site permet aujourd'hui de diffuser de
nombreux documents techniques et scientifiques, les alertes de
sécurité sanitaires prises à l'initiative de l'AFSSAPS,
les lettres aux prescripteurs, les communiqués de presse. Des dossiers
thématiques sont également proposés ainsi que le rapport
annuel d'activité.
Par ailleurs le site s'est enrichi de la mise en consultation des avis de la
commission de la transparence, en 2001, du répertoire des
spécialités pharmaceutiques et du répertoire des essais
cliniques, en 2002. Fin 2002, une liste de diffusion électronique a
été ouverte au public, permettant aux personnes inscrites
d'être informées de toute nouvelle information mise en
consultation.
Les objectifs actuels du site sont :
- fournir aux professionnels de santé, aux usagers, aux industriels, une
information de référence sur les produits de santé ;
- diffuser les alertes de sécurité sanitaire de l'AFSSAPS ;
- contribuer à la promotion du bon usage des produits de
santé ;
- simplifier les démarches des professionnels de santé et des
industriels dans leurs relations avec l'établissement (guides de
remplissage des dossiers et formulaires de déclaration de demandes
d'autorisation).
L'accès du site est libre et aucune forme d'inscription n'est
nécessaire.
Pour piloter cette mission, une cellule Internet a été
créée en 2001. Elle est placée à la direction
générale et est composée d'un coordinateur, de deux
webmasters
et d'une secrétaire à mi-temps. Un
comité éditorial a été mis en place pour assurer la
pertinence et la cohérence des informations publiées sur le site
Internet.
Le nombre de visiteurs du site Internet est en constante augmentation depuis
1998. Il a été multiplié par 3,5 entre 2000 et 2002, avec,
en décembre 2002, une moyenne de 5.000 visiteurs par jour
ouvré.
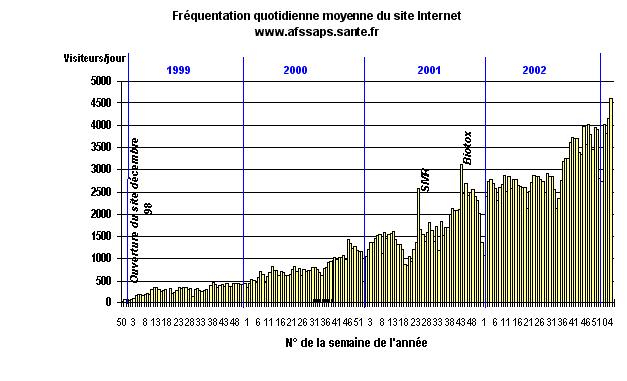
Fréquentation du site Internet de l'AFSSAPS
|
|
2001 |
2002 |
Variation |
|
Pages vues |
2.700.000 |
6.300.000 |
+ 130 % |
|
Visites |
625.000 |
1.000.000 |
+ 60 % |
|
Visiteurs/jour ouvrable |
3.000 |
5.000 |
+ 67 % |
Source : AFSSAPS
Exemple de pages les plus fréquentées
(en nombre de pages vues)
|
|
2001 |
2002 |
|
SMR (140
pages)
|
1.523/jour
|
700/jour
|
|
Fiches de transparence |
200/jour (pour les 41 fiches) |
300/jour (pour les 41 fiches) |
|
Avis de
la transparence
|
107/jour
|
115/jour
|
|
Ruptures de stock (depuis 1 er oct. 2002) |
- |
50/jour |
Source : AFSSAPS
En 2002, chaque communiqué de presse a été consulté
en moyenne 2.800 fois. Chaque offre d'emploi a été
consultée en moyenne 1.700 fois. Chaque lettre aux prescripteurs a
été consultée en moyenne 1.500 fois. Chaque alerte a
été consultée en moyenne 1.400 fois.
Rapports les plus téléchargés en 2001 et 2002
|
|
2001 |
2002 |
|
Répertoire des génériques |
4.000 |
8.000 |
|
Fiches biotox |
9.700-3.400 |
- |
|
Bonnes pratiques de pharmacovigilance |
2.280 |
5.800 |
|
Rapport DHEA |
4.787 |
5.700 |
|
Déclarations publiques d'intérêts |
- |
4.900 |
|
Rapport vente des médicaments |
4.020 |
4.800 |
|
Bulletin des vigilances 7 |
2.350 |
- |
|
Bulletin des vigilances 8-9 |
- |
5.000 |
|
Bulletin des vigilances 10-11 |
- |
3.500 |
|
ATU (doc. d'information) |
- |
4.700 |
|
Rapport vaccination anti hépatite B |
1.656 |
2.700 |
|
Rapport cérivastatine |
1.395 |
3.500 |
|
Divers rapports/recommandations |
|
1.500-2000 |
Source : AFSSAPS
La deuxième partie de l'année 2002 a été
marquée par la mise en ligne de deux bases de données
interrogeables par les internautes :
- le répertoire des spécialités pharmaceutiques qui est
consulté 180 fois par jour ;
- le répertoire des essais cliniques sur les maladies rares/graves, qui
reçoit quotidiennement une centaine de visites.
En fin d'année, a été ouverte au public une liste de
diffusion permettant aux internautes qui le souhaitent de s'inscrire pour
être informés dès la mise à disposition d'une
nouvelle information sur le site Internet. Cette liste a été
testée pendant l'été 2002, auprès de
300 professionnels de santé volontaires.
Les principales demandes d'ajustement souhaité par les premiers
utilisateurs ont été prises en compte avant l'ouverture au public
le 2 décembre 2002. Fin février 2003, plus de
4.000 personnes étaient inscrites.
Depuis le 1
er
janvier 2003
Rapport d'activité 12.000 téléchargements
Monographie DHEA : 9.300 téléchargements
Liste des spécialités indiquées dans le THS 9.200
téléchargements
Répertoire des génériques 8.200
téléchargements
La reprise dans des articles de presse des informations résultant des
manifestations organisées auprès des médias ou des
communiqués diffusés est en progression. Depuis un an, l'Agence
est systématiquement citée dès lors que la presse fait
état d'une information relative à la sécurité
sanitaire des produits de santé.
L'impact de l'information diffusée auprès des professionnels de
santé est, à ce jour, qualitativement mesurée par le biais
des courriers adressés et des contacts téléphoniques
auprès de la cellule de communication. Selon l'Agence,
«
dans la plupart des cas, les professionnels font état de
leur satisfaction sur l'information, mais souhaitent néanmoins que des
améliorations soient apportées à la forme, jugée
trop administrative
.
Un dispositif de mesure systématique
d'impact, en particulier sur les pratiques professionnelles, serait en cours de
mise en oeuvre. Par ailleurs, au cours de l'année 2001, le bulletin
Vigilances
s'est vu adjoindre des pages complémentaires devant
l'adhésion qu'il emportait auprès des professionnels de
santé
».
S'agissant des perspectives de la politique de communication en 2003 et 2004,
l'AFSSAPS est sur le point de se doter d'un nouveau logo reflétant son
aspiration à afficher une plus grande ouverture vers ses
différents publics avec une identité graphique plus forte.
Par ailleurs, elle organise, en 2003, ses 2
èmes
Journées dans un format nouveau, axé sur la volonté de
mieux expliquer son rôle, ses missions et son actualité à
travers des illustrations concrètes susceptibles de répondre aux
attentes des différents publics sollicités (professionnels,
institutionnels, presse, associations).
Ces deux dossiers majeurs entrent dans le cadre de la stratégie de
communication élaborée pour 2003 et 2004, pour laquelle l'AFSSAPS
recourt aux prestations d'une agence de conseil en communication.
Dans ce cadre, plusieurs outils de communication existants, notamment les
bulletins d'information, feront l'objet d'une expertise portant sur la
pertinence et l'impact. De même, les relations avec la presse seront
renforcées par la mise en oeuvre de points d'information sur les sujets
techniques de l'Agence ou autour de grandes thématiques de santé.
En termes de fonctionnement, un nouveau marché d'édition sera
opérationnel au cours du 2
ème
trimestre 2003. Il
permettra d'introduire de nouveaux outils de communication, notamment une
news letter
institutionnelle et une brochure de synthèse des
données d'activité de l'Agence, ou de concevoir de nouveaux
repères visuels pour les informations diffusées aux
professionnels de santé.
• Communication interne
La communication interne de l'Agence s'appuie sur trois orientations :
informer le personnel sur l'Agence et son environnement, favoriser
l'échange d'informations au sein de l'établissement, assister
l'ensemble des directions en proposant et en élaborant, à leur
demande, des outils de communication adaptés.
Dans ce cadre sont élaborées et diffusées des informations
de nature pratique ou sociale (organisation, règles à
respecter...), des informations sur l'actualité de l'Agence
(communiqués et points presse, réunions, séminaires,
colloques...), des informations sur les ressources humaines (réforme
statutaire et 35 heures...). Sur ce dernier point, sont également
organisés des « rendez-vous du personnel ». Dans le
même ordre d'idées, certaines des manifestations organisées
pour un public externe font l'objet de présentation à
l'identique, pour le public interne de l'Agence. Parallèlement, le
personnel dispose,
via
Intranet, d'une lettre bimestrielle d'information
comportant un dossier thématique central. Par ailleurs, 2 à 3
journées sont organisées annuellement pour les nouveaux
collaborateurs de l'Agence.
L'AFSSAPS a mis en place en 2002 le premier niveau de plate-forme technique de
l'outil Intranet, projet conduit en coordination avec le département des
systèmes d'information. Le développement de cet outil
(organisation, fonctionnement, charte graphique) est en cours de
réflexion.
Le rapport d'activité de l'AFSSAPS a subi, depuis 2 ans, de profondes
modifications de forme et de fond pour mieux refléter et illustrer
l'activité de l'établissement. Cette orientation se traduit par
des demandes d'informations nouvelles auprès des différentes
directions de l'établissement, notamment l'introduction d'un plus large
volume de données qualitatives.
c) Le projet @MM
L'article 47 de la loi de financement de la sécurité sociale pour 2001 avait confié à l'AFSSAPS la gestion du fonds de promotion de l'information médicale et médico-économique (FOPIM), lequel finance ou participe au financement d'actions d'information et de communication en matière de bon usage des produits de santé et de stratégie thérapeutique, notamment de prescription et de dispensation médicamenteuse. Le décret régissant le fonctionnement du FOPIM a été pris le 21 novembre 2001, et complété par la nomination de personnalités qualifiées en mars 2002.
Les activités du FOPIM
Le
FOPIM, avec la collaboration d'un groupe de praticiens de terrain, a
réalisé deux enquêtes sur les besoins d'information des
prescripteurs, dont une plus spécifiquement axée sur l'outil
Internet. Il a en outre contribué au volet concernant les professionnels
de santé de la campagne d'information sur les médicaments
génériques. Enfin, il a mis en place un groupe de travail sur les
bases de données médicament et les logiciels d'aide à la
prescription et lancé un appel à subvention pour des revues
indépendantes. Le comité d'orientation du fonds, au cours de sa
réunion du 17 juin 2003, a adopté les délibérations
concernant ces deux derniers projets, permettant ainsi leur réalisation
pratique.
La même disposition législative fixait à l'AFSSAPS la
mission de mettre en oeuvre, d'ici au 1
er
janvier 2003, une banque
de données administratives et scientifiques sur les médicaments
et les dispositifs médicaux, destinée à servir de
référence pour l'information des professionnels de santé
et des administrations compétentes en matière de produits de
santé.
Dans ce cadre, l'AFSSAPS a conçu le
projet @MM
qui a pour
objectif la publication sur son site Internet des décisions
d'autorisations de mise sur le marché, avec le résumé des
caractéristiques du produit et la notice destinée aux patients.
Le nombre de spécialités pharmaceutiques concernées est
d'environ 15.000.
Demande récurrente des professionnels de santé, le projet @MM
s'inscrit aussi, pour l'AFSSAPS, dans une démarche de transparence en
matière de publication et de diffusion de ses décisions
administratives.
Il n'en reste pas moins que cette disposition de la loi de financement de la
sécurité sociale pour 2001 illustre bien la tentation des
pouvoirs publics de mettre à la charge de l'Agence des missions
nouvelles alors qu'elle est par ailleurs confrontée aux
difficultés inhérentes à la transformation de l'ancienne
Agence du médicament et à sa montée en puissance.
Du reste, l'Agence a dû mobiliser des moyens spécifiques pour
développer ce projet :
- le mode de production des décisions d'AMM a été
réorganisé, parallèlement à la restructuration de
la direction de l'évaluation des médicaments et des produits
biologiques de l'établissement : leur rédaction a
été centralisée et des outils d'aide à la
rédaction mis à disposition ;
- 15 pharmaciens ont été recrutés pour une durée de
10 mois au début 2002 pour contrôler la concordance des
données contenues dans la base CODEX, base de données interne sur
le médicament de l'AFSSAPS, avec celles figurant sur les documents
princeps des archives de l'Agence ;
- le recours à une société de services en
ingénierie informatique pour développer l'application Web ;
- la mise en place d'une structure traditionnelle de projet impliquant
différentes directions de l'Agence au sein d'un comité de
pilotage.
Toutefois, comme l'a indiqué l'Agence à votre rapporteur,
«
le scénario préconisé par l'étude de
faisabilité initiale a privilégié une mise à
disposition progressive de ces données
», ce qui revient
à dire que
la mise en oeuvre du projet a pris du retard
.
En effet, si le répertoire des spécialités pharmaceutiques
a été mis à disposition sur le site Internet de l'AFSSAPS
le 17 juin 2002, soit avant le délai du 1
er
janvier 2003
fixé par le législateur,
c'est une version
« allégée » de ce répertoire qui a
été rendue accessible
:
- le contenu de la base de données en ligne est un sous-ensemble des
informations contenues dans la base de données CODEX ; il se
présente sur le site sous la forme d'un
extrait
, soit la fiche
récapitulant les données administratives, réglementaires
et pharmaceutiques de la spécialité pharmaceutique ; cet
extrait est toutefois actualité en fonction des décisions
modificatrices émises par l'AFSSAPS ;
- le contenu de la banque documentaire en ligne est un sous-ensemble des
informations contenues dans les AMM : résumé des
caractéristiques du produit et notice ; les
spécialités pharmaceutiques sont celles qui ont été
octroyées depuis le 1
er
janvier 2002 ; elles sont mises
à jour régulièrement.
En outre, la mise en place d'un référentiel complet s'est
heurtée à plusieurs obstacles :
- l'hétérogénéité du fonds documentaire,
marquée par la prédominance de documents sur support papier et
l'existence de formats électroniques différents ;
- l'évolution peu cohérente de la structure administrative des
décisions d'AMM ;
- l'absence de logiciel de gestion électronique de documents ;
- la qualité, présumée insuffisante par l'AFSSAPS
elle-même, du contenu des bases de données existantes ;
- le périmètre insuffisant des informations enregistrées
dans les bases de données existantes, en particulier l'absence de
données cliniques dans Codex ;
- une équipe de gestion des bases de données
sous-dimensionnées.
A la mi-mars 2003, le site Internet de l'Agence présentait les extraits
de 10.442 spécialités pharmaceutiques, 443 résumés
des caractéristiques du produit et autant de notices.
D'une manière générale, il convient de constater que
la
multiplicité des acteurs institutionnels ayant vocation à
communiquer auprès des médecins et du grand public
(AFSSAPS,
ANAES, caisses d'assurance maladie, INPES, ministère de la santé,
commission de la transparence, FOPIM)
a conduit le ministère à
en souhaiter une rationalisation
.
Selon l'Agence, «
compte tenu de la réforme de la
commission de la transparence en cours, il pourrait être envisagé
de rapprocher le FOPIM de cette dernière. Le secrétariat du FOPIM
devra dans ce cadre rester proche de celui de la commission de la transparence,
ce que devrait permettre l'organisation actuelle, puisque les activités
relatives au FOPIM et à la commission sont regroupées au sein
d'une même direction de l'AFSSAPS
».
-
-
- B. UNE ÉVALUATION DES ACTIVITÉS DE L'AGENCE INSUFFISAMMENT TOURNÉE VERS L'EFFICACITÉ
Les réponses que l'AFSSAPS a apportées sur ce point à votre rapporteur le confirment. Elle a ainsi indiqué qu'elle pouvait rendre compte « d'une importante « activité » dans son environnement et d'un nombre croissant de questions traitées avec toute la rigueur scientifique et techniques indispensables », ce qui est particulièrement succinct. Elle renvoie certes aux indicateurs présentés dans ses rapports d'activité, mais ceux-ci sont essentiellement d'ordre quantitatif. L'Agence a d'ailleurs implicitement reconnu ce fait puisqu'elle a noté que « l'ensemble des interventions et actions de l'Agence font l'objet d'un recensement ». Il s'agit bien, en effet, d'un recensement, et non d'une évaluation. Elle cite d'ailleurs elle-même des exemples : nombre d'AMM, nombre d'autorisations temporaires d'utilisation, nombre d'observations d'effets indésirables dans le domaine des vigilances, nombre de demandes traitées au titre de la transparence et de la publicité, nombre d'établissements contrôlés et de décisions, prises à la suite de ces inspections, nombre d'analyses réalisées par les laboratoires...
L'Agence a ainsi indiqué à votre rapporteur que, « concernant les indicateurs de suivi d'activités, le directeur général n'a jamais caché que l'exercice, qualifié de pertinent et de démarche nouvelle pour l'Agence dans le rapport d'audit IGF/IGAS, d'élaboration d'indicateurs en 2001 n'est qu'une ébauche à partir des données d'activité, certes imparfaite, et d'une estimation des ressources humaines consacrées à ces activités ».
Le travail actuel le plus important repose sur la mise en place d'indicateurs opérationnels, bien qu'il soit difficile d'appréhender globalement l'efficacité des actions d'une agence dont le champ d'intervention n'a cessé de croître .
Néanmoins, des points importants ont déjà été déterminés :
1) Le but est de lier les moyens aux objectifs et de déterminer les priorités en fonction des ressources disponibles.
Les indicateurs développés visent à quantifier, lorsque c'est possible, l'activité de l'Agence. Ils permettent d'évaluer ex ante les moyens nécessaires et de définir ainsi les objectifs accessibles en fonction des priorités et des obligations. Ex post , ils permettent de confirmer l'évaluation et de modifier, le cas échéant, les orientations.
Les tableaux de bord proposés et les indicateurs qui les composent visent ainsi à objectiver le travail de l'Agence :
- dans une approche globale, permettant une compréhension de l'activité générale de l'Agence et facilitant le travail des administrateurs et des ministères de tutelle ;
- en permettant également une analyse plus fine à la demande, dans le cadre du pilotage interne à l'établissement.
2) Une logique de produit prédominant pour une meilleure lisibilité
L'établissement d'un projet de mesure de l'activité de l'Agence a été fait en tenant compte de deux logiques d'analyse de l'activité : une logique de produits et une logique par missions . Dans l'approche globale, le découpage premier est celui des produits, car il correspond aux attentes des professionnels de santé, des patients et des industriels.
L'ensemble des produits de santé pour lesquels l'Agence est compétente peuvent être identifiés et classés selon une catégorie générale d'appartenance, à savoir les médicaments, les dispositifs médicaux, produits biologiques, cosmétiques, et autres produits.
Les activités opérationnelles communes aux différentes directions de l'Agence ont été regroupées autour de six activités qui définissent à la fois les missions de l'Agence et les tâches communes aux différentes directions opérationnelles de celle-ci.
Il s'agit de : l'évaluation ; la vigilance et la gestion des alertes ; le contrôle des produits ; l'inspection ; la conception de la réglementation et des normes ; l'information et la communication.
3) Un choix d'indicateurs qui repose sur un principe de lisibilité
Plusieurs critères ont servi à sélectionner les indicateurs proposés :
• Des indicateurs simples et robustes
Les indicateurs proposés peuvent être renseignés en utilisant des données disponibles et leur recueil ne nécessite pas une adaptation importante du système d'informations. Par ailleurs, la lisibilité de l'évolution des résultats nécessite que les indicateurs définis soient stables dans le temps.
• Des indicateurs pertinents
Les indicateurs retenus donnent à voir la diversité des activités de l'Agence et doivent permettre de mettre en face de celles-ci les moyens ou ressources utilisés ou à mobiliser.
L'appropriation collective des indicateurs exige un accord de l'ensemble des utilisateurs sur leur pertinence, autrement dit que ces indicateurs soient significatifs au regard des missions et de l'activité.
• Des indicateurs interprétables
Les indicateurs sont explicables, c'est-à-dire que les données détaillées sur lesquelles ils sont fondés sont accessibles et que les résultats sont commentés.
• Des indicateurs qualitatifs
Les indicateurs portent sur les flux, mais également sur les performances, au premier rang desquelles le respect des délais impartis, qui constitue un facteur d'efficacité pour la sécurité sanitaire et qui est un service rendu aux industriels. Le délai moyen ou médian présente également un intérêt.
S'agissant des médicaments, des analyses spécifiques sont possibles. Sont d'emblée proposées des analyses sur les médicaments génériques. Sont également proposées des analyses sur les médicaments issus des biotechnologies.
Les activités quantifiées ne s'arrêtent pas à la seule activité opérationnelle de sécurité sanitaire, mais comprennent également la participation à la conception de textes, ainsi que l'activité d'expertise ou de conseil technique et scientifique à la DGS sur les domaines de son champ de compétence. Les activités européennes sont parties intégrantes du travail quotidien et seront quantifiées, en distinguant les cas où l'Agence est pilote au niveau européen, de ceux où elle est simple participante.
Il n'en demeure pas moins vrai que la tâche reste à accomplir et doit mobiliser l'encadrement supérieur de l'AFSSAPS. Ce travail est indispensable à la démarche d'un contrat d'objectifs et de moyens. L'objectif est de consolider une première série d'indicateurs à l'automne 2003 mais il est tout à fait évident que la mise en place d'indicateurs validés sera progressive et bénéficiera du développement d'outils informatiques tant pour le suivi budgétaire (ADIX) que pour les ressources humaines (CIRIL), qui avaient été planifiés et qui sont en fin de réalisation.
Cette démarche, comme l'ont rappelé les tutelles lors du conseil d'administration de mai 2003, ne peut se poursuivre qu'à partir des conclusions définitives du rapport de la mission IGF/IGAS. Le contrat d'objectifs et de moyens serait donc discuté fin 2003/début 2004. Le président et le conseil d'administration doivent s'impliquer dans la préparation du contrat avec les autorités de tutelle.
Votre rapporteur estime dès lors que le nouvel examen de la loi du 1 er juillet 1998 précitée devra prendre en compte les améliorations apportées par l'Agence à son fonctionnement, suite aux conclusions de cet audit.







