C. UNE COOPÉRATION EUROPÉENNE ET INTERNATIONALE ENCORE EMBRYONNAIRE
? La coopération européenne en matière de prévention et gestion des pénuries de médicaments et de vaccins a été enclenchée à partir de la fin de l'année 2012. En dépit d'une littérature abondante et de la multiplication d'instances de concertation au niveau européen, aucune approche européenne harmonisée et coordonnée de la problématique des ruptures d'approvisionnement n'a été définitivement arrêtée à ce jour .
|
La coopération européenne en
matière de prévention
• L'EMA a publié en novembre 2012 un document de réflexion consacré aux ruptures d'approvisionnement de médicaments consécutives à des défauts de qualité et problèmes de production 65 ( * ) . Doublé d'un plan d'action à court et moyen terme 66 ( * ) , ce document a constitué le point de départ d'une série d'ateliers et de groupes de travail associant les agences européennes de sécurité du médicament et les représentants des différentes parties prenantes du secteur pharmaceutique. Un atelier de travail 67 ( * ) organisé le 14 octobre 2013 sous l'égide de l'EMA a débouché sur la création d'une cellule constituée de représentants des organisations professionnelles représentatives du secteur pharmaceutique et chargée de formuler des propositions en matière de prévention des causes de ruptures d'approvisionnement liées aux problèmes de fabrication et défauts de qualité. Le 9 octobre 2015, une réunion 68 ( * ) de ces mêmes parties prenantes au siège de l'EMA a dressé le bilan des progrès réalisés et dessiné les contours des actions à développer. • En réponse aux appels du Conseil de l'Union européenne et du Parlement européen, la Commission européenne a rendu public, à l'occasion d'une réunion technique ad hoc de son comité pharmaceutique le 25 mai 2018, un état des lieux des dispositifs mis en place par les États membres afin de garantir le respect par les fabricants et distributeurs de leurs obligations dans l'approvisionnement approprié et continu des marchés nationaux en médicaments. • Dans le cadre du plan stratégique des agences européennes du médicament pour l'horizon 2020 69 ( * ) , qui fait de la disponibilité des médicaments une priorité, l'EMA et le réseau des responsables des agences européennes de sécurité du médicament 70 ( * ) ont par ailleurs constitué une cellule dédiée (« task force ») chargée de développer et coordonner les actions de prévention et gestion des ruptures d'approvisionnement. Son comité directeur a mis en place trois groupes de travail thématiques destinés à produire une stratégie européenne dans ce domaine : - le groupe de travail n° 1 « Autorisation de mise sur le marché » est chargé de dessiner les pistes susceptibles de faciliter la mise sur le marché des médicaments dans le cadre de la réglementation actuelle ; - le groupe de travail n° 2 « Rupture d'approvisionnement » est chargé de définir les stratégies de prévention et gestion des ruptures et devrait, notamment, formuler une définition européenne de la rupture d'approvisionnement, des lignes directrices pour les entreprises pharmaceutiques dans le signalement des ruptures et pour les autorités de régulation nationales dans l'évaluation statistique des ruptures ; - le groupe de travail n° 3 « Communication » est chargé de formuler des propositions d'amélioration de l'information disponible sur les problèmes de disponibilité, tant pour les acteurs du secteur que pour les patients. Source : Agence européenne du médicament |
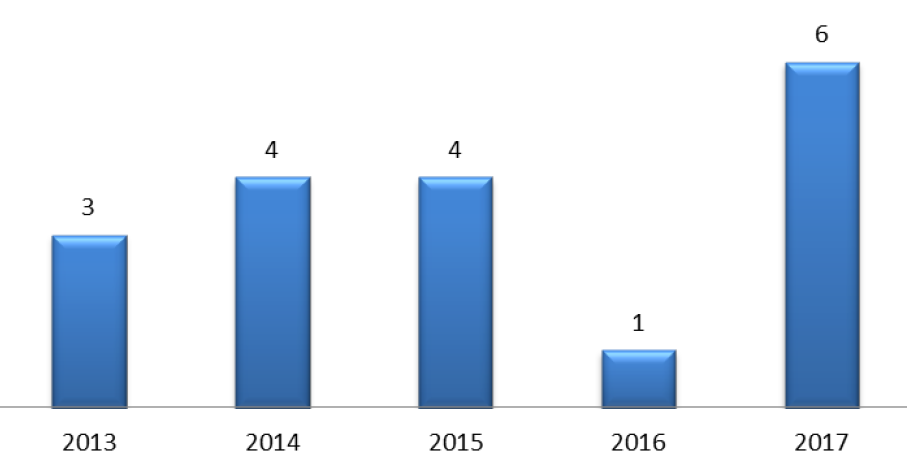
Bien que l'EMA publie sur son site Internet, depuis 2013, un catalogue des ruptures d'approvisionnement affectant les médicaments mis sur le marché dans le cadre de la procédure centralisée, cette base de données ne permet pas de disposer d'une vision complète des problèmes d'approvisionnement transeuropéens, en l'absence d'obligation pour les États membres de partager leurs informations sur les ruptures concernant des produits n'ayant pas été autorisés par l'EMA. Le nombre cumulé de ruptures identifiées par l'EMA sur la période allant de 2013 à 2017 s'établit à seulement 18 ruptures :
Ruptures de médicaments autorisées dans
le cadre
de la procédure décentralisée de l'EMA et
examinées par le CHMP
71
(
*
)
Source : Agence européenne du médicament
Les critères d'identification des médicaments à caractère essentiel, proposés par l'EMA en 2013 et actualisés en 2016 72 ( * ) , n'ont toujours pas été officialisés par l'ensemble des États membres. Selon un sondage effectué par la Commission européenne 73 ( * ) , 14 pays 74 ( * ) disposent d'une définition légale ou réglementaire des médicaments critiques ou essentiels ou font référence aux critères d'identification définis à cet effet par l'EMA ou l'OMS.
En mai 2018 75 ( * ) , la direction générale de la santé et de la sécurité alimentaire de la Commission européenne s'est employée à préciser les contours des obligations incombant aux titulaires d'AMM et aux distributeurs en gros au titre de la directive 2001/83/EC, ainsi que les limites de leurs responsabilités respectives :
- « le titulaire d'AMM est tenu de garantir un approvisionnement suffisamment à l'avance et en quantités adéquates pour couvrir la demande des patients dans un État membre. À cette fin, les titulaires d'AMM doivent assurer un approvisionnement continu qui couvre le besoin des distributeurs en gros de produits pharmaceutiques (incluant les distributeurs commercialisant une gamme complète) et les personnes habilitées à dispenser des médicaments au public. »
Les limites de leurs responsabilités sont appréciées au cas par cas par les États membres et les cas dans lesquels la responsabilité des titulaires d'AMM n'est pas en jeu peuvent inclure « les ruptures causées par l'exportation/la fourniture par un distributeur de produits pharmaceutiques destinés à un autre consommateur dans un État membre différent dont ils n'ont pas connaissance » ou encore « les ruptures causées par l'augmentation de la demande résultant d'une rupture dans un État membre d'un médicament alternatif produit par une autre entreprise » ;
- « les distributeurs en gros sont tenus de garantir l'approvisionnement continu des pharmaciens et personnes habilitées à dispenser des médicaments au public pour couvrir les besoins des patients dans le territoire où le distributeur est établi. » La responsabilité des distributeurs en gros n'est pas en jeu si « le titulaire d'AMM échoue à permettre l'approvisionnement de stocks suffisants de médicaments pour couvrir les besoins des pharmacies ou personnes habilitées à dispenser des médicaments au public dans un État membre. »
? La coopération internationale se cantonne aux accords de reconnaissance mutuelle conclus par la Commission européenne avec des pays tiers 76 ( * ) dans le domaine des inspections des sites de production des substances pharmaceutiques actives et des sites de façonnage et de conditionnement des produits finis. Un programme international d'inspection des sites de fabrication des substances pharmaceutiques actives 77 ( * ) a été institué en 2008 78 ( * ) .
Des téléconférences trimestrielles entre l'EMA et les autorités de régulation internationales, incluant la Food and Drug Administration américaine, la Therapeutic Goods Administration australienne et l'autorité canadienne Health Canada , sur le thème des ruptures d'approvisionnement liées à des défauts de qualité ou des problèmes de fabrication ont été lancées en 2013, avec pour objectif un partage d'information et de bonnes pratiques.
* 65 EMA, « Reflection paper on medicinal product supply shortages caused by manufacturing/Good
Manufacturing Practice Compliance problems », 22 novembre 2012 : http://www.ema.europa.eu/docs/en_GB/document_library/Other/2012/11/WC500135113.pdf
* 66 EMA, « Reflection paper on medicinal-product supply shortages caused by manufacturing/good-manufacturing-practice compliance problems - Implementation plan 2012-2015 », EMA/708575/2012, 23 novembre 2012 : http://www.ema.europa.eu/docs/en_GB/document_library/Other/2012/11/WC500135114.pdf
* 67 « Workshop on product shortages due to manufacturing and quality problems: Developing a proactive approach to prevention », 14 octobre 2013 : http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/events/2013/10/event_detail_000796.jsp&mid=WC0b01ac058004d5c3
* 68 « Stakeholder meeting on product shortages due to manufacturing and quality problems: developing a proactive approach to prevention », 9 octobre 2015 : http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/events/2015/07/event_detail_001179.jsp&mid=WC0b01ac058004d5c3
* 69 « EU Medicines Agencies Network Strategy to 2020 », 17 décembre 2015 : http://www.hma.eu/fileadmin/dateien/HMA_joint/02-_HMA_Strategy_Annual_Reports/08_HMA_Publications/2015_12_Adopted_EU_Medicines_Agencies_Network_Strategy_to_2020.pdf
* 70 Heads of Medicines Agencies .
* 71 Committee for Human Medicinal Products.
* 72 EMA, « Criteria for classification of critical medicinal products for human and veterinary use - Shortages due to GMP non-compliance/quality defects », EMA/24304/2016, 17 mars 2016.
* 73 Commission européenne, « Summary of Responses to the Questionnaire on the Measures implemented in the Member States territories in the context of Article 81 of Directive 2001/83/EC ».
* 74 Belgique, Allemagne, Espagne, France, Italie, Lettonie, Pays-Bas, Royaume-Uni, Slovénie, Estonie, Finlande, Malte, Norvège et Portugal.
* 75 Direction générale de la santé et de la sécurité alimentaire de la Commission européenne, document sur l'obligation d'approvisionnement continu pour traiter le problème des pénuries de médicaments, adopté par le comité technique ad-hoc sur les pénuries de médicaments au sein du comité pharmaceutique, 25 mai 2018 ( http://ec.europa.eu/health/sites/health/files/files/committee/ev_20180525_rd01_en.pdf ).
* 76 Dont les États-Unis, la Suisse, le Canada, le Japon, l'Australie, la Nouvelle-Zélande et Israël.
* 77 « International Active Pharmaceutical Ingredient Inspection Programme ».
* 78 Entre l'EMA, cinq États membres de l'Union européenne (France, Danemark, Irlande, Italie et Royaume-Uni), la direction européenne de la qualité du médicament et des soins de santé du Conseil de l'Europe, la Food and Drug Administration (FDA) américaine, la Therapeutic Goods Administration australienne, l'autorité canadienne Health Canada , la Pharmaceuticals and Medical Devices Agency japonaise et l'OMS.