B. FACE À CERTAINES PRATIQUES DONT L'IMPORTANCE RESTE À ÉTABLIR, RÉTABLIR LA CONFIANCE ENTRE LES ACTEURS DE LA CHAÎNE
La question du lien entre les indisponibilités de médicaments d'une part, et les pratiques de contingentement et d'exportation d'autre part, a suscité de vifs mouvements de défiance et de fortes interrogations lors des auditions menées par votre mission d'information. La chose n'est cependant pas nouvelle, puisqu'un rapport de l'Igas de 2014 147 ( * ) évoquait déjà « un débat tendu » à ce propos.
1. La question du contingentement des stocks attribués par les laboratoires suscite des interrogations
• Selon les grossistes-répartiteurs, les difficultés observées dans la chaîne de distribution résultent notamment des « quotas » ou « contingentements » qui auraient été mis en place par les laboratoires pharmaceutiques au début des années 2000 dans le but de mieux maîtriser l'écoulement de certains de leurs produits sur les marchés.
Ces pratiques modifient considérablement, selon la CSRP, le modèle de fonctionnement traditionnel de la répartition pharmaceutique . Les quantités de produits allouées aux grossistes sont en effet définies de manière unilatérale par les laboratoires, en fonction des parts de marché de chacun d'entre eux, évaluées au niveau national et tous médicaments confondus. Les commandes passées auprès des fabricants ne reposent donc pas sur la demande des pharmaciens d'officine, mais sur la quantité de médicaments à laquelle chaque grossiste a accès. Cette organisation tend à se répercuter sur l'ensemble de la chaîne : les pharmaciens eux-mêmes adaptent leurs commandes au rythme de livraison des laboratoires, ce qui génère des pics de commande fortement déstabilisateurs.
Selon la CSRP, les médicaments faisant l'objet de telles mesures de contingentement de la part des industriels représentent 54 % du chiffre d'affaires de la répartition pharmaceutique et près de 600 références 148 ( * ) . La moitié de ces mesures seraient à l'origine de ruptures d'approvisionnement.
• Ces pratiques sont également perçues par les pharmaciens d'officine, qui se sentent tributaires des relations parfois difficiles entre les laboratoires et les grossistes-répartiteurs.
Mme Alexandra Lèche, entendue lors de l'audition des représentants de la pharmacie rurale, a ainsi estimé que certaines indisponibilités de médicaments pouvaient être liées à la pratique des quotas - qui explique que certaines commandes puissent être honorées directement par les laboratoires, tandis que les grossistes-répartiteurs ne sont pas en mesure d'y satisfaire.
Dans ce contexte, les grossistes et les fabricants tendent à se renvoyer la responsabilité des ruptures. Les questions posées lors des auditions des pharmaciens d'officine ont témoigné de l'incompréhension qui règne entre les acteurs de la distribution pharmaceutiques : « est-ce parce que les grossistes [...] restent contraints par les laboratoires qui ne souhaitent pas que leurs médicaments soient revendus ailleurs en Europe ? Quoi qu'il en soit, c'est le patient qui trinque. »
• Le phénomène a été objectivé par le rapport de l'Igas précité, qui explique son développement par le fait que « les laboratoires acceptent difficilement la concurrence des autres acteurs 149 ( * ) qui achètent, à un prix négocié pour le marché français, des produits qu'ils revendent dans un autre État où les prix sont plus élevés . [...] Disposant en général d'une filiale dans le pays importateur, les laboratoires y voient une concurrence déloyale et cherchent à limiter la capacité d'export de ces intermédiaires ».
Le même rapport précise que le contingent imposé par le laboratoire correspond généralement à la part de marché du grossiste-répartiteur majorée de 10 à 20 %.
• Cette pratique de contingentement a été validée par la jurisprudence : la décision n° 07-D-22 du 5 juillet 2007 du Conseil de la concurrence admet que les laboratoires pharmaceutiques puissent mettre en oeuvre un système de contingentement « à la condition que les restrictions induites par cette régulation soient limitées à ce qui est strictement nécessaire à un approvisionnement fiable et optimal du marché » .
• Votre mission d'information souligne que cette pratique, en plus de contribuer - dans une mesure cependant difficile à évaluer dans le cadre contraint de ses travaux - à la formation de difficultés d'approvisionnement, entretient un climat de tension entre les acteurs de la chaîne de distribution, qui ne favorise pas leur bonne coopération. Il lui apparaît a minima nécessaire de mieux contrôler le respect des obligations définies par la jurisprudence de l'Autorité de la concurrence.
Elle propose de confier à l'ANSM le soin d'évaluer chaque année, pour un échantillon aléatoire de médicaments déclarés en « rupture quota fournisseur », les modalités de répartition des stocks correspondants par les industriels. En effet, aux termes de l'article R. 5124-48-1 du code de la santé publique, « l'entreprise pharmaceutique exploitant des médicaments assure un approvisionnement approprié et continu de tous les établissements autorisés au titre d'une activité de grossiste-répartiteur [...] afin de permettre à ces derniers de remplir les obligations prévues à l'article R. 5124-59 et de manière à couvrir les besoins des patients en France. »
Par conséquent, tout manquement constaté de la part des laboratoires dans leur obligation d'approvisionner le marché français de façon appropriée et continue, notamment en ne permettant pas aux grossistes-répartiteurs d'assurer leurs obligations de service public, devra être financièrement sanctionné .
|
Proposition n° 16 : Confier à l'ANSM le soin d'évaluer les modalités de la répartition de leurs stocks par les laboratoires entre les grossistes-répartiteurs, et sanctionner financièrement tous les industriels qui n'assureraient pas un approvisionnement approprié et continu du marché français en médicaments essentiels. |
2. Les exportations parallèles, une question épineuse à objectiver
a) Une pratique encadrée par la loi
Les différentiels de prix de remboursement entre États membres peuvent conduire certains distributeurs à acheter des médicaments sur des marchés aux prix pharmaceutiques les plus bas afin de les revendre sur des marchés plus rémunérateurs , le prix à l'exportation étant libre.
Ces exportations, qualifiées de « parallèles » dès lors qu'elles sont organisées par des opérateurs s'écartant des réseaux de distribution mis en place directement par les fabricants de médicaments, sont considérées comme légales au regard du droit communautaire car compatibles avec le principe de libre circulation des marchandises.
Bien que les exportations effectuées depuis la France par les grossistes-répartiteurs ne soient pas contrôlées a priori , la réforme introduite par la loi du 26 janvier 2016 interdit de facto toute exportation de médicaments figurant sur la liste des MITM en rupture ou tension d'approvisionnement sur le site de l'ANSM .
b) Une importance limitée sur le marché français du médicament
• Jusqu'en 2010, les États membres les plus affectés par le poids des exportations parallèles étaient essentiellement les pays du Sud de l'Europe, aux prix de remboursement les plus bas : l'Espagne, le Portugal, la Grèce et, dans une moindre mesure, l'Italie et la France.
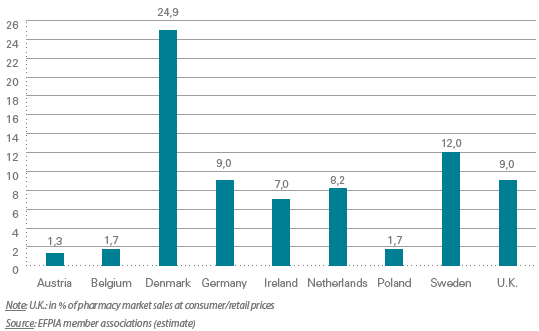
Une étude de la fédération européenne des industries et associations pharmaceutiques (EFPIA) de 2017 a mis en avant l'importance des importations parallèles de médicaments dans l'approvisionnement de marchés européens identifiés comme particulièrement attractifs : le Danemark, qui prend en compte le prix des produits issus du commerce parallèle dans la fixation de ses prix de remboursement, la Suède dont le marché pharmaceutique comporte 15 % de produits importés d'autres pays européens, et l'Allemagne qui impose à ses pharmaciens d'intégrer au moins 5 % de produits issus d'importations parallèles dans leurs ventes trimestrielles 150 ( * ) .
Part des importations parallèles dans le
marché
des ventes pharmaceutiques pour neuf pays
européens
Source : L'industrie pharmaceutique en chiffres - Données clés, rapport de la Fédération européenne des industries et associations pharmaceutiques (EFPIA), 2017
Durement affectés par l'exportation de médicaments acquis sur leurs marchés, l'Espagne, le Portugal, l'Italie et la Slovaquie ont pris des mesures afin d'y remédier, notamment par la mise en place de systèmes de déclaration ou d'autorisation préalables.
• Deux éléments conduisent à relativiser l'impact des exportations parallèles de médicaments sur le marché français .
En premier lieu, l'activité d'exportation des grossistes-répartiteurs semble désormais limitée dans son ampleur : elle oscille généralement entre 1,5 % et 3 % de leur chiffre d'affaires, la moyenne se situant à 2 %. Toutes les organisations de grossistes-répartiteurs interrogées par votre mission d'information assurent n'exporter que lorsqu'elles sont sûres de pouvoir honorer les demandes de leurs clients en France.
En second lieu, les hôpitaux sont régulièrement exposés à des tensions d'approvisionnement, alors que seulement 5 % des commandes des grossistes-répartiteurs sont destinées aux hôpitaux.
|
Le contrôle des exportations parallèles en France Les agences régionales de santé (ARS) procèdent à des inspections des établissements pharmaceutiques de distribution en gros de médicaments à usage humain 151 ( * ) dans le cadre des orientations nationales de contrôle du ministère de la santé. Un certain nombre de dérives ont été constatées au cours des dernières années. En particulier, une catégorie de grossistes-répartiteurs, dénommés « short liners » 152 ( * ) , ne détiennent pas physiquement en stock et sciemment la collection requise et acquièrent des stocks pour un assortiment très limité de spécialités, sous couvert de leur autorisation d'ouverture. Ils les revendent ensuite à d'autres distributeurs en gros, notamment au sein de l'Union européenne. Ils réduisent ainsi les stocks destinés aux patients français et augmentent le risque de ruptures. Ces entreprises ne répondent pas, ou seulement partiellement, à leurs obligations de service public. Devant ces dérives, l'ANSM a pris, en lien avec les ARS, des mesures destinées à prévenir ces comportements incompatibles avec les obligations de service public incombant aux grossistes-répartiteurs : - une vigilance renforcée sur la qualité et la complétude des dossiers soumis dans le cadre de la demande d'ouverture de l'établissement ; - la publication sur le site Internet de l'ANSM d'un avis aux pharmaciens responsables des grossistes-répartiteurs qui précise les modalités d'ouverture effective et de démarrage des opérations de distribution ; - la systématisation d'une inspection menée dans l'établissement durant l'année suivant l'ouverture effective, au cours de laquelle est notamment vérifiée la mise en oeuvre des engagements pris par le pharmacien responsable au moment de la demande d'ouverture ; - la prise de sanctions financières. Ainsi, depuis janvier 2018, deux sanctions financières ont été prononcées pour non-respect des obligations de service public, pour des montants respectifs de 85 000 € à 149 000 € ; - le cas échéant, des plaintes au Conseil national de l'ordre des pharmaciens à l'encontre des pharmaciens responsables des établissements concernés. Source : Agence nationale de sécurité du médicament et des produits de santé |
c) Renforcer l'évaluation et le contrôle des exportations parallèles
• Votre mission d'information préconise tout d'abord de renforcer le contrôle des plannings d'exportation des grossistes-répartiteurs, en particulier des « short liners » .
|
La problématique des grossistes « short liners » Extrait du rapport n° 2014-004R3 de l'Igas, La distribution en gros du médicament en ville , juin 2014 : « Une vingtaine d'établissements dits short liners ayant le statut de grossistes-répartiteurs ne répondent pas aux obligations de service public. Ils ne proposent qu'une courte gamme de médicaments, la plus rentable, à un nombre réduit d'officines auxquelles ils vendent de grandes quantités quand ils ne travaillent pas uniquement à l'export. Ils sont désignés comme short liners par opposition aux full liners qui assurent la répartition en distribuant une large gamme de médicaments. L'ANSM, en partenariat avec les ARS, ordonne leur fermeture lorsqu'il est prouvé qu'ils n'ont pas de clients officinaux. Pour la mission, il est important de fermer les grossistes-répartiteurs qui ne se conforment pas aux obligations de service public. Il apparaît que la difficulté de l'ANSM et de l'ARS ne réside pas tant dans l'absence de moyens juridiques permettant de sanctionner les short liners que dans l'impossibilité d'empêcher l'ouverture de nouvelles entreprises. » |
|
Proposition n° 17 : Renforcer les contrôles par l'ANSM et les ARS des plannings d'exportations des grossistes-répartiteurs, notamment pour prévenir les comportements des « short liners » non-conformes aux obligations de service public des grossistes, et publier les sanctions des manquements constatés. |
• La mise en place d'un répertoire français des numéros de série unique des médicaments, dans le cadre de la mise en oeuvre de la sérialisation, devrait permettre de localiser une boîte de médicament à chaque étape de sa distribution et de quantifier ainsi le volume des ventes de médicaments sous prescription et sa répartition en Europe à partir des données centralisées au niveau du « hub » de données européen auquel seront connectés tous les répertoires nationaux.
Les autorités nationales compétentes étant chargées d'inspecter le bon fonctionnement de ce système de traçabilité, votre mission d'information estime pertinent pour l'ANSM d'examiner les données qui y seront saisies afin d'évaluer les volumes de médicaments répartis par les titulaires d'AMM et distribués par les grossistes-répartiteurs. L'analyse de ces données permettrait de quantifier l'impact des activités d'exportation sur l'approvisionnement du marché français.
À cet égard, la réglementation tchèque apporte un éclairage sur l'utilité d'une transparence accrue des volumes de ventes de médicaments réalisées sur un marché. Le dispositif mis en place par la République tchèque impose aux titulaires d'AMM de transmettre aux autorités nationales compétentes toutes les données disponibles relatives au volume de médicaments vendus et prescrits sur le territoire 153 ( * ) .
|
Proposition n° 18 : Permettre à l'ANSM de consulter les données du futur répertoire français des numéros de série uniques des médicaments afin d'évaluer l'impact des exportations sur l'approvisionnement du marché français. |
3. Mieux évaluer et sanctionner les comportements perçus comme spéculatifs
Au-delà de ces pratiques particulières, le climat général de défiance qui semble régner au sein de la chaîne de distribution conduit votre mission d'information à préconiser de faire toute la transparence sur les pratiques perçues comme spéculatives de la part des différents acteurs . Le cas échéant, les manquements constatés aux obligations permettant l'approvisionnement approprié et continu du marché français devront faire l'objet de sanctions. Et, en tout état de cause, une transparence accrue sur certains comportements prédateurs ne pourra qu'inciter les acteurs concernés à faire preuve de davantage de responsabilité face aux risques de pénurie.
Elle rappelle que l'Autorité de la concurrence s'est saisie d'office, le 20 novembre dernier, d'une enquête sectorielle sur les secteurs du médicament et de la biologie médicale. L'avis qui sera rendu devrait la conduire à formuler des recommandations « visant, d'une part, à assouplir les contraintes réglementaires qui restreignent le jeu de la concurrence dans la distribution du médicament et, d'autre part, à analyser les mécanismes de régulation et de fixation des prix, compte tenu des nouveaux enjeux auxquels le secteur est confronté. ». Votre mission d'information estime que ces travaux devront inclure l'examen des pratiques pouvant aboutir à créer des indisponibilités de médicaments sur le marché français.
L'Autorité européenne du médicament pourrait dans le même temps être encouragée à procéder à une évaluation de pratiques semblables qui pourraient être constatées à l'échelle européenne.
|
Proposition n° 19 : Encourager l'Autorité de la concurrence française et l'agence européenne du médicament (EMA) à contrôler les pratiques spéculatives constatées dans la chaîne de distribution du médicament. |
* 147 La distribution en gros du médicament en ville, rapport de l'Igas de juin 2014.
* 148 Ces données s'entendent exclusion faite des médicaments génériques.
* 149 Les médicaments peuvent être exportés par les fabricants, par les grossistes-répartiteurs qui disposent d'une autorisation d'export ou par des exportateurs en gros, autorisés spécifiquement par l'ANSM. En revanche, les officines ne peuvent pas exporter.
* 150 EFPIA, « Policy proposals to minimise medicine supply shortages in Europe » : http://www.efpia.eu/uploads/Modules/Documents/pac-280214-ai6-a2-shortagesposition-paper-final.pdf
* 151 Qui comprennent les grossistes-répartiteurs, les dépositaires exclusifs, les centrales d'achats pharmaceutiques, les distributeurs en gros à l'exportation ou encore les distributeurs en gros de gaz à usage médical.
* 152 Par opposition aux « full liners » qui disposent de toute la collection de spécialités.
* 153 EFPIA, « Policy proposals to minimize medicine supply shortages in Europe », 28 février 2014.