2. Retarder ou pallier les conséquences néfastes liées à l'obésité
a) Augmenter la satiété
La prise en charge des obèses est rendue difficile en l'absence de traitement leur permettant de perdre du poids durablement.
Jusqu'à présent, les médicaments proposés visaient à agir sur la satiété au niveau du système nerveux central.
La meilleure connaissance des interrelations entre le tube digestif et le cerveau dans la régulation de la satiété laisse entrevoir des pistes prometteuses pour la prise en charge des patients obèses.
Les hormones entéro-digestives sont une première voie de recherche. Ainsi, le GLP1, sécrété par les cellules L du tube digestif, stimule la sécrétion d'insuline. Deux analogues du GLP1 sont déjà utilisés dans le traitement du diabète. Des expérimentations sont en cours afin de vérifier leur efficacité sur le long terme pour aider les patients à maigrir.
Deux autres hormones sécrétées par le tube digestif, l'oxyntomoduline et le peptide PP, apparaissent également intéressantes. Des essais ont montré qu'elles diminuent la prise alimentaire et qu'elles peuvent, à court terme et sur des personnes non obèses, entraîner une perte de poids. Des tests complémentaires doivent donc évaluer leur action sur le long terme et sur les personnes obèses. En outre, elles ont des demi-vies très courtes. Pour pouvoir les utiliser, il faudra développer des analogues à demi-vies plus longues.
A moyen terme, deux voies de recherche pour augmenter la satiété apparaissent prometteuses :
- la régulation de la néoglucogénèse intestinale et de ses relais vagaux : il semblerait en effet que la modulation de la néoglycogénèse intestinale, permettrait de moduler la satiété ;
- le rôle du microbiote intestinal et sa régulation par les prébiotiques qui pourraient déboucher sur la mise au point d'ingrédients à action prébiotique agissant sur la satiété.
b) Dépister les sujets à risque de développer une obésité abdominale
Le développement de l'obésité abdominale se caractérise par une augmentation de la graisse viscérale et de dépôt ectopique de la graisse. Il est associé à une augmentation du risque de diabète et de maladies cardiovasculaires.
Au cours d'expérience de surnutrition chez l'homme, Martine Laville et Hubert Vidal ont montré la variabilité entre les sujets du développement de la graisse viscérale. La propension à développer le tissu viscéral viendrait d'une incapacité du tissu adipeux sous-cutané à se développer et à servir de tampon. Les défauts de ce tissu sont en cours de caractérisation. L'objectif recherché est de pouvoir, à moyen terme, développer des biomarqueurs capables de dépister les sujets à risque de développer une obésité abdominale à travers l'analyse de leur tissu adipeux.
c) Retarder l'apparition du diabète de type 2 et diminuer le risque cardio-vasculaire.
Le diabète de type 2, qui représente 90 % des diabètes, est caractérisé par un excès de sucre dans le sang (hyperglycémie) associé à un excès d'insuline (hyperinsulinémie). Il est précédé par l'établissement d'un état de résistance à l'action de l'insuline (insulino-résistance).
A la recherche de cibles thérapeutiques dans le tissu adipeux, une équipe du Centre de Recherche des Cordeliers a mis en évidence une enzyme à activité protéasique, la Cathepsine S impliquée dans les maladies cardiovasculaires et qui est beaucoup plus présente dans le tissu adipeux des personnes obèses. Plusieurs données expérimentales et cliniques suggèrent que l'inhibition de la Cathepsine S aurait un effet bénéfique aussi bien au niveau des vaisseaux que dans l'occurrence du diabète de type 2. A la suite de ces observations, l'équipe se consacre maintenant à l'analyse des mécanismes moléculaires impliqués et à la recherche d'agents pharmacologiques inhibant l'activité de cette enzyme.
Si cette piste de recherche aboutissait, il serait alors possible d'agir en amont pour retarder l'apparition du diabète de type 2 chez le sujet obèse. En effet, il n'existe actuellement des traitements efficaces qu'une fois que le diabète de type 2 est établi.
Les cibles au niveau du tissu adipeux sont intéressantes. Elles représentent de nouvelles voies thérapeutiques alternatives permettant de compenser les échecs au niveau du contrôle de la prise alimentaire.
d) Régénérer les cellules du pancréas
Le diabète de type 1 est caractérisé par un excès de glucose dans le sang (hyperglycémie), dû à l'insuffisance de production par le pancréas d'une hormone, l'insuline.
Il s'agit d'une maladie auto-immune aboutissant à la destruction des cellules bêta pancréatiques.
Actuellement, les patients diabétiques de type 1 peuvent être soignés par l'injection d'insuline, mais ils ne peuvent pas être guéris.
Néanmoins, de nouvelles approches sont avancées pour guérir les patients diabétiques de type 1 qui pourraient être basées sur des thérapies de type cellulaire ou régénératif.
La thérapie cellulaire consiste par exemple à effectuer une greffe de cellules à insuline obtenues ex vivo à partir de cellules souches pour pallier les défaillances de ces cellules bêta.
La thérapie régénératrice consiste à stimuler in vivo les capacités de régénération de cellules bêta fonctionnelles.
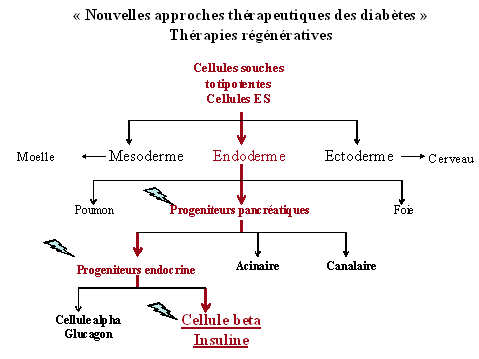
Source : Raphael Scharfmann
Toutefois, ces approches nécessitent une connaissance parfaite des mécanismes régulant le développement physiologique des cellules bêta.
Les cellules bêta se développent à partir de progéniteurs pancréatiques d'origine endodermale qui vont proliférer puis se différencier en cellules bêta produisant de l'insuline. Ce processus de développement est complexe et régulé de manière précise. Théoriquement, il est possible d'activer le développement des cellules bêta de trois manières :
- en activant la prolifération des progéniteurs ;
- en activant leur différenciation en cellules bêta ;
- en activant la prolifération des cellules bêta matures.
Néanmoins, afin de définir de nouvelles molécules qui augmentent le développement de cellules bêta fonctionnelles à partir de progéniteurs, il faut auparavant développer de nouveaux outils et bio-essais qui permettent chez le rongeur et chez l'homme de caractériser des signaux qui activent le développement des cellules bêta.
Une véritable course contre la montre est par exemple engagée entre de nombreuses équipes de recherche qui tentent d'augmenter la prolifération, et donc le nombre de cellules bêta fonctionnelles.
Selon Raphael Scharfmann, directeur de l'équipe « Développement normal et pathologique des organes endocrines » au Centre de recherche croissance et signalisation (Inserm U845), ces recherches devraient avoir des répercussions thérapeutiques d'ici 15 ans.







