II. RENFORCER LA SÉCURITÉ DES PRODUITS DE SANTÉ
Il convient de reconnaître que le projet de loi cherche à maintenir l'équilibre existant. Il reste cependant trop souvent au niveau des symboles.
A. TROUVER L'ÉQUILIBRE ENTRE ACCÈS AUX THÉRAPIES ET SÉCURITÉ
Ainsi que le soulignent à juste titre les associations de patients, la mise en oeuvre de la sécurité sanitaire ne doit pas aboutir à une perte de chance pour les patients. Un médicament nocif en population générale peut avoir un effet positif pour certains malades dans le cadre d'un usage contrôlé. C'est le cas du thalidomide, dont les effets secondaires dramatiques pour les femmes enceintes et leurs enfants ont, on l'a été rappelé, provoqué le premier scandale sanitaire européen et qui a cependant fait l'objet de plusieurs autorisations temporaires d'autorisations depuis 1997 16 ( * ) . Depuis 2009, il fait en effet l'objet d'une indication pour le traitement de première ligne des patients âgés de plus de soixante-cinq ans présentant un myélome multiple non traité ou présentant une contre-indication à la chimiothérapie à haute dose.
Personne ne saurait contester la nécessité de préserver l'accès aux traitements les plus adaptés et les plus innovants. Il convient cependant que les autorités sanitaires se mettent en capacité d'anticiper les risques futurs liés aux produits de santé autres que le médicament.
1. Ne pas faire perdre de chances aux malades
A côté de la procédure de mise sur le marché, qui répond aux sollicitations des laboratoires dans le cadre de leur logique commerciale, des dérogations ont toujours existé pour permettre la diffusion de médicaments non ou non encore autorisés aux patients pour lesquels ils présentent un intérêt thérapeutique majeur. Ces demandes émanant des médecins souvent spécialistes de maladie rares ou de pathologies particulièrement sévères visent à faire profiter leurs patients au plus vite des avancées de la science. Plusieurs mécanismes permettent de leur apporter une réponse.
L'article L. 5121-12 du code de la santé publique dispose que l'Afssaps peut délivrer, à titre exceptionnel, des autorisations temporaires d'utilisation ATU pour des médicaments ne disposant pas d'AMM centralisée ou nationale et destinés à traiter des maladies graves ou rares lorsqu'il n'existe pas de traitement approprié.
Deux types d'ATU sont à distinguer.
L'ATU de cohorte doit être demandée par le titulaire des droits d'exploitation pour un groupe de patients lorsque l'efficacité et la sécurité du médicament sont fortement présumées au regard des résultats des essais thérapeutiques auxquels il a été procédé en vue d'une demande d'AMM. Le titulaire des droits d'exploitation doit avoir déposé une demande d'AMM ou s'engager à le faire dans un délai déterminé. Il conclut également avec l'Afssaps un protocole d'utilisation thérapeutique et de recueil d'informations.
L'ATU nominative peut être accordée pour un patient déterminé, à la demande et sous la responsabilité du médecin, lorsque le médicament est susceptible de présenter un bénéfice pour le patient et que soit son efficacité et sa sécurité sont présumées en l'état des connaissances scientifiques, soit une issue fatale pour le patient est, en l'état des thérapeutiques disponibles, inéluctable. L'ATU nominative suppose une information adaptée du patient ou de son représentant légal et peut être subordonnée par l'Afssaps à la conclusion d'un protocole d'utilisation thérapeutique et de recueil d'informations.
Si l'article L. 5121-12 dispose en son quatrième alinéa que les ATU sont attribuées pour une durée limitée, la partie réglementaire du code de la santé publique précise que les ATU de cohorte sont délivrées pour une année et les ATU nominatives pour la durée du traitement, dans la limite maximale d'un an. Les deux types d'autorisation peuvent être renouvelés à l'issue de ces délais 17 ( * ) . L'Afssaps a le pouvoir de suspendre ou retirer l'ATU si les conditions prévues à l'article L. 5121-12 ne sont plus remplies ou pour des motifs de santé publique.
Le coût des médicaments sous ATU est libre et entièrement pris en charge par l'assurance maladie. L'article L. 162-16-5-1 du code de la sécurité sociale oblige le laboratoire titulaire des droits d'exploitation à déclarer au Comité économique des produits de santé (Ceps) le montant de l'indemnité demandée auprès des établissements de santé pour le médicament sous ATU. Si, dans le cadre d'une AMM ultérieure, le Ceps fixe un prix ou un tarif de remboursement inférieur au prix déclaré, le laboratoire doit reverser tout ou partie de la différence aux organismes de recouvrement. L'indemnité est ensuite affectée aux régimes d'assurance maladie.
Les ATU sont le plus souvent délivrées pour :
- des médicaments anciens bénéficiant généralement d'une AMM à l'étranger mais pour lesquels aucune demande n'a été déposée en France en raison d'un marché jugé insuffisamment rentable par le titulaire de l'autorisation ;
- des médicaments en cours de développement, avec un projet de dépôt d'AMM ;
- des médicaments en cours d'évaluation d'AMM, le plus souvent en procédure centralisée ;
- des médicaments pour lesquels l'ATU permet de pallier une suspension, un retrait ou un refus d'AMM, un arrêt de commercialisation ou l'impossibilité d'inclure les patients dans les essais cliniques.
Les données chiffrées présentées ci-dessous sont révélatrices de la diversité des situations que recouvrent les deux types d'ATU. Alors que les ATU de cohorte sont, de façon générale et de plus en plus, attribuées pour une durée limitée, en vue d'une AMM future, les ATU nominatives sont souvent accordées pour des durées très longues. En 2009, seuls 9 % des médicaments disponibles en ATU nominatives ont obtenu une AMM.
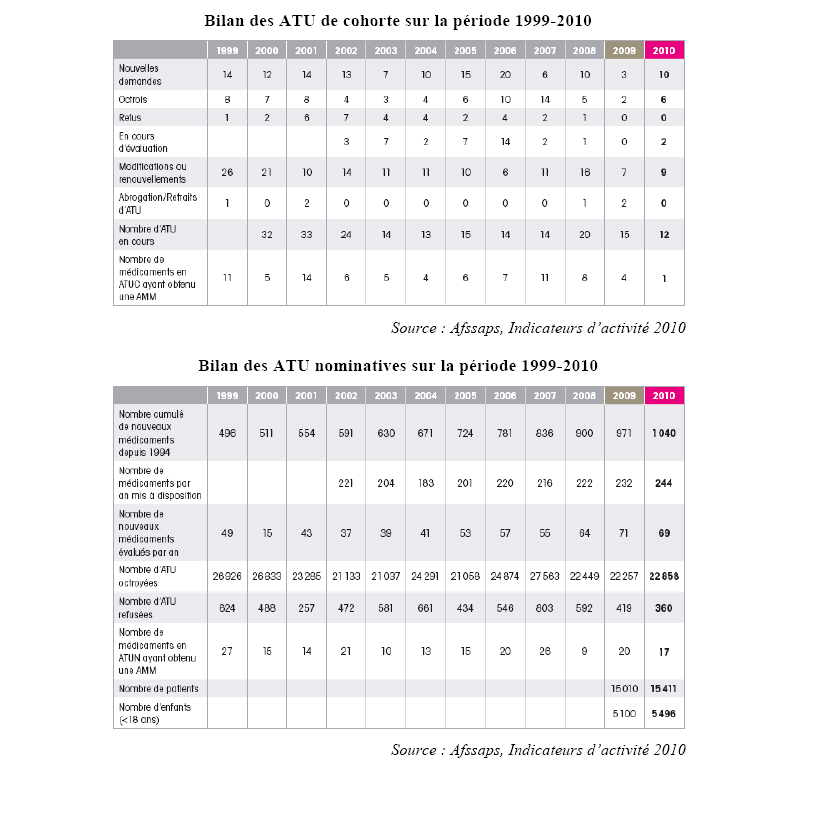
Il résulte de ces éléments, comme l'a souligné le directeur général de l'Afssaps à votre rapporteur, qu'une clarification des conditions dans lesquelles sont accordées les ATU nominatives est nécessaire. En effet, l'intérêt collectif étant que tous les patients puissent bénéficier le plus rapidement possible des innovations thérapeutiques, la transformation des ATU nominatives en ATU de cohorte et de celles-ci en AMM doit être encouragée. Il n'est en tous cas pas souhaitable que perdure la tendance actuelle de pérennisation de fait du régime des ATU.
* 16 Bilan de l'expérience du thalidomide dans le cadre des ATU. Février 1997/Février 2009, www.afssaps.fr.
* 17 Articles R. 5121-72 à R. 5121-74 du code de la santé publique.







