Rapport n° 30 (2004-2005) de M. Jean BIZET , fait au nom de la commission des affaires économiques, déposé le 19 octobre 2004
Disponible au format Acrobat (568 Koctets)
Tableau comparatif au format Acrobat (76 Koctets)
-
EXPOSÉ GÉNÉRAL
-
I. LA TRANSPOSITION DE LA DIRECTIVE 98/44
RÉPOND AUTANT À UN IMPÉRATIF ÉCONOMIQUE QUE
JURIDIQUE
-
A. LA NON TRANSPOSITION DE LA DIRECTIVE 98/44 EST
UNE DES CAUSES DU RETARD EUROPÉEN DANS LES BIOTECHNOLOGIES
-
B. LA TRANSPOSITION DE LA DIRECTIVE EST DEVENUE UN
IMPÉRATIF JURIDIQUE DEPUIS LA CONDAMNATION DE LA FRANCE PAR LA COUR DE
JUSTICE DES COMMUNAUTÉS EUROPÉENNES
-
A. LA NON TRANSPOSITION DE LA DIRECTIVE 98/44 EST
UNE DES CAUSES DU RETARD EUROPÉEN DANS LES BIOTECHNOLOGIES
-
II. UN PROJET DE LOI DE TRANSPOSITION CONSENSUEL
DANS UN CADRE ÉTHIQUE CONSOLIDÉ
-
A. LA TRANSPOSITION DE LA DIRECTIVE S'INSCRIT DANS
UN CADRE ÉTHIQUE CONSOLIDÉ
-
B. LE TEXTE SOUMIS À VOTRE COMMISSION SE
PRÉSENTE COMME CONSENSUEL, CE QUI N'EXCLUT PAS DE
L'AMÉLIORER
-
A. LA TRANSPOSITION DE LA DIRECTIVE S'INSCRIT DANS
UN CADRE ÉTHIQUE CONSOLIDÉ
-
I. LA TRANSPOSITION DE LA DIRECTIVE 98/44
RÉPOND AUTANT À UN IMPÉRATIF ÉCONOMIQUE QUE
JURIDIQUE
-
EXAMEN DES ARTICLES
-
Article 1er -
Brevetabilité de la matière biologique
-
Article 2 -
Principes limitant le champ de la brevetabilité de la matière biologique
-
Article 3 -
Limites de la brevetabilité en matière animale et végétale
-
Article 4 -
Obligation de dépôt de matière biologique pour obtenir un brevet
-
Article 5 -
Coordination
-
Article 6 -
Etendue de la protection garantie par le brevet
-
Article 7 -
Dérogations à la protection garantie par le brevet : privilèges de l'agriculteur et de l'éleveur
-
Article 8 -
Licences obligatoires en cas de dépendance d'une obtention végétale à l'égard d'un brevet
-
Article 9 -
Licences obligatoires en cas de dépendance d'un brevet à l'égard d'une obtention végétale
-
Article 1er -
-
TITRE II -
DISPOSITIONS RELATIVES AU RENFORCEMENT
DES LICENCES OBLIGATOIRES
ET DES LICENCES D'OFFICE
-
ANNEXE I -
EXTRAIT DE LA LOI N° 2004-800 DU 6 AOÛT 2004
RELATIVE À LA BIOÉTHIQUE
-
ANNEXE II -
DIRECTIVE 98/44/CE DU PARLEMENT EUROPÉEN ET DU CONSEIL DU 6 JUILLET 1998 RELATIVE À LA PROTECTION JURIDIQUE DES INVENTIONS BIOTECHNOLOGIQUES
-
ANNEXE III -
LISTE DES PERSONNES AUDITIONNÉES
PAR LE RAPPORTEUR
N° 30
SÉNAT
SESSION ORDINAIRE DE 2004-2005
Annexe au procès-verbal de la séance du 19 octobre 2004
RAPPORT
FAIT
au nom de la commission des Affaires économiques et du Plan (1) sur le projet de loi relatif à la protection des inventions biotechnologiques ,
Par M. Jean BIZET,
Sénateur
(1) Cette commission est composée de : M. Jean-Paul Émorine, président ; MM. Jean-Marc Pastor, Gérard César, Bernard Piras, Gérard Cornu, Marcel Deneux, Pierre Hérisson, vice-présidents ; MM. Gérard Le Cam, François Fortassin, Dominique Braye, Bernard Dussaut, Christian Gaudin, Jean Pépin, Bruno Sido, secrétaires ; MM. Jean-Paul Alduy, Pierre André, Gérard Bailly, René Beaumont, Michel Bécot, Jean Besson, Joël Billard, Michel Billout, Claude Biwer, Jean Bizet, Jean Boyer, Mme Yolande Boyer, MM. Jean-Pierre Caffet, Yves Coquelle, Roland Courteau, Philippe Darniche, Gérard Delfau, Mme Michelle Demessine, MM. Marcel Deneux, Jean Desessard, Mme Evelyne Didier, MM. Philippe Dominati, Michel Doublet, Daniel Dubois, André Ferrand, Alain Fouché, François Gerbaud, Alain Gérard, Charles Ginésy, Georges Ginoux, Adrien Giraud, Mme Adeline Gousseau, MM. Francis Grignon, Louis Grillot, Georges Gruillot, Mme Odette Herviaux, M. Michel Houel, Mmes Sandrine Hurel, Bariza Khiari, M. Yves Krattinger, Mme Elisabeth Lamure, MM. Jean-François Le Grand, André Lejeune, Philippe Leroy, Claude Lise, Daniel Marsin, Jean-Claude Merceron, Dominique Mortemousque, Paul Natali, Ladislas Poniatowski, Daniel Raoul, Paul Raoult, Daniel Reiner, Thierry Repentin, Bruno Retailleau, Charles Revet, Henri Revol, Roland Ries, Claude Saunier, Daniel Soulage, Michel Teston, Yannick Texier, Pierre-Yvon Trémel, Jean-Pierre Vial.
Voir le numéro :
Sénat : 55 (2001-2002)
|
Propriété intellectuelle. |
EXPOSÉ GÉNÉRAL
Mesdames, Messieurs,
Près de trois ans après son dépôt et plus de quatre ans après l'échéance fixée par nos obligations communautaires, ce projet de loi est enfin soumis à l'examen du Parlement.
Il assure la transposition en droit national de la directive communautaire 98/44/CE du Parlement européen et du Conseil du 6 juillet 1998 relative à la protection juridique des inventions biotechnologiques.
Ou, plutôt, il parachève cette transposition, plusieurs fois reportée, et déjà entamée par la loi n°2004-800 du 6 août 2004 relative à la bioéthique.
Sans revenir sur les multiples événements qui ont jalonné l'histoire de cette transposition difficile, qui seront présentés plus loin, votre rapporteur se félicite de l'aboutissement prochain de ce processus.
Il a déjà abondamment présenté les multiples enjeux de l'industrie des biotechnologies pour l'Europe dans le rapport d'information 1 ( * ) que votre commission a adopté l'an passé : un enjeu pour une agriculture indépendante, innovante et durable ; un enjeu stratégique pour une économie de la connaissance, mais également un enjeu commercial international.
Dans ce rapport, votre commission déplorait particulièrement les risques auxquels l'Europe s'exposait en ne prenant pas la mesure de l'enjeu biotechnologique : dépendance à l'égard des détenteurs étrangers de procédés ou produits protégés par la propriété intellectuelle, fuite des cerveaux, appauvrissement des capacités de croissance de notre continent. Elle concluait en ces termes : « le comblement du fossé technologique croissant entre l'Europe et les Etats-Unis, particulièrement dans le domaine des biotechnologies, apparaît comme le pilier géostratégique de la place qu'occupera l'Europe dans le monde du XXIème siècle. »
C'est pourquoi cette transposition de la directive protégeant les inventions biotechnologiques est la bienvenue pour votre commission.
Votre rapporteur aurait certes préféré faire d'une pierre deux coups et transposer par la même occasion l'autre directive communautaire en souffrance, la 2001/18, relative à la dissémination des OGM dans l'environnement. Mais il espère obtenir l'assurance que le Gouvernement ne tardera pas à soumettre à cette fin un prochain projet de loi au Parlement afin de compléter le cadre législatif qui permettra un véritable essor de l'industrie des biotechnologies en Europe.
Le présent projet de loi de transposition de la directive 98/44 répond à la fois aux impératifs économiques (IA), juridiques (IB) tout en intégrant des préoccupations éthiques (II).
I. LA TRANSPOSITION DE LA DIRECTIVE 98/44 RÉPOND AUTANT À UN IMPÉRATIF ÉCONOMIQUE QUE JURIDIQUE
A. LA NON TRANSPOSITION DE LA DIRECTIVE 98/44 EST UNE DES CAUSES DU RETARD EUROPÉEN DANS LES BIOTECHNOLOGIES
1. Le retard européen dans le secteur stratégique des biotechnologies tient largement aux difficultés de financement
a) Les biotechnologies constituent un secteur stratégique pour l'économie européenne d'aujourd'hui et de demain
Le secteur des biotechnologies recouvre une grande diversité d'activités que l'OCDE définit comme « l'ensemble des applications des sciences et technologies utilisant des matières biologiques, vivantes ou mortes pour produire de la connaissance, des aliments ou des services ».
Au sein de ce vaste ensemble, la priorité a longtemps été donnée au développement des outils de biologie moléculaire destinés à l'identification des gènes. Ces travaux ayant abouti à l'achèvement du séquençage du génome (c'est-à-dire l'ensemble des gènes) humain (en 2000) et d'autres espèces, les biotechnologies sont désormais entrées dans l'ère du post-séquençage, c'est-à-dire l'exploitation des données des génomes.
Le post-séquençage connaît aujourd'hui trois types d'applications :
- la « génomique » qui consiste à décrypter les gènes et leurs fonctions ;
- la « protéomique » qui consiste en l'étude des protéines (normales et pathologiques) et de leurs interactions ;
- la « bio-informatique » qui consiste en la mise au point d'outils informatiques spécialisés d'exploitation des données biologiques générées en très grand nombre.
Les interactions entre ces activités aboutissent à de nombreuses inventions dans trois domaines :
- la santé humaine, par les techniques de diagnostic ou les applications thérapeutiques (plus de 50 % des nouveaux médicaments sont issus des techniques d'ingénierie moléculaire et cellulaire) ;
- l'industrie, par la mise au point de nouveaux matériaux ou procédés strictement destinés aux procédés de fabrication ou aux technologies environnementales ;
- l'agriculture, même si l'exploitation des applications potentielles dépend du cadre juridique fixé aux plantes génétiquement modifiés.
Pour les seuls domaines médical et industriel, le marché potentiel mondial des biotechnologies à l'horizon 2010 a été évalué à plus de 2.000 milliards d'euros (soit environ deux fois le PIB de la France) 2 ( * ) .
Au-delà de ce chiffre, le secteur des biotechnologies exerce une action structurante sur l'ensemble de l'économie de la connaissance car il concerne l'ensemble des acteurs publics et privés (organismes de recherche, des industriels et des structures de financement).
Dès lors, le retard européen est préoccupant, dans la mesure où il ne cesse de s'accuser, au point de présenter désormais un caractère structurel.
b) Le retard européen tient à l'absence d'un cercle vertueux : protection de la propriété intellectuelle-financement-développement
Le retard européen par rapport aux Etats-Unis n'a cessé de se creuser au cours des années 1990. En effet, le nombre de brevets biotechnologiques sur chacun des deux continents était comparable en 1990 alors qu'il est aujourd'hui trois fois plus important aux Etats-Unis que dans l'Union européenne (cf. le graphique ci-dessous).
NOMBRE DE BREVETS DEPOSES DANS LE SECTEUR DES BIOTECHNOLOGIES
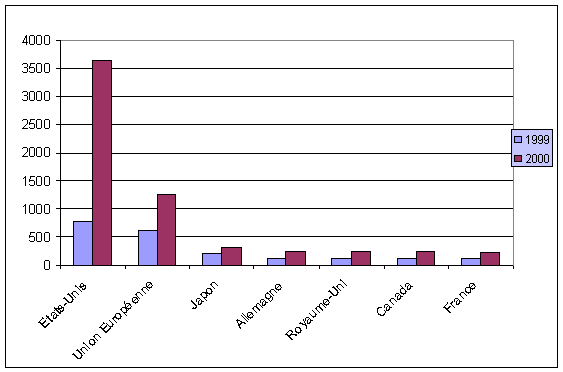
Source : OCDE dans le rapport Innovation and Competitiveness in European Biotechnololgy - Entreprise Papers n° 7, 2002, Commission Européenne
Les causes de cette aggravation du retard européen se précisent lorsque l'on considère la structure du secteur par rapport à celle des Etats-Unis. En effet, le nombre d'entités (entreprises, organismes de recherches ou programmes) dédiées aux biotechnologies est à peu près équivalent des deux côtés de l'Atlantique (environ 8.000 laboratoires). Cette atomisation relative du secteur tient sans doute à la fragmentation des acteurs européens entre les différents Etats membres. En effet, aucun des groupements biotechnologiques existant actuellement en Europe n'atteint la taille et le dynamisme des principaux groupements américains localisés en Nouvelle-Angleterre.
Au-delà de cette fragmentation, l'insuffisant développement du secteur s'explique par un cadre peu favorable eu égard à deux aspects déterminants : le financement d'une part et la propriété intellectuelle d'autre part.
En effet la biotechnologie est un secteur de taille mondiale qui exige des investissements importants concentrés en amont du processus (80 % des dépenses de R&D interviennent avant l'invention) alors que les coûts de production et de commercialisation sont relativement faibles. Les entreprises du secteur doivent donc gérer un processus de recherche et de développement très long et coûteux 3 ( * ) avant de disposer d'un produit commercialisable ou, dans certains cas, d'échouer (comme en témoigne l'abandon de certains programmes génomiques par Adventis en 2002). Quant aux investisseurs publics et privés, ils doivent être prêts à investir à long terme dans des entreprises à haut risque. Il est donc crucial de disposer de garanties claires quant à la propriété intellectuelle sur les inventions.
Aux Etats-Unis, de telles garanties existent traditionnellement depuis la constitution de 1787 (qui garantit explicitement le droit à la propriété intellectuelle) et elles ont été consolidées par le revirement jurisprudentiel de 1980 en matière de brevetabilité du vivant. C'est en effet l'année où la Cour Suprême des Etats-Unis a autorisé M. Ananda Chakrabarty (dans un arrêt du même nom) à breveter une bactérie dont il avait découvert les intéressantes propriétés (sa capacité à digérer les nappes de pétrole). La lecture de cet arrêt fait apparaître clairement la motivation de cette nouvelle conception du droit des brevets : assurer aux chercheurs en biologie et en génétique (secteurs considérés comme stratégiques) que leurs efforts seront récompensés, garantissant ainsi un juste retour sur investissement à leurs financeurs.
Complété par d'autres dispositions (comme le Bay-Dole Act de 1980), la protection de la propriété intellectuelle sur le vivant a eu un effet immédiat sur l'octroi de financements publics et privés.
En Europe, la création de nouvelles entreprises biotechnologiques a été un certain succès depuis 1997, notamment grâce à l'engouement pour les jeunes entreprises de haute technologie. Cependant, une grande partie de ces entreprises sont, à présent, confrontées à la nécessité de renouveler leur financement sur un marché financier plus prudent. La perte, non seulement d'un certain nombre d'entreprises potentiellement viables, mais aussi d'une génération de chercheurs et de la propriété intellectuelle associée s'avère ainsi un danger non négligeable pour l'Europe. Dans cette perspective, le vieux continent risque ainsi de voir s'évaporer un capital de connaissance déjà acquis. Le forum consultatif UE/Etats-Unis 4 ( * ) a évalué ce déficit de financement européen à un milliard de dollars en 2003. Toutes choses égales par ailleurs, la plupart des experts du dossier considèrent que le fossé ainsi creusé ne pourra pas être comblé sans que l'Union européenne ne renforce les garanties de propriété intellectuelle.
La France, troisième acteur européen du secteur (après le Royaume-Uni et l'Allemagne), est pleinement concernée par ce diagnostic 5 ( * ) .
La stratégie européenne en recherche biotechnologique, d'ores et déjà été initiée (au travers notamment de la directive n°98/44) découle de cette analyse.
2. La directive 98/44 s'inscrit dans une stratégie européenne à la hauteur de l'enjeu des biotechnologies
a) L'Union européenne dispose aujourd'hui d'une véritable stratégie en matière de biotechnologies
Cette stratégie s'appuie sur les conclusions du Conseil de Lisbonne de mars 2000 souhaitant que l'Europe devienne en une décennie « l'économie de la connaissance la plus compétitive et la plus dynamique du monde ». Elle a été présentée par la Commission en janvier 2002 et adoptée par le Conseil en juin « compétitivité » et par le Conseil européen.
Au sein d'un plan en 30 points, la priorité est donnée aux actions sur trois handicaps structurels de l'Europe par rapport aux Etats-Unis 6 ( * ) :
- la création d'un véritable espace européen des biotechnologies (renforcement des coopérations publiques et privées à l'échelle de l'Union)
- l'amélioration des outils de financement
- la protection de la propriété intellectuelle.
La protection de la propriété intellectuelle recouvre deux aspects distincts :
- d'une part, la mise en place définitive du brevet communautaire, c'est-à-dire d'un brevet uniforme et valable dans tous les Etats membres 7 ( * )
- d'autre part, la protection des inventions biotechnologiques, qui passe par la transposition de la directive 98/44.
b) La directive 98/44 assure la brevetabilité des inventions biotechnologiques
L'initiative de la directive 98/44 remonte aux années 1980 et a été prise en réaction aux évolutions intervenues aux Etats-Unis. Il est donc bien établi au niveau communautaire depuis plus de vingt ans que les biotechnologies constituent un secteur stratégique en pleine expansion dont le développement nécessite une protection solide de la propriété intellectuelle. A cette fin, une extension de la brevetabilité aux inventions impliquant une matière biologique est apparue nécessaire. Pourtant, l'adoption de cette directive a nécessité dix années de débats et deux propositions de la Commission (1988 et 1994) pour aboutir en 1998.
De plus, cette directive applicable au 30 juillet 2000, n'a été transposée à ce jour que dans neuf 8 ( * ) Etats membres de l'UE à 15 et quinze 9 ( * ) Etats membres de l'UE à 25.
Ces délais contribuent sans doute au retard européen, dans la mesure où la protection de la propriété intellectuelle joue un rôle de clé de voûte pour l'ensemble du développement du secteur.
Mais la transposition de la directive de la directive 98/44 par la France n'est pas seulement une exigence économique.
Elle est aussi devenue un impératif juridique.
B. LA TRANSPOSITION DE LA DIRECTIVE EST DEVENUE UN IMPÉRATIF JURIDIQUE DEPUIS LA CONDAMNATION DE LA FRANCE PAR LA COUR DE JUSTICE DES COMMUNAUTÉS EUROPÉENNES
1. Le retard de transposition de la France s'explique par un débat et des hésitations transcendant les clivages politiques
a) Un débat transcendant les clivages politiques traditionnels
En France, les débats sur cette directive se sont concentrés sur ses articles 5 et 6 relatifs à la brevetabilité d'éléments du corps humain et à ses implications éthiques.
Les positions prises par les uns et par les autres n'ont pas été dictées par des a priori idéologiques ou partisans. Elles semblent avoir résulté de la combinaison de trois facteurs :
- d'une part, des convictions personnelles de certains parlementaires indépendamment de leurs appartenances politiques,
- d'autre part, l'évolution très sensible de la position de plusieurs responsables politiques depuis les années 1996-1997,
- enfin, la prise en compte des obligations liées aux responsabilités gouvernementales.
Cette combinaison de facteurs institutionnels et personnels a donné lieu à plus de six années de débats, décomposables en trois phases.
b) Une évolution en trois temps du débat politique français
1997-1999 : le volontarisme français pour l'adoption de la directive
Le gouvernement français n'a pas seulement voté en faveur de la directive 98/44, mais il a aussi joué un rôle décisif dans son adoption le 6 juillet 1998. Au sein du conseil des ministres de l'industrie, il a notamment fait évoluer la rédaction de plusieurs articles, permettant ainsi d'emporter le vote de plusieurs Etats membres qui étaient plutôt réservés.
D'ailleurs, le gouvernement français ne s'est pas joint à l'action engagée le 19 octobre 1998 devant la Cour de justice des communautés européennes par le gouvernement néerlandais 10 ( * ) , alors même qu'une résolution 11 ( * ) avait été adoptée en octobre 1996 par l'Assemblée Nationale à l'initiative de M. Jean-François Mattei, alors député. A l'instar du recours des Pays-Bas, cette résolution préconisait une plus grande limitation de la portée des brevets qui concernent des éléments du génome humain.
C'est précisément cet aspect éthique du texte qui va devenir central à compter de 2000 et expliquer les réticences françaises à une transposition complète.
2000-2003 : l'apparent consensus français contre la transposition complète de la directive
C'est l'année même (2000) retenue pour l'entrée en vigueur de la directive, que de fortes réserves vis-à-vis du texte ont commencé à prévaloir. Cette nouvelle donne a été très sensible à partir de la pétition lancée par M. Jean-François Mattei, qui reçut le soutien de plusieurs scientifiques (dont le professeur Axel Kahn) pour demander la renégociation des articles 5 et 6 de la directive relatifs au corps humain. Cette préoccupation eut aussi un écho dans le rapport rendu par le député socialiste M. Alain Claeys, en décembre 2001, dans le cadre de l'Office parlementaire d'évaluation des choix scientifiques et technologiques 12 ( * ) . En effet, ce dernier estime que la directive ne donne pas toutes les garanties éthiques, notamment du fait du caractère discutable de la distinction qu'elle établit entre les inventions (qui sont en principe brevetables) et les découvertes (non-brevetables).
Ces préventions contre certaines dispositions de la directive se concrétiseront dans le projet de loi du 31 octobre 2001, n'opérant qu'une transposition partielle du texte européen. En effet, ce projet de loi (toujours non adopté à ce jour) excluait de son champ les dispositions de la directive portant sur les éléments humains (articles 5 et 6).
Ce projet de transposition partielle pose deux difficultés :
- d'une part, il semble ignorer la décision de la CJCE du 9 octobre 2001 statuant sur le recours néerlandais en validant la directive tant sur la procédure que sur le fond ;
- d'autre part, il semble s'en remettre à une hypothétique renégociation des articles 5 et 6 de la directive, malgré les manifestations de fermeté de la Commission européenne (d'ailleurs confortée par la décision de la CJCE).
Depuis fin 2003 : l'évidente obligation d'une transposition
L'hypothèse d'une renégociation de la directive devenant, au fil du temps, de moins en moins réaliste 13 ( * ) , l'obligation de transposer complètement le texte a fini par s'imposer. C'est d'ailleurs l'un des partisans de la renégociation qui, devenu ministre de la Santé en mai 2002, a engagé la transposition complète de la directive.
Ainsi, la loi 2004/800 relative à la bioéthique (loi dite « Mattei » promulguée le 6 août 2004) comprend un titre IV relatif à la protection juridique des inventions biotechnologiques. Il en résulte une transposition/précision des dispositions sur le corps humain, qui soulevaient les difficultés les plus aiguës en France. Un des grands mérites de la méthode retenue est d'avoir situé ce débat dans le cadre plus large de la révision des lois de bioéthique de 1994.
La partie la plus difficile de la transposition étant réalisée, il restait désormais à transcrire le reste de la directive. Tel est l'objet principal du projet de loi examiné par votre Commission.
L'amenuisement des hypothèses de renégociation de la directive ainsi que la nécessité de compléter l'oeuvre législative de la loi Mattei paraissent justifier à eux seuls l'adoption du projet de loi de transposition soumis à votre Commission.
Mais l'adoption de ce texte s'impose aussi et surtout par la récente condamnation de la France et ses conséquences financières.
2. La condamnation de la France et ses conséquences financières n'autorisent plus aujourd'hui aucun retard
a) La détermination de la Commission européenne à voir la directive 98/44 mise en oeuvre
La détermination de la Commission européenne quant à la mise ne oeuvre de cette directive s'explique d'un triple point de vue :
- d'une part, la protection de la propriété intellectuelle est, comme on le sait, une des pierres angulaires de la stratégie européenne en matière de biotechnologies ;
- d'autre part, la non transposition par certains Etats membres à la date prévue du 30 juillet 2000 a eu pour effet de créer des barrières aux échanges, faisant ainsi obstacle au bon fonctionnement du marché intérieur ;
- enfin, une incohérence supplémentaire résultait de l'articulation entre une mise en oeuvre partielle de la directive au sein de l'UE et une mise en oeuvre complète du texte par l'Office européen des brevets, qui a intégré les dispositions de la directive 14 ( * ) dans son règlement d'exécution dès 1999 pour permettre aujourd'hui le dépôt de brevets sur le vivant conformément à la directive.
Ainsi, la Commission a-t-elle provoqué plusieurs réunions à haut niveau avant d'engager une procédure en manquement dont les étapes furent les suivantes :
- décembre 2002 : mise en demeure de l'Allemagne, l'Autriche, la Belgique, la France, l'Italie, le Luxembourg, les Pays-Bas, le Portugal et la Suède ;
- juillet 2003 : saisine de la Cour de justice des communautés européennes (CJCE) contre les Etats membres précités à l'exception du Portugal (qui a transposé la directive en janvier 2003).
b) La condamnation de la France et l'obligation formelle d'une transposition complète
Le 1 er juillet 2004, la CJCE a condamné la France en manquement pour non transposition de la directive.
En complément logique de cette condamnation, la France a reçu le 5 octobre 2004 une lettre de la Commission européenne l'avisant de l'engagement d'une procédure d'astreintes financières sur le fondement de l'article 228 du Traité. Tel est désormais le prix que la France risque de payer pour plusieurs années d'hésitations et de tentatives infructueuses de renégociation.
Certes, cette procédure n'arrivera à son terme que dans plusieurs mois (après la mise en demeure, l'avis motivé puis la saisine de la Cour 15 ( * ) ), mais toute obstination supplémentaire peut sembler absurde et pourrait :
- même pour les dispositions non transposées, la directive 98/44 produit déjà potentiellement d'une application directe en France dans la mesure où il s'agit d'un acte clair et précis 16 ( * ) ;
- la France risque d'avoir à payer des astreintes au moment même où elle vient de régler, par la loi Mattei, les points qui lui posaient le plus de difficultés.
Continuer à refuser de transposer pourrait aussi s'avérer dangereux car rouvrant inutilement un débat potentiellement polémique sur le respect du droit communautaire par la France, sur fond de peurs véhiculées par les sujets bioéthiques. Ceci n'est pas souhaitable.
La transposition définitive de la directive répond donc à la fois :
- à un impératif économique ;
- à une obligation juridique ;
- et à une menace financière.
Mais deux autres arguments viennent conforter ce projet de transposition : d'une part, le texte soumis à votre Commission s'inscrit dans un cadre éthique aujourd'hui consolidé et, d'autre part, il est rédigé de la façon de la plus consensuelle possible.
II. UN PROJET DE LOI DE TRANSPOSITION CONSENSUEL DANS UN CADRE ÉTHIQUE CONSOLIDÉ
A. LA TRANSPOSITION DE LA DIRECTIVE S'INSCRIT DANS UN CADRE ÉTHIQUE CONSOLIDÉ
La transposition s'inscrit dans un cadre offrant des garanties éthiques à trois niveaux :
- des garanties tenant à des exclusions générales du champ de la brevetabilité (1),
- des garanties plus précises relatives au problème spécifique du corps humain (2)
- des garanties quant au contrôle des risques pris pour l'avenir (3).
1. Les garanties données par des interdictions générales
a) Le principe européen de distinction du brevetable et du non brevetable
Issu de plus de dix années (1988-1998) de discussion intenses entre le Commission européenne, le Conseil et le Parlement européen, le texte de la directive 98/44 a manifesté d'entrée le souci de garantir un niveau élevé d'exigence éthique. Ainsi, bien que l'un des objectifs affichés soit la compétitivité face aux Etats-Unis, la directive s'est distinguée d'entrée du système américain. Contrairement au paradigme de la liberté très large 17 ( * ) posé par l'arrêt Chakrabarty, le texte communautaire constitue un véritable « modèle européen » de brevetabilité du vivant. Ce modèle tient essentiellement à l'exclusion du champ de la brevetabilité de tout ce qui n'est qu'une découverte de l'existant naturel, et qui ne fait donc pas appel à l'inventivité scientifique.
b) L'application par la directive de la distinction invention/découverte
La distinction entre découverte (non brevetable) et invention (brevetable) est en effet la clef de voûte du système européen de limitation de la brevetabilité du vivant, comme le prévoit l'article 3-1 de la directive :
« Aux fins de la présente directive, sont brevetables les inventions nouvelles, impliquant une activité inventive et susceptibles d'application industrielle, même lorsqu'elles portent sur un produit composé de matière biologique ou en contenant, ou sur un procédé permettant de produire, de traiter ou d'utiliser de la matière biologique. ».
Dès lors, l'article 3-2 stipule qu'« une matière biologique 18 ( * ) isolée de son environnement naturel ou produite à l'aide d'un procédé technique peut être l'objet d'une invention, même lorsqu'elle préexistait à l'état naturel ».
La nécessité d'obtention par un procédé technique exclut de la brevetabilité tout procédé d'obtention « essentiellement biologique » c'est- à- dire qui « consiste intégralement en des phénomènes naturels tels que le croisement ou la sélection » (article 2-2). Une application de ce principe est l'exclusion des variétés végétales et des races animales du champ de la brevetabilité (article 4-1) ainsi que l'exclusion du corps humain (article 5-1).
2. Des garanties plus précises concernant le corps humain
La question de la brevetabilité d'éléments du corps humain est bien sûr celle qui a nourri le plus d'inquiétudes, aussi bien au plan communautaire qu'au plan national (la France en est un bon exemple), tant au stade de la négociation de la directive 19 ( * ) que lors du suivi de sa mise en application.
Ces inquiétudes doivent être aujourd'hui resituées dans un cadre éthique clarifié. En effet, les dispositions de la directive (a) ont été complétées par des garanties jurisprudentielles et législatives.
a) Les garanties de la directive spécifiques aux éléments humains
Le corps humain est protégé contre toute brevetabilité d`un de ses éléments. Cette interdiction est posée à l'article 5 de la directive : « la simple découverte d'un de ses éléments des [du génome humain], y compris la séquence ou la séquence partielle d'un gène, ne peuvent constituer des inventions brevetables ».
En fait, pour être brevetable, les éléments du corps humain (y compris la séquence totale ou partielle d'un gène) doivent remplir deux nouvelles conditions :
- d'une part, être isolés du corps humain ou autrement produits par un procédé technique ;
- d'autre part, que l'application industrielle d'une séquence partielle ou d'une séquence d'un gène soit concrètement exposée dans la demande de brevet (article 5-3)
A ces conditions spécifiques s'ajoutent l'exclusion de la brevetabilité de tout procédé de clonage d'êtres humains, de toute modification de l'identité génétique germinale de l'être humain, de l'utilisation d'embryons humains à des fins industrielles ou commerciales et plus généralement l'exclusion de toute invention dont l'exploitation serait contraire à l'ordre public et aux bonnes moeurs (article 6).
b) Les garanties supplémentaires données par la jurisprudence de la CJCE
L'une des inquiétudes les plus vives face à la directive portait sur l'absence de prise en compte des principes éthiques par le niveau communautaire.
Cette inquiétude de principe a été levée par la décision de la CJCE du 9 octobre 2001 rappelant que les dispositions de la directive étaient bien soumis à des « exigences éthiques élevées » eu égard au principe d'intégrité et de dignité de la personne humaine.
Même si ce jugement n'a pas été, à lui seul, de nature à rassurer les plus sceptiques, il ouvre la voie à un contrôle « éthique » de la Cour, qui ne peut être que renforcé par la prise de valeur juridique de la Charte des droits fondamentaux de l'Union européenne 20 ( * ) .
c) La consolidation de tous les « acquis éthiques » européens par la loi Mattei
La loi du 6 août 2004 relative à la bioéthique ne se contente pas de transposer les aspects les plus difficiles de la directive 98/44. Elle y ajoute aussi des exigences éthiques dépassant la lettre de la directive sur deux points.
Le premier point concerne la transposition de l'article 5 de la directive. En effet, l'article 17 A. II de la loi (nouvel article L611-18 du code de la propriété intellectuelle) ne se contente pas de transcrire la nécessité d'un exposé concret de l'application d'un élément du corps humain pour en assurer la brevetabilité. Il y ajoute aussi que cette application ne peut découler que d'une fonction d'un élément du corps humain. Ceci restreint et précise encore les cas de brevetabilité relatifs au génome humain, sans devoir être pour autant regardé comme nécessairement contraire à la directive. En effet, cette exigence d'identification de la fonction précise du gène considéré figure au considérant 23 de ladite directive 21 ( * ) .
Le deuxième point concerne l'interdiction de toute invention dont l'exploitation commerciale serait contraire non seulement « à l'ordre public ou aux bonnes moeurs » mais aussi contraire « à la dignité de la personne humaine » (article 17 A. I de la loi, nouvel article L. 611-17 du code de la propriété intellectuelle). L'ajout de cette troisième condition à la lettre de la directive ne devrait pas être regardée comme contraire au droit communautaire car elle reprend l'exigence de respect de la dignité humaine posée par la décision de la CJCE du 9 octobre 2001.
La loi Mattei a donc sécurisé le cadre éthique de la transposition de la directive. C'est sans doute ce qui explique que la saisine du Conseil constitutionnel (n° 2004-498 DC du 29 juillet 2004) contre l'article 17 de la loi n'invoquait nullement un risque de violation des principes de la dignité ou de l'intégrité du corps humain 22 ( * ) .
3. Un cadre éthique prenant en compte les incertitudes de l'avenir
En dépit de l'ensemble de ces garanties, la question de la brevetabilité du vivant est soumise aux nombreuses interrogations d'avenir, indissociables du caractère fortement évolutif des biotechnologies.
Parmi ces interrogations, on peut notamment citer :
Des interrogations générales sur les effets de la brevetabilité :
- le risque paradoxal d'un ralentissement des progrès scientifiques, l'accès au savoir pouvant être entravé par les droits commerciaux des titulaires de brevets ;
- la question morale de la concentration dans les pays développés de brevets nouveaux portant sur des espèces qui se rencontrent majoritairement dans les pays en développement 23 ( * ) .
Des interrogations sur l'adaptation du texte à l'évolution des techniques 24 ( * ) :
- l'évolution des techniques d'élucidation de la fonction des gènes qui pourrait affecter la définition de la « fonction » d'un gène, centrale dans la directive ;
- l'hypothèse de plus en plus fréquente de la découverte de gènes présents dans des espèces différentes mais avec des fonctions différentes.
La nécessité impérieuse de doter l'Europe et la France d'un cadre de protection intellectuelle ne dispense nullement d'être vigilant quant à l'évolution future de l'ensemble de la question.
L'un des arguments supplémentaire pour la pleine entrée de la France dans le système communautaire de brevetabilité du vivant est qu'il s'agit précisément d'un cadre évolutif.
En effet, la Commission a reconnu à de multiples reprises que « la manière de concevoir et d'appliquer la réglementation doit tenir compte des changements rapides que subit le secteur des biotechnologies ».
A ce titre, la Commission a déjà présenté plusieurs rapports prévus par la directive, dont notamment un rapport intitulé « Evolution et implications du droit des brevets dans le domaine de la biotechnologie et du génie génétique » qui témoigne de ses préoccupations en termes de responsabilité sociale et d'exigence éthique.
La transposition complète de la directive de 1998 ne signifie donc nullement l'enfermement dans un carcan dogmatique insensible aux évolutions du secteur et aux interrogations fondamentales qu'elles soulèvent.
B. LE TEXTE SOUMIS À VOTRE COMMISSION SE PRÉSENTE COMME CONSENSUEL, CE QUI N'EXCLUT PAS DE L'AMÉLIORER
1. Un projet de loi consensuel
a) Un projet de loi consensuel sur le fond
Le projet de loi soumis à votre Commission présente trois aspects essentiels, qui devraient tous être accueillis de façon relativement consensuelle :
- le premier aspect du texte (articles 1 à 7) est la garantie du principe général de protection des inventions portant sur la matière biologique, sous réserve des exclusions liées à l'ordre public, ainsi que de conditions et de limites ;
- le deuxième aspect du texte (articles 8 et 9) prévoit des licences obligatoires pour concilier la non brevetabilité des races animales et des variétés végétales avec la brevetabilité d'inventions portant sur des éléments biologiques d'origine animale ou végétale, sous réserve qu'elle répondent à un certain nombre de conditions précises.
Ces deux points ne devraient pas poser de difficultés dans la mesure où la question du génome humain n'est pas traitée par le présent texte (car déjà réglée par loi du 6 août 2004) ;
- le troisième aspect du texte (articles 10 et 11) n'est pas strictement exigé par la transposition de la directive et porte sur le renforcement des licences obligatoires et des licences d'office. Ce renforcement ayant été effectué par l'article 18 de la loi de bioéthique du 6 août 2004, ces articles n'ont plus lieu d'être.
b) Un projet de loi consensuel sur la forme
Le choix du gouvernement a été de déposer sur le bureau du Sénat (première assemblée saisie) le même projet de loi que celui présenté par M. Lionel Jospin, Premier ministre, en novembre 2001 .
La reprise très exacte du précédent projet s'applique à la fois au dispositif du texte et à son exposé des motifs. Ce choix n'est pas motivé par des préoccupations tactiques destinées à gêner les parlementaires de l'ancienne majorité gouvernementale. Il procède en fait de deux considérations :
- d'une part, éviter le trouble que créerait un nouveau texte (avec une nouvelle présentation et une nouvelle terminologie) dans une matière où chaque mot a son importance ;
- d'autre part, répondre à un impératif de délai car la France est tenu de promulguer le présent texte dans les mois qui viennent pour éviter le paiement d'astreintes.
2. Des améliorations possibles
Outre plusieurs amendements 25 ( * ) destinés à assurer la coordination entre le projet de loi, tel que déposé en novembre 2001, et l'état actuel du droit de la propriété intellectuelle résultant des articles 17 et 18 de la loi n°2004-800 du 6 août 2004 relative à la bioéthique, votre commission vous propose des amendements au texte dans un double objectif : d'une part, assurer une meilleure conformité du texte à la directive ; d'autre part, assurer la survie des entreprises semencières européennes par une coexistence harmonieuse et équilibrée entre le droit des brevets et celui des obtentions végétales.
a) Asseoir la sécurité juridique grâce à une transposition fidèle
Il apparaît nécessaire à votre commission de transposer au plus près le texte communautaire. En effet, des écarts, même légers, s'ils ne sont pas purement rédactionnels, risquent de créer des brèches d'incertitude qui pourraient représenter autant de failles exploitables devant les tribunaux. De tels litiges sont nécessairement longs et coûteux et porteraient donc préjudice aux entreprises et laboratoires de biotechnologie, pour une utilité nulle puisque le tribunal ferait certainement primer in fine le texte communautaire sur le texte national.
En outre, une transposition ambiguë, frileuse voire inquiète constituerait un signal négatif à l'égard de l'industrie biotechnologie, qu'il s'agit au contraire de promouvoir. D'ores et déjà, le retard de transposition n'a pas contribué à donner une image positive de la France aux yeux de ces industriels. Une transposition fidèle permettrait, à l'inverse, de faire la preuve de la volonté française de construire l'Europe de la recherche.
A cette fin, votre commission vous propose des amendements aux articles 1 er , 3, 4, 6, 8, 9 et 10.
b) Assurer la survie des entreprises semencières européennes par une coexistence harmonieuse et équilibrée entre le droit des brevets et celui des obtentions végétales
Votre commission propose à cet effet d'introduire, à l'article 7 du présent texte, l'exception du sélectionneur: celle-ci permet d'utiliser librement les variétés végétales protégées par un titre d'obtention végétale à des fins de création variétale.
Le droit européen des brevets organise une dérogation par rapport à la protection du brevet, mais cette dérogation vise exclusivement les actes accomplis à titre expérimental. On retrouve cette disposition appelée "exemption de recherche" en droit national (article L. 613-5 du code de la propriété intellectuelle) : elle permet d'utiliser l'invention brevetée à des fins de recherche, ce qui évite de paralyser l'innovation. Le brevet continue ainsi de promouvoir le progrès scientifique.
Le droit des obtentions végétales organise également une dérogation similaire par rapport à la protection apportée par le certificat d'obtention végétale. Cette dérogation figure dans la convention internationale pour la protection des obtentions végétales (UPOV) et permet d'effectuer librement des actes à titre expérimental mais aussi afin de créer ou de découvrir et de développer d'autres variétés végétales.
La portée de l'exemption de recherche en matière de brevets reste incertaine, et la jurisprudence a pu l'interpréter plus ou moins strictement.
Or, lorsqu'une variété végétale est protégée par un certificat d'obtention végétale -du fait qu'elle est distincte, homogène et stable-, elle peut également bénéficier d'une protection par brevet si elle incorpore un gène servant de support à une invention -qui a été brevetée en raison de sa nouveauté, de son caractère inventif, et de son applicabilité industrielle-.
Chacun des deux droits de propriété intellectuelle doit pouvoir s'exercer pleinement sur une telle variété transgénique. Notamment, il est important que le travail du sélectionneur à partir de cette variété puisse s'effectuer aussi librement que le prévoit la convention protégeant les obtentions végétales et ne nécessite pas une licence du détenteur de brevet.
Certains ont pu s'inquiéter du fait que la protection du brevet pourrait empêcher l'exercice du privilège du sélectionneur.
Afin de lever ces inquiétudes et pour assurer que les droits conférés par le brevet n'empêcheront pas d'exercer les droits attachés au certificat d'obtention végétale, votre commission propose de prévoir, par sécurité, d'insérer une exemption du sélectionneur dans le droit des brevets relatifs aux inventions végétales. Il s'agit d'une mesure favorisant une coexistence équilibrée entre le brevet et le certificat d'obtention végétale.
Cette mesure préserve totalement le droit qui s'attache au brevet comme au COV pour ce qui est de la commercialisation d'une variété dérivée de la première: une telle commercialisation nécessite l'accord du détenteur du droit de propriété intellectuelle et ne peut se faire que moyennant le paiement d'une redevance.
L'introduction de l'exception du sélectionneur est seule à même de permettre aux petites et moyennes entreprises semencières européennes de survivre. Elle seule peut autoriser la France à garder l'ambition de rester dans les tout premiers pays semenciers. D'une manière générale, elle seule, aujourd'hui, apparaît de nature à garantir l'indépendance alimentaire du continent européen.
EXAMEN
DES ARTICLES
TITRE IER
-
DISPOSITIONS RELATIVES À LA TRANSPOSITION
DE LA DIRECTIVE
98/44/CE DU PARLEMENT EUROPÉEN
ET DU CONSEIL DU 6 JUILLET
1998
Article 1er
-
Brevetabilité de la matière biologique
L'article premier du texte complète l'article L. 611-10 du code de la propriété intellectuelle afin d'étendre explicitement aux inventions biotechnologiques le champ de la brevetabilité qui, en droit national, recouvre aujourd'hui « les inventions nouvelles impliquant une activité inventive et susceptibles d'application industrielle », aux termes du paragraphe 1 dudit article.
Les paragraphes 2 et 3 de l'article L. 611-10 précisent que ne sont notamment pas considérées comme des inventions, et donc pas brevetables en tant que tels :
a) les découvertes ainsi que les théories scientifiques et les méthodes mathématiques ;
b) les créations esthétiques ;
c) les plans, principes et méthodes dans l'exercice d'activités intellectuelles, en matière de jeu ou dans le domaine des activités économiques, ainsi que les programmes d'ordinateurs ;
d) les présentations d'informations.
L'article 1 er du présent texte vise à adjoindre à ces paragraphes un quatrième paragraphe dont le premier alinéa inclut, dans les inventions brevetables, celles portant sur un produit constitué de matière biologique ou sur un procédé permettant de produire, de traiter ou d'utiliser une telle matière. Cet alinéa reprend mot pour mot le point 1 de l'article 3 de la directive 98/44 ; toutefois, il introduit d'emblée une référence aux réserves d'ordre public 26 ( * ) que la directive a également prévues en son article 6.1 mais auxquelles son article 3.1 ne se soumet pas explicitement.
Le deuxième alinéa de l'article 1 er introduit, dans des termes presque identiques à ceux retenus au point a) de l'article 2.1 de la directive, une définition de la matière biologique comme une matière « qui contient des informations génétiques et se reproduit ou peut être reproduite dans un système biologique. » La directive parle, pour sa part, de matière « autoreproductible ou reproductible ». L'autoreproduction, comme la reproduction par un tiers, doit donc être une possibilité pour cette matière, non sa caractéristique de fait. Mise à part cette nuance que votre rapporteur vous proposera de résorber par amendement pour éviter toute incertitude juridique, ces définitions similaires mettent l'accent sur le caractère distinctif du vivant, qui fonctionne par « lignées » et dont le résultat de sa possible reproduction présente des caractéristiques communes désignées comme « informations génétiques » .
En confirmant la brevetabilité sur les procédés mais aussi sur les produits en matière biologique, l'article 1 er prend acte d'une évolution de la brevetabilité qui a débuté il y a plus de vingt ans, même si certains ont pu s'en émouvoir dans les années les plus récentes, parfois même après l'adoption par le Parlement européen et le Conseil de la directive 98/44 du 6 juillet 1998.
Le point de départ de cette évolution, ainsi que cela a été souligné précédemment, peut être situé en 1980, année où la Cour Suprême américaine a rendu un arrêt décisif, dit « Chakrabarty » 27 ( * ) , par lequel elle reconnaissait comme objet brevetable « un microorganisme vivant de création humaine » . La décision prise aux Etats-Unis sur les microorganismes sera suivie dès l'année suivante en Europe. De même, comme le rappelait Mme Marie-Angèle Hermitte, directeur d'études à l'EHESS, entendue l'an passé par la mission d'information sur les OGM 28 ( * ) dont votre rapporteur fut le président, « la décision en 1985 de breveter les végétaux aux Etats-Unis a son symétrique en Europe en 1988. » Une troisième étape a été franchie par l'Office européen des brevets qui, en 1990, octroya aux Américains un brevet sur une souris génétiquement modifiée (afin d'augmenter sa prédisposition au cancer) 29 ( * ) , donc conçue pour comprendre les mécanismes de carcinogenèse, en considérant que l'exception à la brevetabilité prévue à l'article 53 b) de la convention de Munich 30 ( * ) visait les races animales et les procédés essentiellement biologiques d'obtention d'animaux mais ne s'appliquait pas aux « animaux en tant que tels ».
Les accords sur les aspects des droits de propriété intellectuelle touchant au commerce (ADPIC), annexés à l'accord de Marrakech du 15 avril 1994 instituant l'Organisation mondiale du commerce (OMC), laissent aux Etats membres de l'OMC la possibilité d'exclure de la brevetabilité « les végétaux et les animaux autres que les micro-organismes », aux termes du 3.b) de l'article 27 de ces accords.
La solution retenue par la directive 98/44 et, avant elle, par les décisions successives des organes judiciaires et des offices de brevets, répond donc, non pas à une obligation internationale à laquelle seraient tenus les Etats membres de l'Union européenne, mais à une volonté politique européenne de doter l'industrie des biotechnologies de la possibilité de recourir aux brevets comme instruments de valorisation de ses recherches assurant un retour sur investissement suffisant.
Il s'agit donc d'un choix de politique industrielle, dont l'objectif est de rattraper le retard pris par l'industrie européenne des biotechnologies sur ses concurrentes, notamment américaine, alors même que l'Europe a été à l'avant-garde de la recherche scientifique en ce domaine.
Votre rapporteur souscrit à ce choix, dont l'urgence lui apparaît depuis déjà longtemps, comme le suggérait déjà le titre que le rapporteur de la mission d'information et lui-même, alors en sa qualité de président de cette mission, avaient retenu pour le rapport : « Quelle politique des biotechnologies pour la France ? » 31 ( * ) .
Il souligne que l'extension au domaine biologique du champ de la brevetabilité soumet naturellement ce domaine aux exigences classiques de la brevetabilité, que l'on retrouve dans les mêmes termes au point 1 de l'article L. 611-10 du code de la propriété intellectuelle, à l'article 52 (1) de la convention sur le brevet européen et à l'article 27 (1) des accords ADPIC : un brevet peut être obtenu pour une invention à condition qu'elle soit « nouvelle », qu'elle « implique une activité inventive » et qu'elle soit « susceptible d'application industrielle » :
- la nouveauté est entendue -en droit national- de façon absolue, une publicité donnée à l'invention antérieurement au dépôt de la demande de brevet rendant celle-ci irrecevable ; l'invention nouvelle, dont la caractéristique est de « ne pas être comprise dans la technique » (article L. 611-10 du code), peut porter aussi bien sur des produits, sur des moyens, sur leurs combinaisons ou sur des applications de moyens déjà connus ;
- le caractère inventif de l'activité impliquée par l'invention est avéré si, pour un homme de métier, « l'invention ne découle pas d'une manière évidente de l'état de la technique » (article L. 611-14 du code) ;
- l'application industrielle est la troisième exigence de fond pour l'octroi d'un brevet : est considérée comme susceptible d'application industrielle une invention « dont l'objet peut être fabriqué ou utilisé dans tout genre d'industrie, y compris l'agriculture » (article L. 611-15 du code).
Sous réserve de présenter les trois caractéristiques énumérées ci-dessus, les inventions sont brevetables. En revanche, les découvertes ne le sont pas, ce qui signifie qu'un produit naturel, quelque utilité qu'il puisse avoir pour l'industrie, ne saurait, en dehors de toutes méthodes industrielles d'application de procédés nouveaux, faire l'objet d'un brevet.
Ceci reprend la traditionnelle distinction entre découverte et invention, déjà présente en ces termes 32 ( * ) sous la plume d'Emmanuel Kant : « Découvrir quelque chose, c'est percevoir le premier ce qui était déjà là, par exemple l'Amérique, la force magnétique qui se dirige vers le pôle, l'électricité atmosphérique. Inventer quelque chose, c'est faire venir à la réalité ce qui n'était pas encore là, par exemple l'aérostat. » 33 ( * ) Comme le résume M. Michel Vivant, auditionné par votre rapporteur, « la découverte enrichit les connaissances, l'invention transforme le monde. »
Or la distinction traditionnelle en droit des brevets entre découverte et invention est particulièrement délicate à établir en matière de biotechnologie, technologie dont la matière première, voire le produit, est souvent un élément naturel.
Selon M. Jean-Marc Mousseron, dans son Traité des brevets cité par le rapporteur de l'Office parlementaire d'évaluation des choix scientifiques et technologiques (OPECST), le député Alain Claeys, « la découverte se distingue en ce qu'elle est la perception par voie d'observation d'un phénomène naturel préexistant à toute intervention de l'homme, alors que l'invention se caractérise en ce qu'elle est la coordination volontaire par l'homme de moyens matériels. L'aspect naturel d'un objet distingue la découverte de l'invention industrielle nécessairement marquée par une intervention artificielle de l'homme».
La ligne de démarcation entre l'invention et la découverte prête à débat. Certains tracent cette ligne entre les gènes à l'état naturel -« en tant que tels »- et les gènes isolés, copiés voire interprétés grâce à l'intervention humaine. Ce faisant, l'homme permet au phénomène naturel de se manifester dans une application industrielle alors qu'il n'était pas en état de le faire dans son expression naturelle.
D'autres font valoir, à l'inverse, que la sphère de la découverte engloberait les gènes à l'état naturel aussi bien que ceux isolés de leur contexte pour être copiés à l'identique, alors que les procédés d'obtention ou d'application de ces gènes, les méthodes de tests génétiques bien définies ou encore les produits thérapeutiques dérivés relèveraient des inventions techniquement brevetables.
La difficulté à tracer une frontière incontestable entre le domaine des découvertes et celui des inventions en matière biotechnologique s'est accrue à la faveur de l'évolution récente de cette science, qui met en oeuvre des capacités informatiques croissantes permettant une forme d'automatisation de la recherche. Ainsi, l'inventivité en matière d'isolement de gènes va diminuant tandis que s'accroît la contribution de l'informatique à la biologie : c'est la bio-informatique, par sa capacité à traiter un volume considérable de données, qui aura permis le séquençage du génome humain. L'informatique permet de reconstituer et d'identifier les gènes codant pour une protéine, voire de prédire la localisation des parties d'une séquence génique codant pour une protéine, et, en comparant automatiquement les séquences géniques identifiées, de déduire la fonction probable d'un gène. Le processus de recherche s'en trouve banalisé et l'invention réduite au minimum.
Le titre de la directive « pour la protection des inventions biotechnologiques » tend à qualifier d'inventions les avancées en matière de biotechnologie, malgré le flou de la frontière qui sépare l'invention de la découverte, ce qui atteste du fait que cette frontière s'apparente à une convention que l'on se donne pour séparer ce qui est du domaine du brevet et ce que l'on veut soustraire à ce domaine.
L'objectif de la directive étant de protéger la propriété intellectuelle afin d'encourager le développement de l'industrie biotechnologique, elle repose sur une acception plutôt large de l'invention 34 ( * ) en incluant la matière biologique dans le champ de la brevetabilité, dès lors qu'elle est isolée de son environnement naturel ou produite par un procédé technique, « même lorsqu'elle préexistait à l'état naturel », aux termes de l'article 3.2. Votre rapporteur relève que ce point 2 de l'article 3 ne fait pas l'objet d'une transposition en droit national ; toutefois, il fait observer que cette transposition est en fin de compte tacite, puisqu'elle est sous-jacente à l'ensemble des autres dispositions du texte. Ceci ne peut donc pas être considéré comme une lacune.
Parallèlement, la directive pose toutefois des limites à la brevetabilité de la matière biologique : c'est l'objet des deux articles suivants du projet de loi, relatifs aux articles L. 611-17 et L. 611-18 du code de la propriété intellectuelle. Il est à noter que c'est sous réserve de leurs dispositions que le présent article rend brevetables les inventions biotechnologiques.
En raison des réaménagements intervenus depuis dans le code de la propriété intellectuelle, la référence aux articles L. 611-17 et L. 611-18 doit être revue. C'est pourquoi votre rapporteur vous proposera à cet article un amendement de coordination, afin de soumettre la brevetabilité de la matière biologique aux réserves qui figureront désormais aux articles L. 611-17, L. 611-18 et L. 611-19 du code.
En outre, il propose un amendement visant à assurer la transposition la plus fidèle possible avec la directive, afin d'éviter toute insécurité juridique. La définition de la matière biologique dans la directive vise la matière « autoreproductible ou reproductible ». Il n'est sans doute pas souhaitable d'introduire en droit national ces néologismes.
Cependant, il convient de veiller à garder leur sens dans la rédaction française. Aussi la notion de capacité de reproduction -spontanée ou non- doit être mise en avant : cet amendement met donc le verbe "peut" en facteur commun des deux modes de reproduction de la matière biologique : spontané ou provoqué.
Votre commission vous propose d'adopter cet article ainsi modifié.
Article 2 -
Principes limitant le champ de la brevetabilité de la
matière biologique
L'article 2 du projet de loi n° 55, tel que déposé sur le bureau du Sénat en novembre 2001, prévoyait d'abroger deux des trois points composant l'article L. 611-17 du code de la propriété intellectuelle, dont l'objet est de déterminer ce qui n'est pas brevetable, son article 3 prévoyant, quant à lui, la création d'un nouvel article L. 611-18 qui aurait réintégré, dans une liste allongée, les deux exclusions de brevetabilité figurant auparavant à l'article L. 611-17.
Jusqu'à l'adoption de la loi n°2004-800 du 6 août 2004 sur la bioéthique, l'article L. 611-17 excluait du champ de la brevetabilité trois éléments :
- les inventions « dont la publication ou la mise en oeuvre serait contraire à l'ordre public ou aux bonnes moeurs », cette contrariété ne pouvant résulter du seul fait que cette mise en oeuvre est interdite par une disposition législative ou réglementaire ; à ce titre, « le corps humain, ses éléments et ses produits ainsi que la connaissance de la structure totale ou partielle d'un gène humain ne peuvent, en tant que tels, faire l'objet de brevets » ;
- les obtentions végétales d'un genre ou d'une espèce protégés par un certificat d'obtention végétale (dont le régime juridique est défini au chapitre III du titre II du livre VI du code de la propriété intellectuelle) ;
- les races animales ainsi que les procédés essentiellement biologiques d'obtention de végétaux ou d'animaux, cette disposition ne s'appliquant pas aux procédés microbiologiques et aux produits obtenus par ces procédés.
L'objet de l'article 2 du présent texte était de réaménager le code de la propriété intellectuelle en cantonnant l'article L. 611-17 à l'exclusion de brevetabilité pour cause de contrariété avec « l'ordre public ou les bonnes moeurs », qui constitue une raison de principe d'opposition à l'octroi d'un brevet.
Le projet était de regrouper dans un autre article -l'article L. 611-18-, que l'article 3 visait à créer, les inventions qui, par leur nature et non du fait de leur « illicéité » 35 ( * ) , ne pouvaient être brevetées. Dans la liste limitative de ces inventions non brevetables, auraient donc notamment figuré les obtentions végétales et les races animales, d'ores et déjà exclues du champ de la brevetabilité, mais au titre de l'ancien article L. 611-17.
Or la loi « bioéthique » d'août 2004 a déjà procédé à un réaménagement du code s'agissant des exclusions du champ de la brevetabilité.
Comme le prévoyait l'article 2 du présent texte, l'article 17 de cette loi « bioéthique » a isolé, dans l'article L. 611-17 rédigé sous une nouvelle forme, la non brevetabilité pour contrariété avec l'ordre public et les bonnes moeurs. Ceci rend donc caduque l'article 2, dont votre rapporteur vous proposera en conséquence la suppression.
En revanche, l'énumération limitative des « inventions » non brevetables en raison de leur nature, auquel le présent texte prévoyait de consacrer un nouvel article L. 611-18, a été « éclatée » par la loi bioéthique dans trois nouveaux articles :
- un article L. 611-18 consacré à l'humain ;
- un article L. 611-19 dédié à l'animal ;
- un article L. 611-20 traitant du végétal.
Alors que les articles 2 et 3 du projet de loi n°55 n'ambitionnaient de transposer que les articles 4 et 6 36 ( * ) de la directive 98/44/CE, la loi bioéthique a ainsi opéré la transposition quasi complète des articles 4, 5 et 6.
Les controverses multiples occasionnées par l'article 5 depuis son adoption -et même dès avant celle-ci- avaient en effet conduit le gouvernement de M. Lionel Jospin à déposer en novembre 2001 sur le bureau du Sénat un projet de loi transposant la directive communautaire 98/44 mis à part son article 5, qui traite de la brevetabilité du corps humain et des gènes et dont d'aucuns ont demandé la renégociation à l'échelon communautaire.
La loi bioéthique d'août 2004 est finalement parvenue à la transposition de cet article 5 plus de six ans après son adoption, au terme d'un débat fructueux entre les deux chambres du Parlement sur l'interprétation à donner à la directive communautaire sur ce point délicat.
On relèvera que l'article L. 611-17 du code de la propriété intellectuelle issu de la loi « bioéthique » n'est pas strictement identique au a) de l'ancien article L. 611-17, ce qui aurait été lé résultat mécanique de la stricte application de l'article 2 du présent texte.
En effet, la loi « bioéthique », comme évoqué plus haut, a adopté une nouvelle rédaction de la phrase qui constituait auparavant le a) de l'article L. 611-17 : le principe est désormais posé d'exclure de la brevetabilité les inventions dont « l'exploitation commerciale », et non plus « la publication ou la mise en oeuvre », serait contraire aux bonnes moeurs et à l'ordre public, mais aussi -nouveauté- contraire à « la dignité de la personne humaine ».
Viser l'exploitation commerciale plutôt que la publication ou la mise en oeuvre comme action dérivée de l'invention et susceptible de contrarier les bonnes moeurs ou l'ordre public ne change pas fondamentalement la donne. Ce glissement sémantique prend sa source dans la directive communautaire elle-même, dont l'article 6.1 pose le même principe de non brevetabilité pour contrariété avec l'ordre public ou les bonnes moeurs en visant aussi « l'exploitation commerciale ». Sans doute la directive elle-même a-t-elle repris les termes utilisés à l'article 27.2 des accords ADPIC, qui ouvre aux Etats membres la possibilité d'écarter de la brevetabilité les inventions « dont il est nécessaire d'empêcher l'exploitation commerciale sur leur territoire pour protéger l'ordre public ou la moralité. » Cette référence à l'exploitation commerciale apparaît d'autant plus fondée que la substance même du brevet est d'octroyer à son détenteur le droit d'empêcher l'exploitation commerciale de son invention par un tiers non autorisé, durant la période couverte par le brevet 37 ( * ) .
La notion d'ordre public et de bonnes moeurs, classique en droit des brevets, doit être entendue largement, l'article L. 611-17, comme d'ailleurs l'article 6.1 de la directive communautaire ou l'article 27.2 des accords ADPIC, précisant explicitement que cette notion dépasse la simple légalité : l'exploitation commerciale d'une invention pourrait être contraire à l'ordre public et aux bonnes moeurs quand bien même elle ne serait pas interdite par une disposition législative ou réglementaire en vigueur.
La loi « bioéthique » a ajouté une nouvelle condition de brevetabilité : ne sont pas non plus brevetables les inventions dont l'exploitation commerciale « serait contraire à la dignité de la personne humaine ». Il s'agit d'une garantie supplémentaire que le législateur national a légitimement souhaité introduire afin de mieux circonscrire encore le champ de la brevetabilité et qui constitue une forme de transposition du considérant 16 de la directive 98/44/CE, lequel rappelle notamment que « le droit des brevets doit s'exercer dans le respect des principes fondamentaux garantissant la dignité et l'intégrité de l'Homme ».
Alors que l'article L. 611-17, dans sa rédaction antérieure à la loi bioéthique, n'exigeait pas explicitement le respect de la dignité humaine, il interdisait toutefois, au titre du respect de l'ordre public et des bonnes moeurs, la brevetabilité « en tant que tels » du corps humain, de ses éléments et de ses produits ainsi que de la connaissance de la structure totale ou partielle d'un gène humain.
C'est désormais un nouvel article L. 611-18 qui pose cette interdiction de breveter le corps humain : « Le corps humain, aux différents stades de sa constitution et de son développement, ainsi que la simple découverte d'un de ses éléments, y compris la séquence totale ou partielle d'un gène, ne peuvent constituer des inventions brevetables. »
Si la nouvelle formulation de cette interdiction a le mérite de clarifier les termes de la précédente -et de mettre notamment fin aux débats interprétatifs autour de l'expression « en tant que tels »-, on peut relever que les « produits du corps humain » (sueur, urine, larmes...) ne figurent plus expressément dans le champ du non brevetable. L'exclusion de brevetabilité qui frappe les « éléments » du corps humain doit en fait s'interpréter comme emportant également l'exclusion de brevetabilité des produits du corps humain, qui en sont, d'une certaine manière, des éléments d'un type particulier. Ainsi n'est pas fragilisée la protection dont doivent impérativement bénéficier les produits du corps humain afin de ne pas entrer dans le champ commercial, conformément au principe de non commercialisation du corps humain, consacré par le code civil en ses articles 16-1et 16-5 38 ( * ) et rappelé avec force par le Comité consultatif national d'éthique dans l'avis 39 ( * ) qu'il a rendu sur l'avant-projet de loi portant transposition de la directive 98/44/CE.
Il convient de souligner également que le nouvel article L. 611-18 ne se contente pas de reformuler l'interdiction de breveter le corps humain ou ses éléments.
Il complète et enrichit ce principe de deux manières.
D'une part, il circonscrit avec soin le champ du brevetable :
- en destinant la protection du brevet aux seules inventions (la distinction entre la découverte, non brevetable par principe, et invention est ainsi réaffirmée), et, parmi les inventions, à celles « constituant l'application technique d'une fonction d'un élément du corps humain » ;
- en limitant le champ des revendications associées à un tel brevet au seul aspect de l'élément du corps humain « nécessaire à la réalisation et à l'exploitation de cette application particulière » ;
- en exigeant la description concrète et précise de l'application dans la demande de brevet.
D'autre part, il établit, à titre indicatif, une liste de quatre procédés ou produits non brevetables : les procédés de clonage des êtres humains, les procédés de modification de l'identité génétique de l'être humain, les utilisations d'embryons humains à des fins industrielles ou commerciales et les séquences totales ou partielles d'un gène prises en tant que telles.
Celle liste non exhaustive permet ainsi au législateur d'expliciter notamment l'interdiction de breveter les procédés qui sont notoirement attentatoires à la dignité humaine, aux bonnes moeurs et à l'ordre public, ou les éléments du corps humain qui représentent des découvertes et non des inventions (les séquences de gène « en tant que telles »). Ce faisant, et conformément au considérant 38 de la directive 98/44, le législateur donne aux juges et aux offices de brevets des orientations générales sur l'interprétation de la référence à l'ordre public et aux bonnes moeurs prévue à l'article 6.1 de la directive communautaire.
La liste retenue par le législateur national reprend d'ailleurs celle figurant à l'article 6.2 tout en la complétant par une interdiction explicite de breveter une séquence de gène en tant que telle, interdiction qui ne figure pas expressément dans la directive -dont l'ambiguïté de l'article 5 a été abondamment soulevée 40 ( * ) - mais qui en constitue une interprétation française.
Votre rapporteur fait observer que la transposition en droit national de la directive 98/44/CE n'a donc pas pour effet de rendre brevetable une séquence de gène en tant que telle mais n'autorise la délivrance de brevet que sur l'application technique d'une fonction spécifique assurée par une telle séquence. Cette interprétation est d'ailleurs directement inspirée du considérant 23 de la directive qui dispose qu'une « simple séquence d'ADN sans indication d'une fonction ne contient aucun enseignement technique ; qu'elle ne saurait, par conséquent, constituer une invention brevetable. »
Votre commission vous propose de supprimer cet article.
Article 3 -
Limites de la brevetabilité en matière animale
et végétale
L'article 3 du projet de loi n°55 prévoyait l'insertion, après l'article L. 611-17 du code de la propriété intellectuelle, d'un nouvel article L. 611-18 délimitant le champ de la brevetabilité en matière végétale et animale.
L'intervention de la loi bioéthique entre la date de dépôt du projet de loi et son inscription à l'ordre du jour du Parlement vient encore compliquer l'examen de cet article 3. En effet, la loi bioéthique a déjà créé un article L. 611-18, ci-dessus exposé, consacré à la brevetabilité du corps humain et de ses éléments. De surcroît, elle a dédié un nouvel article L. 611-19 à la question de la brevetabilité en matière animale et un nouvel article L. 611-20 à celle de la brevetabilité en matière végétale.
Ces deux nouveaux articles méritent toutefois d'être revus : d'une part, ils ont été élaborés à droit constant -puisqu'ils reproduisent les dispositions figurant antérieurement aux b) et c) de l'ancien article L. 611-17 du code 41 ( * ) -, et n'opèrent donc pas une transposition complète de la directive 98/44/CE sur ces sujets ; d'autre part, il paraît difficile, voire impossible, de ne pas les fusionner en un seul article, dans la mesure où l'animal et le végétal font l'objet de dispositions juridiques communes.
C'est pourquoi, à la place de l'insertion prévue d'un article L. 611-18, ce numéro d'article étant désormais consacré à l'humain, votre rapporteur vous proposera le remplacement des articles L. 611-19 et L. 611-20 par un seul et nouvel article L. 611-19.
Cet article reprendrait les termes de celui dont le présent article 3 prévoyait l'insertion : conformément à l'article 4 de la directive qu'il transpose fidèlement, il a pour objet d'écarter du champ de la brevetabilité quatre produits ou procédés, dont on pourrait dire que la caractéristique commune est de représenter des expressions naturelles des règnes animal et végétal.
Sont ainsi déclarés non brevetables :
- les races animales , concept dont la définition ne figure d'ailleurs dans aucun texte juridique en raison des difficultés d'ordre scientifique que soulève son établissement, mais dont l'avocat général M.F.G. Jacobs, dans ses conclusions présentées devant la Cour de justice des Communautés européennes 42 ( * ) , a proposé l'interprétation suivante : « un ensemble taxinomique prenant rang juste après la sous-espèce (lorsqu'elle existe) ou l'espèce, dont les membres diffèrent d'autres représentants de la même espèce ou sous-espèce par des caractéristiques mineures mais permanentes ou héréditaires » ;
- les variétés végétales , dont la définition figure à l'article 5 du règlement CE n°2100/94 du 27 juillet 1994 43 ( * ) : « on entend par « variété » un ensemble végétal d'un seul taxon botanique du rang le plus bas connu qui, qu'il réponde ou non pleinement aux conditions d'octroi d'une protection des obtentions végétales, peut être défini par l'expression des caractères résultant d'un certain génotype ou d'une certaine combinaison de génotypes, être distingué de tout autre ensemble végétal par l'expression d'au moins un desdits caractères et être considéré comme une entité eu égard à son aptitude à être reproduit sans changement. »
En renvoyant à cette définition qui englobe aussi les ensembles végétaux ne répondant pas pleinement aux « conditions d'octroi d'une protection des obtentions végétales » , l'exclusion de brevetabilité des variétés végétales couvre un champ plus grand que l'exclusion qui figurait auparavant au c) de l'article L. 611-17 du code et visait les seules obtentions végétales, protégées par les « dispositions du chapitre III du titre II du présent livre », chapitre débutant par un article L. 623-1, aux termes duquel est appelée « obtention végétale » la « variété nouvelle, créée ou découverte :
1° qui se différencie des variétés analogues déjà connues par un caractère important, précis et peu fluctuant, ou par plusieurs caractères dont la combinaison est de nature à lui donner la qualité de variété nouvelle ;
2° qui est homogène pour l'ensemble de ses caractères ;
3° qui demeure stable, c'est-à-dire identique à sa définition initiale à la fin de chaque cycle de multiplication ».
La non brevetabilité des variétés végétales s'entend quelque soit la manière dont a été produite cette variété végétale : en conséquence, les variétés végétales contenant des gènes introduits par recombinaison génétique sont exclues de la brevetabilité en tant que telles. Toutefois, elles peuvent être couvertes par le brevet éventuellement associé aux gènes qu'elle abrite : en effet, dans ce cas, conformément au droit commun des brevets 44 ( * ) , la protection conférée par brevet au gène s'étend au produit qui l'incorpore, en l'occurrence la plante, qui peut être une variété si elle répond aux trois critères présentés ci-dessus.
A l'inverse, une invention dans laquelle une variété végétale spécifique n'est pas individuellement revendiquée n'est pas exclue de la brevetabilité, même si elle peut couvrir des variétés végétales. Ceci résulte de la jurisprudence de l'Office européen des brevets, mais se trouve désormais confirmé par l'article 4.2 de la directive 98/44/CE, que transpose en ces termes le point 2° du nouvel article du code créé par le présent article 3 45 ( * ) : « les inventions portant sur des végétaux ou des animaux sont brevetables si l'application de l'invention n'est pas limitée à une variété végétale ou à une race animale déterminée ».
Le présent texte retient comme condition de brevetabilité le fait que « l'application» déborde une seule variété végétale ou race animale, alors que la directive vise la « faisabilité technique ». Votre rapporteur souligne la nuance qui distingue la faisabilité technique d'une invention de son application, le texte communautaire posant une condition relative au procédé, à la façon de faire, alors que le texte national conditionne la brevetabilité au champ d'application, en aval du procédé. Si le texte national impose que l'application plutôt que la seule faisabilité de l'invention ne se limite pas à une seule variété ou race, il devient sans doute plus exigeant en termes de brevetabilité. Afin d'éviter tout conflit d'interprétation sur ce point entre le texte national et le texte communautaire, votre rapporteur vous propose un amendement remplaçant le terme « application » par celui de « faisabilité technique » ;
- les procédés « essentiellement biologiques » pour l'obtention des animaux et des végétaux : il est précisé dans le présent texte, alors que cela ne l'était pas dans la loi bioéthique du 6 août 2004 46 ( * ) , qu'il s'agit de procédés « qui font exclusivement appel à des phénomènes naturels comme le croisement ou la sélection ». En filigrane, dans l'exclusion de brevetabilité qui frappe de tels procédés, réapparaît le souci de préserver de toute brevetabilité les données ou procédés préexistant dans la nature, et donc relevant de la sphère des découvertes plutôt que de celle des inventions.
L'article 2.2 de la directive adopte une définition similaire du « procédé essentiellement biologique », mais pas tout à fait identique : selon le texte communautaire, il s'agit d'un procédé « qui consiste intégralement en des phénomènes naturels comme le croisement ou la sélection », alors que le texte national le définit comme faisant « exclusivement appel à » ces mêmes phénomènes naturels. Sur ce point, votre rapporteur soutient le texte du projet de loi qui lui paraît mieux rédigé : en effet, il serait absurde d'identifier un procédé à des phénomènes, la nature du procédé étant d'être une construction de l'esprit. Le procédé consiste en une succession organisée d'étapes, lesquelles, seules, sont susceptibles de faire exclusivement appel à des phénomènes naturels ;
- les « procédés de modification de l'identité génétique des animaux de nature à provoquer chez eux des souffrances sans utilité médicale substantielle pour l'homme ou l'animal, ainsi que les animaux issus de tels procédés » : alors que tout procédé de modification génétique de l'identité germinale de l'être humain est écarté, sans condition, de la brevetabilité en vertu de l'article L. 611-18 du code créé par la loi bioéthique 47 ( * ) , il s'agit ici d'un arbitrage plus délicat entre les avantages thérapeutiques attendus -pour l'homme ou l'animal- du procédé ou de l'animal « inventé » et les atteintes au bien-être animal que cette invention provoque.
Cet arbitrage a déjà guidé plusieurs décisions des offices de brevets. Ainsi, un brevet sur une souris oncogène a pu être accordé 48 ( * ) en raison des avancées qu'elle était susceptible de permettre dans la connaissance de la carcinogenèse, tandis que le caractère d'invention brevetable a été dénié à une autre souris transgénique ayant reçu un gène stimulant la pousse des poils qui aurait pu contribuer à lutter contre la calvitie 49 ( * ) .
L'article L. 611-19 du code de la propriété intellectuelle, dans la nouvelle rédaction issue du présent article 3 du texte, prévoit donc quatre exclusions de brevetabilité, dont celle des procédés essentiellement biologiques, au c) du 1. Cette exclusion se trouve contrebalancée par l'affirmation, au 3° de l'article L. 611-19, de la brevetabilité des inventions « ayant pour objet des procédés techniques, notamment un procédé microbiologique, ou un produit obtenu par ces procédés » . Il s'agit de la transposition fidèle du point 3 de l'article 4 de la directive, qui confirme que l'intervention humaine c'est-à-dire « technique » sur la nature fait nécessairement basculer dans la sphère de l'invention, donc du brevetable. Votre rapporteur vous proposera un simple amendement rédactionnel afin de clarifier ce point, notamment en précisant -conformément au texte communautaire- qu'un brevet peut être octroyé pour un seul procédé technique et non nécessairement pour plusieurs d'entre eux.
Ce 3° précise ensuite quelle est la définition d'un procédé microbiologique : « tout procédé utilisant ou produisant une matière biologique ou comportant une intervention sur une telle matière » . Cette définition est inspirée de celle qui figure au 1.b) de l'article 2 de la directive communautaire, même si celle-ci vise plus précisément la matière microbiologique et non la matière biologique. Votre rapporteur vous propose toutefois de conserver la définition proposée par le projet de loi, qui, se référant à la matière « biologique », est plus exacte scientifiquement. Il relève en outre que, même dans la directive, seule la matière biologique est définie -au a) du point 1 de l'article 2- alors que la matière microbiologique ne l'est pas.
Sur cette définition du procédé microbiologique, le seul amendement proposé par votre rapporteur est d'ordre rédactionnel.
Votre commission vous propose d'adopter cet article ainsi modifié.
Article 4 -
Obligation de dépôt de matière
biologique pour obtenir un brevet
Aux termes du premier alinéa de l'article L. 612-5 du code de la propriété intellectuelle, une invention doit être exposée dans la demande de façon suffisamment claire et précise pour qu'un homme de métier puisse l'exécuter.
Le second alinéa de cet article prévoyait aussi une condition supplémentaire pour considérer comme suffisante cette description dans le cas des inventions impliquant un micro-organisme auquel le public n'a pas accès : l'obligation de déposer une culture de ce micro-organisme auprès d'un organisme habilité. Il était précisé que les conditions d'accessibilité du public à cette culture étaient fixées par voie réglementaire.
Ces dispositions, prévues du temps où la seule matière vivante pouvant prétendre à brevet était les micro-organismes, doivent nécessairement être adaptées en raison de l'extension du champ de la brevetabilité à la matière biologique dans son ensemble.
C'est pourquoi, conformément à l'article 13.1 de la directive communautaire, le présent article étend l'obligation de dépôt aux inventions impliquant une matière biologique inaccessible au public, dans certaines circonstances. Il renvoie précisément à un décret en Conseil d'Etat le soin de fixer les conditions d'accessibilité du public à cette culture, lesquelles sont détaillées aux points 2, 3, 4 et 5 de l'article 13 de la directive.
Cette nouvelle obligation susceptible de concerner toute invention relative à une matière biologique inaccessible au public perd toutefois en systématicité. Alors qu'auparavant, le seul fait, pour une invention, d'impliquer un micro-organisme inaccessible au public emportait l'obligation de dépôt, désormais, comme le prévoit le directive 98/44/CE, l'obligation de dépôt ne s'impose qu'aux inventions qui impliquent une matière biologique inaccessible au public mais aussi dont la description ne permet pas à l'homme de métier de les exécuter. Ces conditions cumulatives tendent à rendre plus lâche l'obligation de dépôt : ainsi, jusque là, la description d'une invention impliquant une matière microbiologique inaccessible au public ne pouvait jamais être regardée comme suffisante si elle n'était pas accompagnée d'un dépôt du micro-organisme en cause. A l'avenir, aux termes de la directive repris dans le texte de transposition national, la description d'une invention impliquant une matière biologique inaccessible au public pourrait être considérée comme suffisante sans dépôt de cette matière du moment que cette description permet à l'homme de métier d'exécuter l'invention.
Votre rapporteur relève toutefois que le champ des inventions soumises à obligation de dépôt est légèrement plus large dans le texte de droit national que dans le texte communautaire : en effet, celui-ci vise toute invention ne pouvant être décrite de manière à permettre à un homme du métier de la réaliser, alors que le présent article vise toute invention dont la description ne permet pas à un homme de métier de la reproduire, ce qui inclut aussi bien les inventions ne pouvant, par nature, être précisément décrites -comme le prévoit la directive- que les inventions qui auraient pu être précisément décrites mais ne l'ont pas été. Ainsi, le texte de transposition étend marginalement l'obligation de dépôt de matière biologique.
On pourra objecter que la rédaction nationale présente un caractère plus opératoire ; il est vrai qu'il est sans doute plus aisé de constater qu'une description ne suffit pas à la reproduction de l'invention par l'homme de métier plutôt que de déterminer si une description suffisante est possible ou ne l'est pas. Dans un souci de sécurité juridique, votre rapporteur vous propose toutefois un amendement qui impose le dépôt de matière biologique dans des circonstances strictement identiques à celles prévues en droit communautaire et vise les inventions « ne pouvant être décrites afin de permettre à l'homme de métier de les reproduire. »
Votre commission vous propose d'adopter cet article ainsi modifié.
Article 5 -
Coordination
Cet article adapte, pour des raisons de coordination avec les articles du code nouvellement créés, certaines dispositions du code se référant à l'ancien article L. 611-17. Ces dispositions figurent à l'article L. 612-12, qui énumère les raisons justifiant le rejet d'une demande de brevet, parmi lesquelles on trouve le caractère non brevetable de l'invention, en application de l'article L. 611-17 jusqu'à la promulgation de la loi bioéthique, en application des articles L. 611-17 à L. 611-20 depuis.
Le I de l'article 5 vise à substituer à l'ancien renvoi à l'article L. 611-17 un renvoi aux articles L. 611-17 et L. 611-18, la création de ce dernier article étant prévue par l'article 3 du présent texte.
Or, suite à l'adoption de la loi bioéthique d'août dernier qui a créé un autre article L. 611-18, et à l'amendement proposé par votre rapporteur à l'article 3 du présent texte pour fusionner en un article L. 611-19 les deux articles L. 611-19 et L. 611-20 créés par l'article 17 de la loi bioéthique, la non brevetabilité repose désormais sur trois articles du code, les articles L. 611-17, L. 611-18 et L. 611-19. C'est pourquoi votre rapporteur propose un amendement de coordination remplaçant la référence envisagée par le présent article aux articles L. 611-17 et L. 611-18 par une référence aux articles L. 611-17 à L. 611-19.
Le II de l'article 5 tend également à modifier l'article L. 612-12, dont le dernier alinéa prévoit la suppression d'office de parties de la description et des dessins. Cette suppression d'office visait, jusqu'à la loi bioéthique, les parties non conformes au a) de l'article L. 611-17, lequel posait la non brevetabilité des inventions contraires aux bonnes moeurs et à l'ordre public et, à ce titre, celle du corps humain et de ses éléments, ou à l'article L. 612-1, qui énumère les conditions de forme imposées à toute demande de brevet.
Par cohérence avec la scission en deux articles L. 611-17 et L. 611-18 de ces dispositions auparavant contenues au a) de l'article L. 611-17, le IV du A de l'article 17 de la loi bioéthique a remplacé la référence au a) de l'article L. 611-17 dans l'article L. 612-12 par une référence aux articles L. 611-17 et L. 611-18.
Le présent article 5 prévoyait lui aussi la même substitution mais, selon son économie interne de novembre 2001 (donc avant l'intervention de la loi bioéthique), cette substitution ne relevait pas d'une simple coordination à droit constant mais constituait bien un élargissement du champ de la suppression d'office d'une part des descriptions ou dessins : non seulement cette suppression était de droit pour toute violation du a) de l'article L. 611-17 -a) que l'article 2 du présent texte prévoit de transformer en article L. 611-17 à part entière- mais elle le devenait aussi pour violation de l'article L 611-18 qui, en vertu de l'article 3 du présent texte, devait énumérer ce qui n'était pas brevetable, y compris donc les races animales et les variétés végétales.
Il est nécessaire à l'ordre public et aux bonnes moeurs que l'Etat, qui en est le garant, refuse de publier et supprime d'office les éléments de la description ou les dessins qui y seraient contraires. En revanche, votre rapporteur ne voit pas de raison à ce que cette suppression d'office vise aussi les descriptions entrant dans le champ du non brevetable désormais tracé par l'article L. 611-19, par exemple la description d'une nouvelle race animale pourtant exclue de la brevetabilité. Dans un tel cas, en effet, le brevet ne pourra pas, de toute façon, être accordé puisque l'invention porte sur un objet non brevetable.
Votre rapporteur propose donc de maintenir la référence prévue aux articles L. 611-17 et L. 611-18, qui maintient le droit constant, ces deux articles correspondant désormais au a) de l'ancien article L. 611-17.
Votre commission vous propose d'adopter cet article ainsi modifié.
Article 6 -
Etendue de la protection garantie par le brevet
Le droit exclusif d'exploitation que confère le brevet au titre de l'article L. 611-1 du code de la propriété intellectuelle représente une protection dont l'étendue est déterminée par la teneur des revendications, qui s'interprètent, en vertu de l'article L. 613-2, à l'aide de la description et des dessins accompagnant la demande de brevet.
L'article 6 a pour objet d'insérer, après cet article L. 613-2, quatre articles dans le code afin de préciser l'étendue de la protection par brevet en matière biologique. Ces précisions répondent aux préoccupations d'ordre éthique et économique que soulève spécifiquement la matière biologique, tant en raison de l'universalité de sa structure -les gènes étant communs à l'ensemble du vivant, du végétal jusqu'à l'humain- qu'en raison de sa capacité à se multiplier.
• Le premier article dont le présent
article 6 prévoit l'insertion dans le code est
l'article
L. 613-2-1
, relatif à l'étendue de la protection
par brevet d'une invention impliquant une séquence génique. Il
précise que la portée d'une revendication couvrant une
séquence génique
« est limitée à la
partie de cette séquence directement liée à la fonction
spécifique concrètement exposée dans la
description »
. Ceci vise à cantonner la protection
apportée par le brevet au couple séquence génique
(éventuellement partielle)/ fonction associée.
Le point 3 de l'article 5 de la directive communautaire se trouve ainsi transposé dans un article indépendant de celui exclusivement consacré à l'humain -L. 611-18-, ce qui est plus logique que la solution retenue par la directive, qui intègre cette disposition relative au gène dans l'article 5 dédié à l'humain, alors même que le gène est commun à l'ensemble du vivant : le point 3 de l'article 5 de la directive -comme son considérant 22- exige l'exposé concret de « l'application industrielle d'une séquence ou d'une séquence partielle de gène » dans la demande de brevet. Cette exigence de description est reprise dans le texte national et même précisée, puisque la description en vient à déterminer l'étendue du brevet, comme le font les revendications dont la description est le support. En effet, le droit commun des brevets, notamment l'article L. 612-6 du code de la propriété intellectuelle, prévoit que les revendications définissent l'objet de la protection demandée et qu'elles doivent être claires et concises et se fonder sur la description.
Ainsi, le texte national limite l'étendue de la protection conférée par le brevet à la seule partie de la séquence génique qui code pour la protéine assurant la fonction spécifique concrètement décrite.
La loi n° 2004-800 du 6 août 2004 relative à la bioéthique a déjà procédé, aux termes du III du A de son article 17, à l'insertion de ce nouvel article L. 613-2-1 dans le code, en des termes identiques.
Elle a toutefois complété cet article en l'enrichissant d'une deuxième phrase, qui tire explicitement les conséquences de la première et affine encore la lecture de la directive communautaire s'agissant de l'exercice des droits que le brevet confère à son titulaire. En effet, le deuxième alinéa de l'article L. 613-2-1 interdit d'invoquer l'existence d'un brevet incluant une séquence génique « à l'encontre d'une revendication ultérieure portant sur la même séquence si cette revendication satisfait elle-même aux conditions de l'article L. 611-18 et qu'elle expose une autre application particulière de cette séquence. »
Cet ajout confirme que le brevet ne protège pas la séquence génique « en tant que telle » mais bien le binôme qu'elle forme avec l'application précisément identifiée. Il lève ainsi l'ambiguïté que certains avaient pu dénoncer entre les points 1 et 2 de l'article 5 de la directive, le premier assurant que la séquence génique ne peut constituer une invention brevetable, le deuxième prévoyant qu'une séquence génique « isolée » quoique identique peut constituer une invention brevetable.
La biologie moléculaire s'est construite sur un « postulat » fondateur qui associait chaque gène à une protéine et à une fonction unique, dont on sait désormais qu'il est souvent abusivement simplificateur. L'état de la science ne permet pas d'ignorer que plusieurs fonctions peuvent être assurées par une même séquence génique ou une même portion de séquence, l'expression d'une séquence génique étant conditionnée par une multitude de facteurs, et notamment par l'environnement cellulaire dans lequel elle est insérée, par les réseaux de protéines, par les mécanismes de régulation... Alors que la directive semble encore admettre ce dogme en assimilant implicitement, en son article 9, « information génétique » et séquence génique, l'article L. 613-2-1 rédigé par la loi bioéthique prend acte de cette évolution scientifique : afin d'éviter de paralyser l'accès à une séquence génique sous prétexte que celle-ci et l'une de ses fonctions ont fait l'objet d'un brevet, il nie toute dépendance entre deux brevets impliquant la même séquence génique mais exposant des applications distinctes de cette séquence.
Il se démarque ainsi des jurisprudences consacrant un « droit de suite », droit qui peut se justifier en chimie lorsque la synthèse d'une molécule (à laquelle est associée une fonction) a déjà représenté un investissement financier considérable et mérite la protection du brevet. En revanche, pour le vivant, ce droit de suite ne semble pas justifié au plan économique.
En limitant les effets pervers du brevet -possibilité de dérive vers une paralysie de la recherche-, ce dispositif renforce finalement la contribution du brevet à la promotion de l'innovation. Comme le souligne le Conseil d'analyse économique dans son rapport « Propriété industrielle » d'octobre 2002 50 ( * ) , la brevetabilité du vivant peut être analysée en termes d'efficacité : si un brevet sur un gène récompense une innovation amont, il peut aussi bloquer le processus de recherche aval. Toute protection de la propriété intellectuelle implique la privatisation d'une connaissance faisant partie du patrimoine commun de l'humanité : son opportunité doit donc être évaluée par l'analyse des coûts et bénéfices qu'elle engendre.
Le considérant 25 de la directive prévoit que, « pour l'interprétation des droits conférés par un brevet, lorsque des séquences se chevauchent seulement dans les parties qui ne sont pas essentielles à l'invention, le droit des brevets considère chacune d'elles comme une séquence autonome. » Il précise ainsi qu'une même portion de séquence génique -se situant « à cheval » entre deux séquences géniques brevetées- peut faire l'objet de plusieurs brevets si elle appartient à des séquences géniques associées à des fonctions spécifiques et donc à des « inventions » différentes ; il ne dit pas toutefois que cette même partie de séquence génique peut faire l'objet de brevets distincts correspondant à ses différentes applications sans que ces brevets puissent être considérés comme dépendants les uns des autres. C'est cette lacune que tend à combler le deuxième paragraphe de l'article L. 613-2-1 inséré par la loi bioéthique.
Il s'agit ici d'une garantie forte contre la monopolisation de la connaissance du vivant. Son adoption a permis au Ministre de la santé, de la famille et des personnes handicapées, M. Jean-François Mattei, d'affirmer 51 ( * ) que cette disposition interdirait désormais la répétition d'une affaire comme celle du laboratoire américain Myriad Genetics qui s'est approprié la séquence génique prédisposant au cancer du sein chez la femme et a revendiqué l'exclusivité de toutes les analyses de dépistage de la planète à partir de la méthode qu'il avait mise au point 52 ( * ) .
Selon les propres mots de M. Jean-François Mattei devant le Sénat, « s'agissant de la biotechnologie, si on ne peut pas breveter le « bio », on peut breveter la technologie. Je propose que l'on brevette une méthode, y compris lorsqu'elle inclut un gène, pour autant que ce gène demeure accessible à qui veut y accéder pour mettre au point une autre méthode plus compétitive, plus efficace, et que le brevet de méthode ne permette pas l'appropriation du gène. »
La loi bioéthique ayant donc introduit d'ores et déjà l'article L. 613-2-1 enrichi de dispositions apportant des garanties importantes quant au maintien de l'accès au vivant sous brevet, votre rapporteur propose un amendement de conséquence supprimant, dans le présent texte, l'insertion prévue dans le code de ce même article.
Les trois autres articles que le présent article 6 prévoit d'insérer dans le code n'ont pas été, pour leur part, introduits par la loi bioéthique. Ils transposent des dispositions novatrices de la directive qui répondent aux caractéristiques de la matière biologique, réplicable et susceptible de mutations. Alors que la Convention de Munich sur le brevet européen se limitait aux questions de délivrance des titres, la directive 98/44/CE traite les questions relatives aux droits conférés par ces titres en matière biotechnologique.
•
L'article L. 613-2-2
transpose l'article 9 de la directive communautaire, qui prévoit que la
protection conférée par un brevet à un produit contenant
ou consistant en une information génétique
« s'étend à toute matière, sous
réserve de l'article 5, paragraphe 1, dans laquelle le produit est
incorporé et dans laquelle l'information génétique est
contenue et exerce sa fonction »
53
(
*
)
. Le présent projet de loi reprend ces
termes de la directive, à deux nuances près :
- d'une part, il caractérise plus précisément la matière bénéficiant de l'extension de la protection du brevet : dans cette matière, l'information génétique doit être contenue et exercer sa fonction ou alors, ce qui représente un ajout par rapport à la directive, procurer son résultat technique. L'objet de cet ajout n'apparaît pas clairement à votre rapporteur : que signifie, pour une information génétique, « procurer son résultat technique » sinon, par le biais de l'exercice de la fonction correspondante, déboucher sur une application industrielle ? C'est pourquoi il en proposera la suppression par amendement ; un autre amendement tend par ailleurs à préciser que la fonction que doit exercer le gène dans la matière protégée est celle indiquée dans la demande de brevet et non une autre. Il n'est en effet pas possible de laisser subsister une rédaction qui laisserait penser qu'à chaque gène correspond une et une seule fonction ;
- d'autre part, il soumet cette extension de protection par brevet aux dispositions de l'article L. 613-2-1, qui circonscrit la portée d'une revendication couvrant une séquence génique, alors que la directive soumet cette extension aux dispositions de son article 5, paragraphe 1, qui consacre la non brevetabilité du corps humain et de la découverte de ses éléments -y compris les gènes- et dont la transposition a été effectuée à l'article L. 611-18 par la loi bioéthique et complétée à l'article L. 613-2-1.
Pour une meilleure conformité du texte national à la directive, votre rapporteur propose un amendement qui complète la référence prévue à l'article L. 613-2-1 par une référence à l'article L. 611-18, ces deux articles pouvant conjointement se lire comme la transposition du point 1 de l'article 5 de la directive : tout détenteur de brevet sur une séquence génique humaine se trouve ainsi empêché d'interdire l'exploitation commerciale de toute matière incorporant une portion de cette séquence génique si elle n'y exerce pas sa fonction brevetée.
•
L'article L. 613-2-3
transpose, quant à lui, l'article 8 de la directive communautaire, qui
prévoit que la protection s'étend aux descendants directs de la
matière ou du procédé biologique brevetés.
Le point 1 de l'article 8 de la directive est fidèlement transposé par le premier alinéa de cet article L. 613-2-3 : il étend la protection conférée par un brevet relatif à une matière biologique dotée de propriétés déterminées à toute matière obtenue à partir de la première par multiplication ou reproduction et dotée de ces mêmes propriétés.
Ainsi, la protection ne se limite pas à la première génération mais s'étend à toute matière biologique obtenue à partir de cette première génération. Dans la mesure où le propre de la matière biologique est d'être reproductible ou de se reproduire elle-même, il apparaît indispensable de prévoir une protection pour les descendants, au risque sinon de vider de son sens la protection initiale, particulièrement dans les cas où le cycle de reproduction est très court (ce qui est notamment le cas pour nombre de végétaux).
A ce sujet, votre rapporteur relève la difficulté que pourrait soulever le contrôle de ces dispositions. La reproduction végétale mais aussi, voire surtout animale, est susceptible d'échapper à la maîtrise de l'homme. Ainsi, la dissémination naturelle -vent, pollinisations croisées...- ne peut être écartée : faut-il alors invoquer une contrefaçon involontaire ? L'affaire Percy Schmeiser/ Monsanto 54 ( * ) au Canada permet d'entrapercevoir les conséquences considérables que de tels litiges ont pu entraîner outre-Atlantique.
Sur ce point, l'article L. 615-1 du code de la propriété intellectuelle apporte une réponse claire : « l'offre, la mise dans le commerce, l'utilisation, la détention en vue de l'utilisation ou la mise dans le commerce d'un produit contrefait, lorsque ces faits sont commis par une autre personne que le fabricant du produit contrefait, n'engagent la responsabilité de leur auteur que si les faits ont été commis en connaissance de cause. »
Cet article permet d'éviter de qualifier de contrefaçon la dissémination accidentelle de végétaux ou animaux brevetés.
A l'instar du deuxième alinéa de l'article 8 de la directive communautaire, le deuxième alinéa de l'article L. 613-2-3 concerne la protection des inventions de procédés permettant de produire une matière biologique dotée de propriétés déterminées. Bâti sur le même schéma que le premier alinéa, il étend la protection conférée à un tel procédé à la matière biologique directement obtenue par ce procédé et à ses générations successives.
Le dispositif mis en place par l'article L. 613-2-3 applique aux inventions biotechnologiques le droit commun des brevets, qui figure à l'article L. 613-2 du code de la propriété intellectuelle et qui admet que le produit obtenu directement par un procédé breveté est lui-même couvert par le brevet
• Le troisième article dont le
présent article 6 prévoit l'insertion dans le code de la
propriété intellectuelle est
l'article
L. 613-2-4.
L'extension de la protection conférée par brevet qu'opèrent les articles L. 613-2-2 (pour les produits incorporant une information génétique protégée) et L. 613-2-3 (pour les générations successives de matières biologiques protégées ou produites par un procédé protégé) se trouve spécifiquement limitée par l'article L. 613-2-4. Cet article prévoit en effet un régime particulier pour l'espace géographique représenté par la Communauté européenne et par l'Espace économique européen (EEE).
Conformément à l'article 10 de la directive qu'il transpose tout en élargissant le champ d'application de cette dérogation à l'EEE, cet article dispose que la protection du brevet ne peut être étendue à une matière biologique reproduite à partir d'une matière protégée et commercialisée sur le territoire européen en accord avec le titulaire du brevet si cette reproduction de la matière résulte nécessairement de l'utilisation à laquelle est destinée sa commercialisation et si la matière obtenue ne sert pas à en reproduire encore.
Comme le suggère le député Alain Claeys 55 ( * ) , la situation visée pourrait être « par exemple celle d'une levure ou d'une bactérie dépolluante qui se multiplie au fur et à mesure où elle remplit son office. »
Cet article permet donc une certaine tolérance à l'égard des reproductions non maîtrisées de la matière biologique brevetée dans l'environnement géographique de la première mise sur le marché de cette matière. L'extension à l'EEE de cette disposition, prévue dans la directive pour s'appliquer seulement au sein de la Communauté européenne, s'impose pourtant en vertu d'un accord de 1994 liant l'Espace économique européen, l'Union européenne, et les Etats membres. Les informations recueillies par votre rapporteur ne lui permettent pas de s'expliquer l'omission, dans la directive, de l'extension à l'EEE. Cette omission ne saurait en tout cas être reproduite en droit national. Il est à noter, d'ailleurs, que toutes les dispositions du code de la propriété intellectuelle relatives à l'épuisement des droits sont étendues à l'Espace économique européen.
Votre commission vous propose d'adopter cet article ainsi modifié.
Article 7 -
Dérogations à la protection garantie par le
brevet : privilèges de l'agriculteur et de l'éleveur
Cet article a pour objet d'insérer dans le code deux articles prévoyant des dérogations spécifiques à l'égard de la protection conférée par le brevet en matière biotechnologique : les articles L. 613-5-1 et L. 613-5-2. Ces deux articles se présentent de manière symétrique, l'un étant relatif au végétal, l'autre à l'animal, et transposent quasiment mot pour mot les deux alinéas de l'article 11 de la directive communautaire.
L'article L. 613-5-1 autorise tout agriculteur ayant légalement acquis du matériel de reproduction végétal, protégé par un brevet, à des fins d'exploitation agricole à utiliser le produit de sa récolte pour la reproduction par lui-même sur son exploitation. Ceci consacre donc ce que les traditions du monde agricole désignent sous l'expression de « privilège de l'agriculteur », privilège qui permet à l'agriculteur ayant acquis des semences à utiliser les semences issues de la mise en culture des premières, dites « semences de ferme », aux seules fins de sa propre exploitation agricole.
Le privilège de l'agriculteur ici introduit concerne les végétaux génétiquement modifiés et brevetés, mais les modalités de l'exercice de ce privilège correspondent, aux termes de la directive comme du texte de transposition, à celles prévues à l'article 14 du règlement (CE) n°2100/94 56 ( * ) , qui organise une dérogation identique à l'égard de la protection communautaire des obtentions végétales. Cet article 14 autorise en effet les agriculteurs « à utiliser, à des fins de multiplication en plein air dans leur propre exploitation, le produit de la récolte obtenu par la mise en culture, dans leur propre exploitation, de matériel de multiplication d'une variété bénéficiant d'une protection communautaire des obtentions végétales autre qu'une variété hybride ou synthétique » .
Le point 3 de l'article 14 du règlement communautaire cité fixe les modalités d'application de cette dérogation et prévoit, notamment, d'exonérer les « petits » agriculteurs -définis dans le texte en fonction de la surface cultivée 57 ( * ) - de payer une rémunération au titulaire du certificat d'obtention végétale pour bénéficier de ce privilège de l'agriculteur. Les « gros » agriculteurs, en revanche, ne peuvent jouir du privilège de l'agriculteur que moyennant une redevance.
Ce point délicat, qui aurait conduit de grandes exploitations agricoles à devoir payer pour utiliser les semences de ferme, n'a jamais été introduit en droit national. Il n'existe qu'en droit communautaire, dans le règlement (CE) 2100/94 précité.
En effet, la France n'a pas adhéré à la révision de la convention de l'Union pour la protection des obtentions végétales (UPOV) 58 ( * ) intervenue en 1991 et qui introduisait précisément le privilège de l'agriculteur dans des conditions qu'a reprises, en droit communautaire, le règlement (CE) 2100/94 59 ( * ) .
Votre rapporteur relève que le présent article procède donc à l'introduction du privilège de l'agriculteur dans le droit des brevets sur la matière biologique, alors même que ce privilège n'a pas été introduit en droit français des obtentions végétales et que la France n'a pas encore pris les moyens d'organiser la mise en oeuvre de ce privilège.
Il encourage le Gouvernement à inscrire à l'ordre du jour le projet de loi n° 145 déposé en décembre 1996 sur le bureau du Sénat, qui vise justement à introduire l'exception de l'agriculteur en droit national en modifiant le code de la propriété intellectuelle et le code rural. Ceci permettrait de régulariser la situation française et de mettre à jour son droit des obtentions végétales 60 ( * ) . L'image de la France à l'UPOV, organisation dans laquelle elle continue à tenir un rôle majeur et qu'elle a portée sur les fonds baptismaux par l'accord de Paris en 1961 pour tenir tête aux Américains dont le droit des brevets sur les plantes remonte aux années 1930, s'en trouverait crédibilisée.
Alors même que le présent texte offre les moyens d'une protection efficace par brevets des végétaux, il apparaît urgent de conforter la protection par COV des variétés si l'on veut assurer la coexistence équilibrée du système européen sui generis de protection des obtentions végétales, auquel les agriculteurs et sélectionneurs européens sont légitimement attachés et qui a fait la preuve de son efficacité, et du système des brevets, hérité du monde industriel et promu prioritairement par les Etats-Unis 61 ( * ) .
Si l'article 27b) des accords ADPIC autorise aujourd'hui la protection des obtentions végétales « par des brevets, par un système sui generis efficace ou par une combinaison de ces deux moyens », il n'est pas à l'abri d'une renégociation qui reviendrait sur cet équilibre, et pourrait faire prévaloir le brevet si le COV n'était pas soutenu et défendu par ses principaux artisans, au premier rang desquelles la France.
L'article L. 613-5-2 , pour sa part, crée une exception analogue pour l'éleveur mais accompagne, « le cas échéant » , du paiement d'une rémunération l'autorisation donnée à l'agriculteur d'utiliser le bétail protégé pour un usage agricole, c'est-à-dire d'en disposer « pour la poursuite de son activité agricole » mais non pour « la vente dans le cadre d'une activité commerciale d'exploitation » . Les modalités de mise en oeuvre de cette dérogation relative à l'animal sont renvoyées par le point 3 de l'article 11 de la directive communautaire aux « lois, dispositions réglementaires et pratiques nationales » , ce qui révèle l'absence de système communautaire harmonisé de protection des obtentions animales alors qu'un tel système devrait, en toute logique, être établi de manière symétrique par rapport au système existant de protection des obtentions végétales. Selon les informations recueillies par votre rapporteur, un projet de loi visant à l'instauration d'un tel système pour l'animal serait en voie d'être proposé par le ministère de l'agriculture français.
Puisque n'existe, en matière animale, aucun accord international équivalent à la convention de l'Union pour la protection des obtentions végétales (UPOV), l'entrée de l'animal dans le champ du brevet risque d'attirer vers le brevet la protection juridique de nombreuses populations animales améliorées, ce qui « détournerait » au profit des titulaires de brevet des efforts séculaires de sélection et d'amélioration génétique classique. Comme le soulignait M. Alain Weil 62 ( * ) , lors de son audition par votre rapporteur, l'accès universel à la variabilité génétique animale ne serait alors plus garanti.
Votre rapporteur regrette en outre le flou qui persiste à entourer la définition juridique des termes « animal d'élevage », « bétail » ou « race animale ». Cette imprécision contribue à fragiliser l'édifice juridique s'appuyant sur ces concepts.
Outre l'exception de l'agriculteur et celle de l'éleveur, votre rapporteur propose d'apporter une troisième exception au droit du détenteur de brevet par le biais d'un nouvel article L. 613-5-3.
De même qu'est introduit dans le droit des brevets l'exception de l'agriculteur, il convient d'envisager l'introduction en droit des brevets de l'exception du sélectionneur. Celle-ci permet d'utiliser librement les variétés végétales protégées par un titre de propriété intellectuelle afin de créer, découvrir ou développer de nouvelles variétés.
Votre rapporteur estime fondamental d'assurer une symétrie sur ce point entre les deux systèmes de protection de la propriété intellectuelle en matière végétale que sont les brevets et les certificats d'obtention végétale : il y va de la place du modèle juridique européen mais aussi de l'indépendance économique, voire alimentaire, de notre continent.
Comme l'y autorise l'article 30 63 ( * ) des accords ADPIC, le droit européen des brevets organise une dérogation par rapport à la protection du brevet, mais cette dérogation vise exclusivement les actes accomplis à titre expérimental. On retrouve cette disposition appelée "exemption de recherche" en droit national : l'article L. 613-5 du code de la propriété intellectuelle prévoit que « les droits conférés par le brevet ne s'étendent pas aux actes accomplis à titre expérimental qui portent sur l'objet de l'invention brevetée ». Cette dérogation permet ainsi d'utiliser à des fins de recherche l'invention brevetée.
Le droit des obtentions végétales organise également une dérogation similaire par rapport à la protection apportée par le certificat d'obtention végétale. Cette dérogation figure dans la convention UPOV, dont l'article 15 dispose que « le droit d'obtenteur ne s'étend pas aux actes accomplis à titre expérimental ». Toutefois, la dérogation organisée par la Convention UPOV va plus loin : elle permet d'effectuer librement des actes à titre expérimental mais aussi, comme le précise la suite de l'article 15, d'accomplir librement « des actes aux fins de la création de nouvelles variétés ».
Cette dérogation a d'ailleurs été transcrite en droit communautaire par le règlement (CE) 2100/94 déjà évoqué, dont l'article 15 dispose que « la protection communautaire des obtentions végétales ne s'étend pas (...) aux actes accomplis à titre expérimental et aux actes accomplis en vue de créer ou de découvrir et de développer d'autres variétés » végétales. Elle figure également en droit national au deuxième alinéa de l'article L. 623-25 du code qui dispose que 64 ( * ) « ne constitue pas une atteinte aux droits du titulaire d'un certificat d'obtention l'utilisation de la variété protégée comme source de variation initiale en vue d'obtenir une variété nouvelle. »
En droit des brevets, la portée de l'exemption de recherche reste incertaine, et la jurisprudence a pu l'interpréter plus ou moins strictement selon la frontière tracée entre recherche académique et recherche à finalité commerciale. Quand bien même son interprétation serait large, il semble admis que l'exemption de recherche ne saurait inclure le « développement » de nouvelles variétés, action considérée comme pré-commerciale, mais pourtant incluse dans l'exemption du sélectionneur instaurée par le droit de la protection des obtentions végétales.
Or, lorsqu'une variété végétale est protégée par un certificat d'obtention végétale -du fait qu'elle est distincte, homogène et stable-, elle peut également bénéficier d'une protection par brevet si elle incorpore un gène servant de support à une invention -qui a été brevetée en raison de sa nouveauté, de son caractère inventif, et de son applicabilité industrielle-. Une seule et même variété végétale peut ainsi faire l'objet de deux titres de propriété intellectuelle distincts, attribués sur le fondement de critères différents.
Chacun des deux droits de propriété intellectuelle doit pouvoir s'exercer pleinement sur une telle variété transgénique. Notamment, il est important que le travail du sélectionneur à partir de cette variété puisse s'effectuer aussi librement qu'à partir de n'importe quelle autre variété, comme le prévoit la convention protégeant les obtentions végétales. Il ne serait pas admissible que, du fait que la variété est parallèlement couverte par un brevet, le sélectionneur soit tenu de solliciter une licence du détenteur de brevet pour faire son travail de création variétale et de développement de nouvelles variétés. Il serait également choquant qu'un sélectionneur ayant utilisé une plante incluant un gène breveté et ayant obtenu une variété où ne subsiste aucune trace du gène breveté se voie accusé de contrefaçon.
Certains, notamment issus de la filière semencière française, ont fait part à votre rapporteur de leur inquiétude sur ce point, craignant que la protection du brevet puisse empêcher l'exercice du privilège du sélectionneur.
Cette crainte mérite d'être prise en compte avec attention : en effet, si elle était avérée, cela signifierait que les semenciers européens se trouveraient dans l'obligation de négocier des licences auprès des titulaires de brevets couvrant des variétés végétales, et ce, dès l'amont du processus de sélection, donc avant même d'avoir pu obtenir une variété nouvelle digne d'intérêt. Certaines des personnes auditionnées par votre rapporteur ont pu rapprocher cette situation de l'affrontement entre David et Goliath.
Or la plupart des grandes firmes agrochimistes américaines ont profité de l'ouverture du système européen de protection des obtentions végétales : accédant librement aux variétés protégées par brevet, elles ont ainsi pu insérer des gènes -d'intérêt inégal, d'ailleurs- dans ces variétés pour les mettre sous la protection du brevet. Détenant aujourd'hui une grande quantité de brevets protégeant des variétés, ces firmes seraient en mesure, selon le droit des brevets et, du fait de la portée incertaine mais, en tout état de cause, limitée de l'exemption de recherche, d'exiger des sélectionneurs qu'ils sollicitent une licence pour être autorisés, moyennant redevance, à effectuer leur travail de sélection.
Le caractère déséquilibré d'un tel scénario est patent. Il reviendrait à faire primer la protection conférée par le brevet sur la protection conférée par le droit d'obtention végétale.
Afin de lever les légitimes inquiétudes des semenciers européens, dont les résultats financiers sont déjà incommensurables par rapport à leurs concurrents américains, et pour assurer que les droits conférés par le brevet n'empêcheront pas d'exercer les droits attachés au certificat d'obtention végétale, votre commission propose d'insérer une exemption du sélectionneur dans le droit des brevets relatifs aux inventions végétales.
Il s'agit d'une mesure favorisant une coexistence équilibrée entre le brevet et le certificat d'obtention végétale et évitant une interférence injustifiée entre ces deux droits. Elle permettrait aussi un rapport de force plus équilibré entre les semenciers européens et les firmes américaines en déplaçant vers l'aval la négociation des licences -que les semenciers devront encore demander si la variété qu'ils ont obtenue est dépendante du brevet-. En effet, la négociation d'une licence avant la commercialisation d'une variété mettra en relation un détenteur de brevet et un obtenteur qui aura achevé son travail de sélection et présentera au détenteur de brevet une variété nouvelle susceptible de l'intéresser à l'affaire.
Votre rapporteur insiste sur le fait que l'introduction de l'exception du sélectionneur préserve totalement le droit qui s'attache au brevet comme au COV pour ce qui est de la commercialisation : comme pour les variétés essentiellement dérivées 65 ( * ) , la commercialisation d'une variété couverte par les revendications ou contenant un élément breveté nécessite l'accord du détenteur du droit de propriété intellectuelle et ne peut se faire que moyennant le paiement d'une redevance.
S'agissant de la compatibilité d'un tel dispositif à l'égard de la directive communautaire, votre rapporteur souligne le silence de la directive sur ce point. Aucune disposition du texte communautaire ne l'interdit 66 ( * ) .
Le considérant 49 de la directive dispose seulement que « le titulaire du brevet peut défendre ses droits (...) contre l'obtenteur qui a développé la variété végétale incorporant l'invention protégée si celui-ci ne respecte pas ses engagements » . Ceci signifie que le titulaire du brevet est en droit d'exiger de l'obtenteur le paiement des redevances qui assortissent naturellement toute licence que l'obtenteur se doit d'avoir pour exploiter commercialement une nouvelle variété incluant toujours le gène breveté qui était déjà présent dans la variété transgénique ayant servi de support initial à son travail de sélection.
Ces dispositions ne sont en aucune façon remises en cause par le dispositif proposé par votre commission.
Votre rapporteur fait aussi observer que les dispositions relatives à l'exploitation des brevets sont d'ordre national, le droit communautaire se portant sur la constitution des droits que confère le brevet et non sur leur exercice.
Votre rapporteur relève enfin que les accords ADPIC ne s'opposent pas non plus à l'introduction d'une telle dérogation dans le droit des brevets, leur article 30 autorisant, on l'a vu, « des exceptions limitées aux droits exclusifs conférés par un brevet, à condition que celles-ci ne portent pas atteinte de manière injustifiée à l'exploitation normale du brevet ni ne causent un préjudice injustifié aux intérêts légitimes du titulaire du brevet, compte tenu des intérêts légitimes des tiers. » Le droit de l'obtenteur ne relève-t-il pas des ces intérêts légitimes dont cet article de l'accord ADPIC invite à tenir compte ?
On peut aussi citer deux autres articles des ADPIC permettant d'autoriser le maintien de l'exception de l'obtenteur : l'article 7, qui prévoit que « la protection et le respect des droits de propriété intellectuelle devraient contribuer à la promotion de l'innovation technologique et au transfert et à la diffusion de la technologie, à l'avantage mutuel de ceux qui génèrent et utilisent des connaissances techniques et d'une manière propice au bien-être social et économique, et à assurer un équilibre de droits et d'obligations » ; l'article 8.2 qui dispose que « des mesures appropriées, à condition qu'elles soient compatibles avec les dispositions du présent accord, pourront être nécessaires afin d'éviter l'usage abusif des droits de propriété intellectuelle par les détenteurs de droits ou leur recours à des pratiques qui restreignent de façon déraisonnable le commerce ou sont préjudiciables au transfert international de technologie ».
La rapidité du progrès dans le domaine du génie génétique laisse entrevoir que, dans un avenir prévisible, de plus en plus de variétés végétales contiendront des inventions brevetées. La conséquence de cette évolution doit-elle être la disparition, ou du moins le très grand affaiblissement, de l'exception en faveur de l'obtenteur, fondement du système européen de protection des variétés végétales, entraînant de fait la régression de l'Europe en matière de semences, la disparition de ses petites et moyennes entreprises de sélection végétale et sa dépendance alimentaire à l'égard des Etats-Unis ?
Votre commission ne le souhaite pas.
Votre rapporteur vous propose d'adopter cet article ainsi modifié.
Article 8 -
Licences obligatoires en cas de dépendance d'une
obtention végétale à l'égard d'un brevet
L'article 8 prévoit d'insérer dans le code, après son article L. 613-15 relatif aux licences de dépendance, un article nouveau, L. 613-15-1 qui rend possible l'octroi de licences obligatoires en cas de dépendance d'une obtention végétale à l'égard d'un brevet.
Cet article transpose très fidèlement les paragraphes 1 et 3 de l'article 12 de la directive communautaire. Il dispose ainsi que peut être demandée, si l'obtention ou l'exploitation d'un droit sur une variété végétale est empêchée par un brevet, la concession d'une licence de ce brevet à deux conditions cumulatives :
- « dans la mesure où cette licence est nécessaire pour l'exploitation de la variété végétale à protéger » ;
- « pour autant que la variété constitue à l'égard de ce brevet un progrès technique important et présente un intérêt économique certain. »
Cet article envisage donc le cas où l'obtention d'un droit sur une variété végétale peut porter atteinte à un brevet antérieur : il s'agit ici d'une variété dont la protection par COV est demandée et qui inclut un gène déjà protégé par brevet. Il est évident que, dans un tel cas classique de dépendance, une licence doit être demandée : en effet, le droit sur une variété permet à son détenteur d'engager l'exploitation commerciale de cette variété, ce qui implique nécessairement d'obtenir une licence du détenteur du brevet couvrant le gène qui est inclus dans la nouvelle variété à protéger. En revanche, cet article ne vise pas le cas où la nouvelle variété pour laquelle est revendiqué le COV n'inclut plus le gène de la variété transgénique à partir de laquelle elle a toutefois été élaborée initialement, ce cas ne nécessitant pas de licence.
Comme la rédaction proposée par le projet de loi laisse croire qu'un brevet est susceptible de faire obstacle à l'obtention d'un droit sur une variété végétale, votre rapporteur propose de l'améliorer. Il est clair, en effet, que l'octroi d'un tel droit ne pourra jamais être conditionné qu'à la satisfaction des trois critères habituels (distinction, homogénéité et stabilité de la variété). Jamais un brevet ne pourrait « faire obstacle » à l'octroi de ce droit.
L'amendement proposé présente une nouvelle formulation, directement inspirée de l'article 12 de la directive communautaire, afin de viser clairement le cas où l'obtention d'un droit sur une variété peut porter atteinte à un brevet antérieur. Ce cas correspond à la demande de protection d'une variété incluant un gène protégé.
De même, et de façon encore plus évidente, l'exploitation d'un droit sur une variété végétale incluant un gène breveté justifie l'octroi d'une licence.
Toutefois, dans les deux cas (obtention d'un droit ou exploitation de celui-ci), le demandeur n'est fondé à demander une licence obligatoire que si la variété à protéger présente, par rapport au brevet, un progrès technique important et un intérêt économique « certain ». A ce propos, un amendement, purement rédactionnel, est proposé par votre rapporteur, afin de tenir compte du fait que le progrès technique et l'intérêt économique ne sauraient s'apprécier entre un titre de propriété, le brevet, et une variété végétale. Ils ne peuvent s'apprécier qu'entre l'invention, protégée par ledit brevet, et cette variété.
La souplesse du terme retenu en droit national - intérêt économique « certain » - pourrait utilement contribuer à faciliter l'octroi de licences obligatoires de dépendance et, ainsi, à éviter un engorgement du fait du nombre de titres de propriété intellectuelle et des chevauchements entre eux. Toutefois que le texte communautaire, directement inspiré des accords ADPIC 67 ( * ) de l'Organisation mondiale du commerce, exige que l'intérêt économique soit « considérable ». Une exacte conformité à la directive impose de rétablir l'adjectif « considérable ». Votre rapporteur vous propose un amendement en ce sens.
Il n'ignore pas que ce souci de fidélité à la directive conduit à restreindre le champ d'octroi des licences obligatoires. En effet, l'amélioration variétale relève rarement d'un « progrès technique important d'un intérêt économique considérable » . C'est pourquoi il plaide à nouveau pour l'introduction de l'exception du sélectionneur qui rendra moins nécessaire le recours aux licences au stade pré-commercial, ceci contrebalançant la plus grande sévérité dans l'octroi de licences obligatoires.
Par ailleurs, la portée pratique du « resserrement » des conditions d'octroi des licences obligatoires pourrait être mineure, dans la mesure où les juristes auditionnés par votre rapporteur lui ont fait part de la grande rareté du recours aux licences obligatoires.
Le deuxième alinéa de l'article L. 613-15-1 prévoit que, dans le cas où une telle licence est accordée, le titulaire du brevet est en droit d'obtenir lui aussi du tribunal, « à des conditions équitables » -que la directive préfère qualifier de « raisonnables » -, la concession d'une licence réciproque pour utiliser la variété protégée : ainsi, des licences croisées doivent permettre de rendre harmonieuse la coexistence des deux systèmes concurrents de protection végétale que constitueront désormais le brevet et le certificat d'obtention végétale (COV) et de fluidifier l'exploitation des innovations soumises à des régimes différents de protection de la propriété intellectuelle.
Enfin, le dernier alinéa de l'article confirme que restent applicables aux cas de dépendance entre brevet et COV les dispositions classiques en matière de licences obligatoires, contenues aux articles L. 613-12 (qui impose notamment de prouver l'impossibilité d'obtenir préalablement du détenteur du brevet une licence contractuelle et qui prévoit que la licence obligatoire donne lieu à redevances), L. 613-13 (caractère non exclusif de la licence obligatoire), et L. 613-14 (retrait de licence en cas de violation des conditions de son octroi).
Votre rapporteur vous propose d'adopter cet article ainsi modifié.
Article 9 -
Licences obligatoires en cas de dépendance d'un
brevet à l'égard d'une obtention végétale
L'article 9 se présente comme le pendant de l'article 8 : il vise à traiter le cas inverse, c'est-à-dire celui de la dépendance d'un brevet à l'égard d'une obtention végétale.
Il prévoit d'insérer deux articles L. 623-22-1 et L. 623-22-2 après l'article L. 623-22 du code de la propriété intellectuelle, lequel se situe dans le chapitre III (« Obtention végétale ») du titre II (« Protection des connaissances techniques ») du livre VI du code, livre dont le titre Ier est consacré aux brevets d'invention.
• L'article L. 623-22-1
dispose, quasi symétriquement à l'article L. 613-15-1, que
le titulaire d'un brevet portant sur une invention biotechnologique peut
demander, si l'exploitation de son invention est empêchée par un
droit d'obtention végétale, la concession d'une licence pour
l'exploitation de la variété protégée par le droit
d'obtention à deux conditions cumulatives :
- « dans la mesure où cette licence est nécessaire à l'exploitation du brevet » ;
- « pour autant que cette invention constitue à l'égard de la variété végétale un progrès technique important et présente un intérêt économique certain. »
Il s'agit d'un amendement rédactionnel, visant à rendre symétrique et conforme à la directive la rédaction des dispositions relatives aux cas de dépendance d'un droit d'obtention végétal à l'égard d'un brevet et celles relatives aux cas de dépendance inverses
La rédaction de l'article L. 623-22-1 apparaît quelque peu tautologique : « lorsqu'un droit d'obtention végétale fait obstacle à l'exploitation d'un brevet », une licence peut être concédée « dans la mesure où cette licence est nécessaire à l'exploitation du brevet ». Autant cette condition se justifiait à l'article précédent, qui envisageait non seulement le cas où l'exploitation d'un droit sur une variété, mais également celui où l'obtention d'un tel droit, portait atteinte à un brevet antérieur, autant elle paraît ici redondante : il n'est pas nécessaire d'exiger que la licence demandée au titulaire du droit d'obtention végétale soit nécessaire à l'exploitation du brevet puisque le cas visé est justement celui où un droit d'obtention végétale fait obstacle à l'exploitation d'un brevet.
C'est la raison pour laquelle le point 2 de l'article 12 de la directive que le présent article 9 vise à transposer ne pose pas, lui, comme condition d'octroi d'une licence pour l'exploitation d'une variété protégée par un droit d'obtention, le fait que cette licence soit nécessaire pour l'exploitation du brevet. Votre rapporteur vous propose donc un amendement de clarification, supprimant la partie redondante de cette première phrase du premier alinéa de l'article L. 623-22-1, ce qui assure d'ailleurs une transposition plus fidèle de la directive communautaire.
Un deuxième amendement vise par ailleurs à substituer à nouveau l'adjectif « considérable » à l'adjectif « certain » afin d'éviter que le texte national ne s'écarte de la directive.
La dernière phrase de l'article L. 623-22-1 et l'article L. 623-22-2 ont pour objet d'expliciter, dans ce chapitre du code consacré aux obtentions végétales, le fait que s'appliquent à ces licences obligatoires concédées par rapport à un droit d'obtention végétale des dispositions identiques à celles que le code, dans le chapitre consacré aux brevets d'invention, prévoit déjà aux articles L. 613-12 à L. 613-14 et que l'article L. 613-15-1 rend d'ailleurs applicables au cas inverse traité à l'article 8 du présent texte.
En effet, ces dispositions contenues aux points 2, 3 et 4 de l'article 12 de la directive doivent être expressément intégrées dans le chapitre du code consacré au droit des obtentions végétales afin de s'y appliquer. Il s'agit de :
- la nécessité, pour le demandeur de la licence obligatoire,de justifier qu'il n'a pu obtenir du titulaire du droit d'obtention une licence d'exploitation et « qu'il est en état d'exploiter la variété de manière effective et sérieuse » (dernière phrase de l'article L. 623-22-1 qui est l'exacte réplique de la deuxième phrase de l'article L 613-12) ;
- la formation de la demande de licence devant le tribunal de grande instance (première phrase de l'article L. 623-22-2 qui est calquée sur la première phrase de l'article L 613-12) ;
- le caractère non exclusif de la licence (première phrase du deuxième alinéa de l'article L. 623-22-2 mais aussi première phrase de l'article L. 613-13) ;
- la détermination par le tribunal des conditions, notamment financières -redevances- de la licence (fin du deuxième alinéa de l'article L. 623-22-2 qui réplique les deux derniers alinéas de l'article L. 613-12) ;
- l'incessibilité de la licence (troisième alinéa de l'article L. 623-22-2, calqué sur la dernière phrase de l'article L. 613-13) ;
- le retrait de la licence si son titulaire ne satisfait pas aux conditions dont elle était assortie (dernière phrase de l'article L. 623-22-2, qui reproduit à l'identique l'article L. 613-14).
Enfin, votre rapporteur relève que le pénultième alinéa de l'article L. 623-22-2 organise, comme l'a fait le nouvel article L. 613-15-1, l'octroi, « à des conditions équitables », d'une licence réciproque au bénéfice du titulaire du droit d'obtention, pour lui permettre d'utiliser l'invention protégée par le brevet.
Ce dispositif complet de licences obligatoires (et réciproques) en cas de dépendance entre brevet et titre d'obtention végétale (ou inversement) doit permettre de faire coexister les deux systèmes de protection de la propriété intellectuelle. Votre rapporteur s'en félicite, convaincu que les deux approches sont complémentaires et qu'il convient de les défendre parallèlement, y compris dans les instances de négociations internationales. L'article 30 de l'accord ADPIC de l'OMC tolère aujourd'hui la possibilité de recourir au brevet ou à tout autre système sui generis de protection de la propriété intellectuelle -ce qui vise la convention UPOV-. Votre rapporteur appelle à la plus grande vigilance à l'heure où une renégociation de cet article 30 pourrait modifier ce précieux équilibre.
Votre rapporteur vous propose d'adopter cet article ainsi modifié.
TITRE
II -
DISPOSITIONS RELATIVES AU RENFORCEMENT
DES LICENCES
OBLIGATOIRES
ET DES LICENCES D'OFFICE
Ce titre se compose de trois articles, les articles 10 à 12, dont deux contiennent des dispositions déjà adoptées en termes identiques par la loi bioéthique.
Article 10 -
Licences obligatoires en cas de dépendance entre
brevets
Cet article et le suivant proposent une nouvelle rédaction de l'article L. 613-15 et de l'article L. 613-16. Or l'article 18 de la loi n°2004-800 du 6 août 2004 relative à la bioéthique a déjà permis l'adoption d'une nouvelle rédaction de ces mêmes articles du code, en des termes identiques à ceux prévus dans le présent texte, complétés par quelques enrichissements.
Il s'agit de renforcer les dispositions relatives aux licences obligatoires « classiques » -en cas de dépendance entre brevets- et aux licences d'office. Ce renforcement n'est pas rendu nécessaire par la transposition de la directive 98/44/CE qu'achèvent les neuf premiers articles du texte. Il résulte de la volonté du gouvernement actuel comme de celle du gouvernement qui a déposé le texte en novembre 2001 : comme le rappelle l'exposé des motifs du présent texte, il a en effet été jugé « nécessaire de renforcer les dispositions relatives aux licences obligatoires et d'office, qui permettent d'écarter les conséquences néfastes des situations de dépendance technologique, de faire prévaloir l'intérêt public, notamment celui de la santé publique, et de corriger un éventuel abus des droits que confère le brevet à son titulaire. Ce renforcement n'est pas nécessaire pour assurer la transposition de la directive mais, d'une part, il n'est nullement incompatible avec la directive et, d'autre part, il assure l'équilibre du dispositif, notamment dans le domaine particulièrement sensible des biotechnologies. »
Les licences obligatoires étaient déjà rendues possibles en droit national par l'article L. 613-15. Elles visent à régler un conflit d'ordre privé entre le titulaire d'un brevet antérieur et celui d'un brevet postérieur dépendant du premier et qui nécessite donc, pour son exploitation, l'accord du titulaire du premier brevet. Elles sont octroyées sur décision judiciaire à la demande du titulaire du brevet postérieur si celui-ci présente « un progrès technique et un intérêt économiques importants ».
L'ancien article L. 613-15 ajoutait une condition supplémentaire, l'existence d'un « intérêt public », dont le contenu était flou et correspondait mal au contexte d'un litige privé. Cette condition, qui ne figure pas dans l'accord ADPIC, a donc été supprimée à l'occasion de l'adoption de la loi bioéthique.
Parallèlement, la condition exigeant que l'invention présente « un progrès technique et un intérêt économiques importants » a fait l'objet d'une nouvelle rédaction, qui est la même que celle retenue par le présent texte pour les licences obligatoires en cas de dépendance entre brevet et COV : l'invention devra désormais constituer « un progrès technique important » et présenter « un intérêt économique certain », ce qui est moins contraignant. C'est pourquoi votre rapporteur, là aussi, propose un amendement visant à rétablir le mot « considérable » en lieu et place du mot « certain » dans le texte de l'article L. 613-15 issu de la loi bioéthique.
De même, l'octroi d'une licence obligatoire était jusqu'alors subordonnée à l'écoulement d'un certain délai ; cette condition, qui ne se justifiait pas, a également été supprimée.
Enfin, la nouvelle version de l'article L. 613-15 substitue la notion de brevet dépendant, plus large, à celle de brevet de perfectionnement, ce qui est conforme à l'article 31 de l'accord ADPIC.
A l'issue de la navette parlementaire intervenue lors de l'examen de la loi bioéthique, la nouvelle rédaction de l'article L. 613-15 se trouve donc exactement celle que proposait le présent article 10, à une nuance près : elle a été enrichie d'un paragraphe, devenu le premier, qui confirme la nécessité d'une autorisation réciproque des titulaires des brevets postérieur et antérieur pour permettre à l'un comme à l'autre d'exploiter le brevet dépendant. Cette disposition n'est pas nouvelle puisqu'elle figurait au début de l'ancien article L. 613-15 mais sa reprise avait été omise dans le projet gouvernemental. Cette lacune est désormais comblée.
Votre rapporteur propose donc de remplacer le présent article 10 par un article modifiant l'article L. 613-15 issu de la loi bioéthique et rétablissant là aussi le caractère « considérable » de l'intérêt économique exigé pour l'octroi d'une licence obligatoire en cas de dépendance d'un brevet postérieur à l'égard d'un brevet antérieur.
Votre rapporteur vous propose d'adopter cet article ainsi modifié.
Article 11 -
Licences d'office
Les licences d'office sont des actes de la puissance publique : elles permettent de mettre sous licence accordée par l'Etat l'exploitation de brevets lorsque l'intérêt de la défense nationale, l'intérêt de l'économie nationale ou l'intérêt de la santé publique le justifient. Aux termes de l'ancien article L. 613-16, les licences d'office dans l'intérêt public ne pouvaient porter que sur les médicaments. Le rôle des dispositifs médicaux à visée thérapeutique ou diagnostique et des méthodes de diagnostic ex vivo peut pourtant être tout aussi considérable dans l'intérêt de la santé publique.
C'est pourquoi le présent texte prévoyait d'étendre le champ des licences d'office dans l'intérêt de la santé publique, tout en précisant les conditions dans lesquelles elles pouvaient être décidées, afin de respecter le droit de propriété du titulaire du brevet ainsi que les limites posées par l'accord ADPIC aux licences de ce type.
L'article 18 de la loi bioéthique a procédé à une nouvelle rédaction de l'article L. 613-16 en des termes identiques à ceux proposés par le présent article 11. Désormais, le champ des licences d'office dans l'intérêt de la santé publique inclut donc les dispositifs médicaux à visée thérapeutique ou diagnostique et des méthodes de diagnostic ex vivo , ainsi que les procédés et produits nécessaires à l'obtention de ces dispositifs. Les cas dans lesquels une licence d'office peut être octroyée -quantité ou qualité insuffisantes ou prix anormalement élevés- ont également été élargis au cas de l'exploitation dans des conditions contraires à l'intérêt de la santé publique ou constituant des pratiques déclarées anti-concurrentielles 68 ( * ) par une décision administrative ou juridictionnelle, dont le caractère définitif a été fort opportunément exigé par le Parlement lors de l'examen de la loi bioéthique. En effet, l'article 31 de l'accord ADPIC exige que les pratiques anticoncurrentielles -par exemple, abus de position dominante- aient été préalablement reconnues comme telles « à l'issue d'une procédure judiciaire ou administrative ».
Comme le même article 31 exige également, sauf pour les cas de pratiques anti-concurrentielles ou d'urgence, la recherche d'un accord préalable avec le breveté, ceci est précisé au premier alinéa du nouvel article L. 613-16 (qui pose le principe du nécessaire défaut d'accord amiable) et à son dernier alinéa (qui pose l'exception au principe pour les deux cas visés à l'article 31 de l'accord ADPIC).
En raison de cette nouvelle rédaction de l'article L. 613-16 par la loi bioéthique, le présent article 11 n'a plus lieu d'être en l'état.
Toutefois, la nouvelle rédaction de l'article L. 613-16 issue de la loi bioéthique a malencontreusement rendu cumulatives deux conditions qui étaient alternatives dans le code, et qui sont également alternatives dans le présent projet de loi et dans les accords ADPIC de l'Organisation mondiale du commerce.
Ainsi, les licences d'office doivent pouvoir être prises dans l'intérêt de la santé publique, soit si la quantité des produits ou procédés visés est insuffisante, soit si leur qualité est insuffisante. C'est pourquoi votre rapporteur propose un amendement tendant à remplacer le « et » par un « ou ».
Votre rapporteur vous propose d'adopter cet article ainsi modifié.
Article 12 -
Champ territorial d'application de la loi
Cet article final précise le champ d'application du texte de transposition : cette loi s'appliquera en Polynésie française, dans les îles Wallis et Futuna, dans les Terres australes et antarctiques françaises, en Nouvelle-Calédonie et à Mayotte.
Votre rapporteur rappelle que les lois s'appliquent directement dans les quatre départements d'outre-mer en vertu du principe de l'assimilation législative et qu'en revanche l'application d'une loi dans une collectivité d'outre-mer doit être prévue explicitement en vertu du principe de spécialité législative.
Ce n'est donc que sur le territoire de la collectivité d'outre-mer de Saint-Pierre-et-Miquelon que le présent texte ne sera pas applicable, puisqu'il est explicitement prévu par cet article 12 son application dans les quatre autres collectivités d'outre-mer.
Votre rapporteur vous propose d'adopter cet article sans modification.
* * *
Sous le bénéfice des observations qui précèdent et sous réserve de l'adoption des amendements qu'elle vous soumet, la commission des Affaires économiques vous propose d'adopter ce projet de loi ainsi modifié.
ANNEXE
I -
EXTRAIT DE LA LOI N° 2004-800 DU 6 AOÛT 2004
RELATIVE
À LA BIOÉTHIQUE
TITRE IV
PROTECTION JURIDIQUE
DES INVENTIONS
BIOTECHNOLOGIQUES
Article 17
A. - Le code de la propriété intellectuelle est ainsi modifié :
I. - L'article L. 611-17 est ainsi rédigé :
« Art. L. 611-17. - Ne sont pas brevetables les inventions dont l'exploitation commerciale serait contraire à la dignité de la personne humaine, à l'ordre public ou aux bonnes moeurs, cette contrariété ne pouvant résulter du seul fait que cette exploitation est interdite par une disposition législative ou réglementaire. »
II. - Après l'article L. 611-17, sont insérés trois articles L. 611-18, L. 611-19 et L. 611-20 ainsi rédigés :
« Art. L. 611-18. - Le corps humain, aux différents stades de sa constitution et de son développement, ainsi que la simple découverte d'un de ses éléments, y compris la séquence totale ou partielle d'un gène, ne peuvent constituer des inventions brevetables.
« Seule une invention constituant l'application technique d'une fonction d'un élément du corps humain peut être protégée par brevet. Cette protection ne couvre l'élément du corps humain que dans la mesure nécessaire à la réalisation et à l'exploitation de cette application particulière. Celle-ci doit être concrètement et précisément exposée dans la demande de brevet.
« Ne sont notamment pas brevetables :
« a) Les procédés de clonage des êtres humains ;
« b) Les procédés de modification de l'identité génétique de l'être humain ;
« c) Les utilisations d'embryons humains à des fins industrielles ou commerciales ;
« d) Les séquences totales ou partielles d'un gène prises en tant que telles.
« Art. L. 611-19. - Les races animales ainsi que les procédés essentiellement biologiques d'obtention de végétaux ou d'animaux ne sont pas brevetables.
« Cette disposition ne s'applique pas aux procédés microbiologiques et aux produits obtenus par ces procédés.
« Art. L. 611-20. - Les obtentions végétales d'un genre ou d'une espèce bénéficiant du régime de protection institué par les dispositions du chapitre III du titre II du présent livre relatives aux obtentions végétales ne sont pas brevetables. »
III. - Après l'article L. 613-2, il est inséré un article L. 613-2-1 ainsi rédigé :
« Art. L. 613-2-1. - La portée d'une revendication couvrant une séquence génique est limitée à la partie de cette séquence directement liée à la fonction spécifique concrètement exposée dans la description.
« Les droits créés par la délivrance d'un brevet incluant une séquence génique ne peuvent être invoqués à l'encontre d'une revendication ultérieure portant sur la même séquence si cette revendication satisfait elle-même aux conditions de l'article L. 611-18 et qu'elle expose une autre application particulière de cette séquence. »
IV. - Dans le cinquième alinéa (4°) de l'article L. 612-12, les mots : « de l'article L. 611-17 » sont remplacés par les mots : « des articles L. 611-17 à L. 611-20 » et, dans le dernier alinéa du même article, les mots : « du a de l'article L. 611-17 » sont remplacés par les mots : « des articles L. 611-17 et L. 611-18 ».
B. - Le Gouvernement transmet au Parlement, dans un délai de trois ans à compter de la publication de la présente loi, un rapport d'évaluation des conséquences juridiques, économiques, éthiques et de santé publique de l'application du présent article.
Article 18
Les articles L. 613-15 et L. 613-16 du code de la propriété intellectuelle sont ainsi rédigés :
« Art. L. 613-15. - Le titulaire d'un brevet portant atteinte à un brevet antérieur ne peut exploiter son brevet sans l'autorisation du titulaire du brevet antérieur ; ledit titulaire ne peut exploiter le brevet postérieur sans l'autorisation du titulaire du brevet postérieur.
« Lorsque le titulaire d'un brevet ne peut l'exploiter sans porter atteinte à un brevet antérieur dont un tiers est titulaire, le tribunal de grande instance peut lui accorder une licence d'exploitation du brevet antérieur dans la mesure nécessaire à l'exploitation du brevet dont il est titulaire et pour autant que cette invention constitue à l'égard du brevet antérieur un progrès technique important et présente un intérêt économique certain.
« La licence accordée au titulaire du brevet postérieur ne peut être transmise qu'avec ledit brevet.
« Le titulaire du brevet antérieur obtient, sur demande présentée au tribunal, la concession d'une licence réciproque sur le brevet postérieur.
« Les dispositions des articles L. 613-12 à L. 613-14 sont applicables.
« Art. L. 613-16. - Si l'intérêt de la santé publique l'exige et à défaut d'accord amiable avec le titulaire du brevet, le ministre chargé de la propriété industrielle peut, sur la demande du ministre chargé de la santé publique, soumettre par arrêté au régime de la licence d'office, dans les conditions prévues à l'article L. 613-17, tout brevet délivré pour :
« a) Un médicament, un dispositif médical, un dispositif médical de diagnostic in vitro , un produit thérapeutique annexe ;
« b) Leur procédé d'obtention, un produit nécessaire à leur obtention ou un procédé de fabrication d'un tel produit ;
« c) Une méthode de diagnostic ex vivo .
« Les brevets de ces produits, procédés ou méthodes de diagnostic ne peuvent être soumis au régime de la licence d'office dans l'intérêt de la santé publique que lorsque ces produits, ou des produits issus de ces procédés, ou ces méthodes sont mis à la disposition du public en quantité et qualité insuffisantes ou à des prix anormalement élevés, ou lorsque le brevet est exploité dans des conditions contraires à l'intérêt de la santé publique ou constitutives de pratiques déclarées anticoncurrentielles à la suite d'une décision administrative ou juridictionnelle devenue définitive.
« Lorsque la licence a pour but de remédier à une pratique déclarée anticoncurrentielle ou en cas d'urgence, le ministre chargé de la propriété industrielle n'est pas tenu de rechercher un accord amiable. »
ANNEXE
II -
DIRECTIVE 98/44/CE DU PARLEMENT EUROPÉEN ET DU CONSEIL DU 6
JUILLET 1998 RELATIVE À LA PROTECTION JURIDIQUE DES INVENTIONS
BIOTECHNOLOGIQUES
Le Parlement Européen et le Conseil de l'Union européenne
vu le traité instituant la Communauté européenne, et notamment son article 100 A,
vu la proposition de la Commission (1),
vu l'avis du Comité économique et social (2),
statuant conformément à la procédure visée à l'article 189 B du traité (3),
(1) considérant que la biotechnologie et le génie génétique jouent un rôle croissant dans un nombre considérable d'activités industrielles; que la protection des inventions biotechnologiques revêtira certainement une importance essentielle pour le développement industriel de la Communauté ;
(2) considérant que, notamment, dans le domaine du génie génétique, la recherche et le développement exigent une somme considérable d'investissements à haut risque que seule une protection juridique adéquate peut permettre de rentabiliser ;
(3) considérant qu'une protection efficace et harmonisée dans l'ensemble des États membres est essentielle en vue de préserver et d'encourager les investissements dans le domaine de la biotechnologie ;
(4) considérant que, à la suite du rejet par le Parlement européen du projet commun, approuvé par le comité de conciliation, de directive du Parlement européen et du Conseil relative à la protection juridique des inventions biotechnologiques (4), le Parlement européen et le Conseil ont constaté que la protection juridique des inventions biotechnologiques avait besoin d'être clarifiée ;
(5) considérant qu'il existe des divergences, dans le domaine de la protection des inventions biotechnologiques, entre les législations et pratiques des différents États membres; que de telles disparités sont de nature à créer des entraves aux échanges et à faire ainsi obstacle au fonctionnement du marché intérieur ;
(6) considérant que ces divergences risquent de s'accentuer au fur et à mesure que les États membres adopteront de nouvelles lois et pratiques administratives différentes ou que les interprétations jurisprudentielles nationales se développeront diversement ;
(7) considérant qu'une évolution hétérogène des législations nationales relatives à la protection juridique des inventions biotechnologiques dans la Communauté risque de décourager encore plus les échanges commerciaux, au détriment du développement industriel de ces inventions et du bon fonctionnement du marché intérieur ;
(8) considérant que la protection juridique des inventions biotechnologiques ne nécessite pas la création d'un droit particulier se substituant au droit national des brevets; que le droit national des brevets reste la référence essentielle pour la protection juridique des inventions biotechnologiques, étant entendu qu'il doit être adapté ou complété sur certains points spécifiques pour tenir compte de façon adéquate de l'évolution de la technologie faisant usage de matière biologique, mais répondant néanmoins aux conditions de brevetabilité ;
(9) considérant que, dans certains cas, comme celui de l'exclusion de la brevetabilité des variétés végétales et des races animales ainsi que des procédés essentiellement biologiques d'obtention de végétaux ou d'animaux, certaines notions des législations nationales, fondées sur les conventions internationales relatives aux brevets et aux variétés végétales, ont suscité des incertitudes concernant la protection des inventions biotechnologiques et de certaines inventions microbiologiques; que, dans ce domaine, l'harmonisation est nécessaire pour dissiper ces incertitudes ;
(10) considérant qu'il convient de prendre en compte le potentiel de développement des biotechnologies pour l'environnement et en particulier l'utilité de ces technologies pour le développement de méthodes culturales moins polluantes et plus économes des sols; qu'il convient d'encourager, par le système des brevets, la recherche et la mise en oeuvre de tels procédés ;
(11) considérant que le développement des biotechnologies est important pour les pays en voie de développement, tant dans le domaine de la santé et de la lutte contre les grandes épidémies et endémies que dans le domaine de la lutte contre la faim dans le monde; qu'il convient d'encourager de même, par le système des brevets, la recherche dans ces domaines; qu'il convient par ailleurs de promouvoir des mécanismes internationaux assurant la diffusion de ces technologies dans le tiers monde et au profit des populations concernées ;
(12) considérant que l'accord sur les aspects des droits de propriété intellectuelle qui touchent au commerce (ADPIC) (5), signé par la Communauté européenne et ses États membres est entré en vigueur; que cet accord prévoit que la protection conférée par un brevet doit être assurée pour les produits et les procédés dans tous les domaines de la technologie ;
(13) considérant que le cadre juridique communautaire pour la protection des inventions biotechnologiques peut se limiter à la définition de certains principes applicables à la brevetabilité de la matière biologique en tant que telle, principes ayant notamment pour but de déterminer la différence entre inventions et découvertes à propos de la brevetabilité de certains éléments d'origine humaine, à l'étendue de la protection conférée par un brevet sur une invention biotechnologique, à la possibilité de recourir à un système de dépôt complétant la description écrite et, enfin, à la possibilité d'obtenir des licences obligatoires non exclusives pour dépendance entre des variétés végétales et des inventions, et inversement ;
(14) considérant qu'un brevet d'invention n'autorise pas son titulaire à mettre l'invention en oeuvre, mais se borne à lui conférer le droit d'interdire aux tiers de l'exploiter à des fins industrielles et commerciales; que, dès lors, le droit des brevets n'est pas susceptible de remplacer ni de rendre superflues les législations nationales, européennes ou internationales, fixant d'éventuelles limitations ou interdictions, ou organisant un contrôle de la recherche et de l'utilisation ou de la commercialisation de ses résultats, notamment par rapport aux exigences de santé publique, de sécurité, de protection de l'environnement, de protection des animaux, de préservation de la diversité génétique et par rapport au respect de certaines normes éthiques ;
(15) considérant que ni le droit national ni le droit européen des brevets (convention de Munich) ne comportent, en principe, d'interdiction ou d'exclusion frappant la brevetabilité de la matière biologique ;
(16) considérant que le droit des brevets doit s'exercer dans le respect des principes fondamentaux garantissant la dignité et l'intégrité de l'Homme; qu'il importe de réaffirmer le principe selon lequel le corps humain, dans toutes les phases de sa constitution et de son développement, cellules germinales comprises, ainsi que la simple découverte d'un de ses éléments ou d'un de ses produits, y compris la séquence ou séquence partielle d'un gène humain, ne sont pas brevetables; que ces principes sont conformes aux critères de brevetabilité prévus par le droit des brevets, critères selon lesquels une simple découverte ne peut faire l'objet d'un brevet ;
(17) considérant que des progrès décisifs dans le traitement des maladies ont d'ores et déjà pu être réalisés grâce à l'existence de médicaments dérivés d'éléments isolés du corps humain et/ou autrement produits, médicaments résultant de procédés techniques visant à obtenir des éléments d'une structure semblable à celle d'éléments naturels existant dans le corps humain; que, dès lors, il convient d'encourager, par le système des brevets, la recherche tendant à obtenir et à isoler de tels éléments précieux pour la production de médicaments ;
(18) considérant que, dans la mesure où le système des brevets s'avère insuffisant pour inciter à la recherche et à la production de médicaments issus de biotechnologies et nécessaires pour lutter contre les maladies rares ou dites «orphelines», la Communauté et les États membres ont l'obligation d'apporter une réponse adéquate à ce problème ;
(19) considérant que l'avis n° 8 du groupe de conseillers pour l'éthique de la biotechnologie de la Commission européenne a été pris en compte ;
(20) considérant, en conséquence, qu'il est nécessaire d'indiquer qu'une invention qui porte sur un élément isolé du corps humain ou autrement produit par un procédé technique, et qui est susceptible d'application industrielle, n'est pas exclue de la brevetabilité, même si la structure de cet élément est identique à celle d'un élément naturel, étant entendu que les droits conférés par le brevet ne s'étendent pas au corps humain et à ses éléments dans leur environnement naturel ;
(21) considérant qu'un tel élément isolé du corps humain ou autrement produit n'est pas exclu de la brevetabilité puisqu'il est, par exemple, le résultat de procédés techniques l'ayant identifié, purifié, caractérisé et multiplié en dehors du corps humain, techniques que seul l'être humain est capable de mettre en oeuvre et que la nature est incapable d'accomplir par elle-même ;
(22) considérant que le débat sur la brevetabilité de séquences ou de séquences partielles de gènes donne lieu à des controverses; que, aux termes de la présente directive, l'octroi d'un brevet à des inventions portant sur de telles séquences ou séquences partielles doit être soumis aux mêmes critères de brevetabilité que pour tous les autres domaines technologiques, nouveauté, activité inventive et application industrielle; que l'application industrielle d'une séquence ou d'une séquence partielle doit être exposée de façon concrète dans la demande de brevet telle que déposée ;
(23) considérant qu'une simple séquence d'ADN sans indication d'une fonction ne contient aucun enseignement technique; qu'elle ne saurait, par conséquent, constituer une invention brevetable ;
(24) considérant que, pour que le critère d'application industrielle soit respecté, il est nécessaire, dans le cas où une séquence ou une séquence partielle d'un gène est utilisée pour la production d'une protéine ou d'une protéine partielle, de préciser quelle protéine ou protéine partielle est produite ou quelle fonction elle assure ;
(25) considérant, pour l'interprétation des droits conférés par un brevet, que lorsque des séquences se chevauchent seulement dans les parties qui ne sont pas essentielles à l'invention, le droit des brevets considère chacune d'entre elles comme une séquence autonome ;
(26) considérant que, si une invention porte sur une matière biologique d'origine humaine ou utilise une telle matière, dans le cadre du dépôt d'une demande de brevet, la personne sur laquelle le prélèvement est effectué doit avoir eu l'occasion d'exprimer son consentement éclairé et libre à celui-ci, conformément au droit national ;
(27) considérant que, si une invention porte sur une matière biologique d'origine végétale ou animale ou utilise une telle matière, la demande de brevet devrait, le cas échéant, comporter une information concernant le lieu géographique d'origine de cette matière, si celui-ci est connu; que ceci est sans préjudice de l'examen des demandes de brevet et de la validité des droits résultant des brevets délivrés ;
(28) considérant que la présente directive n'affecte en rien les fondements du droit des brevets en vigueur selon lequel un brevet peut être accordé pour toute nouvelle application d'un produit déjà breveté ;
(29) considérant que la présente directive ne concerne pas l'exclusion de la brevetabilité des variétés végétales et des races animales; que, en revanche, les inventions portant sur des plantes ou des animaux sont brevetables si leur application n'est pas techniquement limitée à une variété végétale ou à une race animale ;
(30) considérant que la notion de variété végétale est définie par la législation relative à la protection des obtentions végétales; que, selon ce droit, une obtention est caractérisée par l'intégralité de son génome et qu'elle est par conséquent individualisée et se différencie nettement d'autres obtentions ;
(31) considérant qu'un ensemble végétal caractérisé par un gène déterminé (et non par l'intégralité de son génome) n'est pas soumis à la protection des obtentions; que, de ce fait, il n'est pas exclu de la brevetabilité, même lorsqu'il englobe des obtentions végétales ;
(32) considérant que, si l'invention se borne à modifier génétiquement une variété végétale déterminée et si une nouvelle variété végétale est obtenue, elle reste exclue de la brevetabilité, même lorsque cette modification génétique n'est pas le résultat d'un procédé essentiellement biologique mais d'un procédé biotechnologique ;
(33) considérant qu'il est nécessaire de définir aux fins de la présente directive quand un procédé d'obtention de végétaux ou d'animaux est essentiellement biologique ;
(34) considérant que la présente directive n'affecte pas les notions d'invention et de découverte telles que déterminées par le droit des brevets, que celui-ci soit national, européen ou international ;
(35) considérant que la présente directive n'affecte pas les dispositions des législations nationales en matière de brevets selon lesquelles les procédés de traitement chirurgical ou thérapeutique du corps humain ou animal et les méthodes de diagnostic pratiquées sur l'organisme humain ou animal sont exclus de la brevetabilité ;
(36) considérant que l'accord ADPIC prévoit, pour les membres de l'Organisation mondiale du commerce, la possibilité d'exclure de la brevetabilité les inventions dont il est nécessaire d'empêcher l'exploitation commerciale sur leur territoire pour protéger l'ordre public ou la moralité, y compris pour protéger la santé et la vie des personnes et des animaux ou préserver les végétaux, ou pour éviter de graves atteintes à l'environnement, à condition que cette exclusion ne tienne pas uniquement au fait que l'exploitation est interdite par leur législation ;
(37) considérant que la présente directive se doit d'insister sur le principe selon lequel des inventions dont l'exploitation commerciale serait contraire à l'ordre public ou aux bonnes moeurs doivent être exclues de la brevetabilité ;
(38) considérant qu'il importe aussi de mentionner dans le dispositif de la présente directive une liste indicative des inventions exclues de la brevetabilité afin de donner aux juges et aux offices de brevets nationaux des orientations générales aux fins de l'interprétation de la référence à l'ordre public ou aux bonnes moeurs; que cette liste ne saurait bien entendu prétendre à l'exhaustivité; que les procédés dont l'application porte atteinte à la dignité humaine, comme par exemple les procédés de production d'êtres hybrides, issus de cellules germinales ou de cellules totipotentes humaines et animales, doivent, bien évidemment, être exclus eux aussi de la brevetabilité ;
(39) considérant que l'ordre public et les bonnes moeurs correspondent notamment à des principes éthiques ou moraux reconnus dans un État membre, dont le respect s'impose tout particulièrement en matière de biotechnologie en raison de la portée potentielle des inventions dans ce domaine et de leur lien inhérent avec la matière vivante; que ces principes éthiques ou moraux complètent les examens juridiques normaux de la législation sur les brevets, quel que soit le domaine technique de l'invention ;
(40) considérant qu'un consensus existe au sein de la Communauté quant au fait que l'intervention génique germinale sur l'homme et le clonage de l'être humain sont contraires à l'ordre public et aux bonnes moeurs; qu'il importe par conséquent d'exclure sans équivoque de la brevetabilité les procédés de modification de l'identité génétique germinale de l'être humaine et les procédés de clonage des êtres humains ;
(41) considérant que les procédés de clonage des êtres humains peuvent se définir comme tout procédé, y compris les techniques de scission des embryons, ayant pour but de créer un être humain qui aurait la même information génétique nucléaire qu'un autre être humain vivant ou décédé ;
(42) considérant, en outre, que les utilisations d'embryons humains à des fins industrielles ou commerciales doivent également être exclues de la brevetabilité; que, en tout état de cause, une telle exclusion ne concerne pas les inventions ayant un objectif thérapeutique ou de diagnostic qui s'appliquent à l'embryon humain et lui sont utiles ;
(43) considérant que l'article F, paragraphe 2, du traité sur l'Union européenne prévoit que l'Union respecte les droits fondamentaux, tels qu'ils sont garantis par la Convention européenne de sauvegarde des droits de l'Homme et des libertés fondamentales, signée à Rome le 4 novembre 1950, et tels qu'ils résultent des traditions constitutionnelles communes aux États membres, en tant que principes généraux du droit communautaire ;
(44) considérant que le Groupe européen d'éthique des sciences et des nouvelles technologies de la Commission évalue tous les aspects éthiques liés à la biotechnologie; que, à cet égard, il convient de remarquer que la consultation de ce groupe, y compris en ce qui concerne le droit des brevets, ne peut se situer qu'au niveau de l'évaluation de la biotechnologie au regard des principes éthiques fondamentaux ;
(45) considérant que les procédés de modification de l'identité génétique des animaux de nature à provoquer chez eux des souffrances sans utilité médicale substantielle dans le domaine de la recherche, de la prévention, du diagnostic ou de la thérapeutique, pour l'homme ou l'animal, ainsi que les animaux issus de tels procédés, doivent être exclus de la brevetabilité ;
(46) considérant que, le brevet ayant pour fonction de récompenser l'inventeur par l'octroi d'un droit exclusif, mais limité dans le temps, au titre de sa créativité, et d'encourager ainsi l'activité inventive, le titulaire du brevet doit avoir le droit d'interdire l'utilisation d'une matière autoreproductible brevetée dans des circonstances analogues à celles où l'utilisation de produits brevetés non autoreproductibles pourrait être interdite, c'est-à-dire la production du produit breveté lui-même ;
(47) considérant qu'il est nécessaire de prévoir une première dérogation aux droits du titulaire du brevet lorsque du matériel de reproduction incorporant l'invention protégée est vendu à un agriculteur à des fins d'exploitation agricole par le titulaire du brevet ou avec son consentement ; que cette première dérogation doit autoriser l'agriculteur à utiliser le produit de sa récolte pour reproduction ou multiplication ultérieure sur sa propre exploitation et que l'étendue et les modalités de cette dérogation doivent être limitées à l'étendue et aux modalités prévues par le règlement (CE) n° 2100/94 du Conseil du 27 juillet 1994 instituant un régime de protection communautaire des obtentions végétales (6) ;
(48) considérant que seule la rémunération envisagée par le droit communautaire des obtentions végétales en tant que modalité d'application de la dérogation à la protection communautaire des obtentions végétales peut être exigée de l'agriculteur ;
(49) considérant, cependant, que le titulaire du brevet peut défendre ses droits contre l'agriculteur abusant de la dérogation ou contre l'obtenteur qui a développé la variété végétale incorporant l'invention protégée si celui-ci ne respecte pas ses engagements ;
(50) considérant qu'une deuxième dérogation aux droits du titulaire du brevet doit autoriser l'agriculteur à utiliser le bétail protégé à un usage agricole ;
(51) considérant que l'étendue et les modalités de cette deuxième dérogation doivent être réglées par les lois, les dispositions réglementaires et les pratiques nationales, en l'absence de législation communautaire concernant l'obtention de races animales ;
(52) considérant que, dans le domaine de l'exploitation des nouvelles caractéristiques végétales issues du génie génétique, un accès garanti moyennant rémunération doit être accordé sous forme de licence obligatoire lorsque, par rapport au genre ou à l'espèce concerné, la variété végétale représente un progrès technique important d'un intérêt économique considérable par rapport à l'invention revendiquée dans le brevet ;
(53) considérant que, dans le domaine de l'utilisation en génie génétique de nouvelles caractéristiques végétales issues de nouvelles variétés végétales, un accès garanti moyennant rémunération doit être accordé sous forme de licence obligatoire lorsque l'invention représente un progrès technique important d'un intérêt économique considérable ;
(54) considérant que l'article 34 de l'accord ADPIC contient une réglementation détaillée de la charge de la preuve qui s'impose à tous les États membres; que, par conséquent, il n'y a pas lieu de prévoir dans la présente directive une disposition à ce sujet ;
(55) considérant que la Communauté, à la suite de la décision 93/626/CEE (7), est partie à la convention sur la diversité biologique du 5 juin 1992; que, à cet égard, les États membres, dans le cadre de la mise en vigueur des dispositions législatives, réglementaires et administratives nécessaires pour se conformer à la présente directive, tiennent compte notamment de l'article 3, de l'article 8, point j), et de l'article 16, paragraphe 2, deuxième phrase, et paragraphe 5, de ladite convention ;
(56) considérant que la troisième conférence des parties signataires de la convention sur la diversité biologique, qui s'est tenue en novembre 1996, a reconnu, dans la décision III/17, que « des travaux supplémentaires sont nécessaires pour contribuer au développement d'une appréciation commune de la relation entre les droits de propriété intellectuelle et les dispositions afférentes de l'accord sur les aspects commerciaux des droits de propriété intellectuelle et de la convention sur la diversité biologique, notamment sur les questions relatives aux transferts de technologies, la conservation et l'utilisation durable de la biodiversité et le partage équitable des bénéfices de l'utilisation des ressources génétiques, y compris la protection des connaissances, innovations et pratiques des communautés indigènes et locales incarnant des modes de vie traditionnels importants pour la conservation et l'utilisation durable de la biodiversité »,
ONT ARRÊTÉ LA PRÉSENTE DIRECTIVE :
CHAPITRE I - Brevetabilité
Article 1 er
1. Les États membres protègent les inventions biotechnologiques au moyen de leur droit national des brevets. Ils adaptent leur droit national des brevets, si nécessaire, pour tenir compte des dispositions de la présente directive.
2. La présente directive n'affecte pas les obligations découlant, pour les États membres, des conventions internationales, et notamment de l'accord ADPIC et de la convention sur la diversité biologique.
Article 2
1. Aux fins de la présente directive, on entend par:
a) «matière biologique»: une matière contenant des informations génétiques et qui est autoreproductible ou reproductible dans un système biologique ;
b) « procédé microbiologique »: tout procédé utilisant une matière microbiologique, comportant une intervention sur une matière microbiologique ou produisant une matière microbiologique.
2. Un procédé d'obtention de végétaux ou d'animaux est essentiellement biologique s'il consiste intégralement en des phénomènes naturels tels que le croisement ou la sélection.
3. La notion de variété végétale est définie à l'article 5 du règlement (CE) n° 2100/94.
Article 3
1. Aux fins de la présente directive, sont brevetables les inventions nouvelles, impliquant une activité inventive et susceptibles d'application industrielle, même lorsqu'elles portent sur un produit composé de matière biologique ou en contenant, ou sur un procédé permettant de produire, de traiter ou d'utiliser de la matière biologique.
2. Une matière biologique isolée de son environnement naturel ou produite à l'aide d'un procédé technique peut être l'objet d'une invention, même lorsqu'elle préexistait à l'état naturel.
Article 4
1. Ne sont pas brevetables :
a) les variétés végétales et les races animales ;
b) les procédés essentiellement biologiques pour l'obtention de végétaux ou d'animaux.
2. Les inventions portant sur des végétaux ou des animaux sont brevetables si la faisabilité technique de l'invention n'est pas limitée à une variété végétale ou à une race animale déterminée.
3. Le paragraphe 1, point b), n'affecte pas la brevetabilité d'inventions ayant pour objet un procédé microbiologique, ou d'autres procédés techniques, ou un produit obtenu par ces procédés.
Article 5
1. Le corps humain, aux différents stades de sa constitution et de son développement, ainsi que la simple découverte d'un de ses éléments, y compris la séquence ou la séquence partielle d'un gène, ne peuvent constituer des inventions brevetables.
2. Un élément isolé du corps humain ou autrement produit par un procédé technique, y compris la séquence ou la séquence partielle d'un gène, peut constituer une invention brevetable, même si la structure de cet élément est identique à celle d'un élément naturel.
3. L'application industrielle d'une séquence ou d'une séquence partielle d'un gène doit être concrètement exposée dans la demande de brevet.
Article 6
1. Les inventions dont l'exploitation commerciale serait contraire à l'ordre public ou aux bonnes moeurs sont exclues de la brevetabilité, l'exploitation ne pouvant être considérée comme telle du seul fait qu'elle est interdite par une disposition légale ou réglementaire.
2. Au titre du paragraphe 1 ne sont notamment pas brevetables :
a) les procédés de clonage des êtres humains ;
b) les procédés de modification de l'identité génétique germinale de l'être humain ;
c) les utilisations d'embryons humains à des fins industrielles ou commerciales ;
d) les procédés de modification de l'identité génétique des animaux de nature à provoquer chez eux des souffrances sans utilité médicale substantielle pour l'homme ou l'animal, ainsi que les animaux issus de tels procédés.
Article 7
Le Groupe européen d'éthique des sciences et des nouvelles technologies de la Commission évalue tous les aspects éthiques liés à la biotechnologie.
CHAPITRE II - Étendue de la protection
Article 8
1. La protection conférée par un brevet relatif à une matière biologique dotée, du fait de l'invention, de propriétés déterminées s'étend à toute matière biologique obtenue à partir de cette matière biologique par reproduction ou multiplication sous forme identique ou différenciée et dotée de ces mêmes propriétés.
2. La protection conférée par un brevet relatif à un procédé permettant de produire une matière biologique dotée, du fait de l'invention, de propriétés déterminées s'étend à la matière biologique directement obtenue par ce procédé et à toute autre matière biologique obtenue, à partir de la matière biologique directement obtenue, par reproduction ou multiplication sous forme identique ou différenciée et dotée de ces mêmes propriétés.
Article 9
La protection conférée par un brevet à un produit contenant une information génétique ou consistant en une information génétique s'étend à toute matière, sous réserve de l'article 5, paragraphe 1, dans laquelle le produit est incorporé et dans laquelle l'information génétique est contenue et exerce sa fonction.
Article 10
La protection visée aux articles 8 et 9 ne s'étend pas à la matière biologique obtenue par reproduction ou multiplication d'une matière biologique mise sur le marché sur le territoire d'un État membre par le titulaire du brevet ou avec son consentement, lorsque la reproduction ou la multiplication résulte nécessairement de l'utilisation pour laquelle la matière biologique a été mise sur le marché, pourvu que la matière obtenue ne soit pas utilisée ensuite pour d'autres reproductions ou multiplications.
Article 11
1. Par dérogation aux articles 8 et 9, la vente ou une autre forme de commercialisation de matériel de reproduction végétal par le titulaire du brevet ou avec son consentement à un agriculteur à des fins d'exploitation agricole implique pour celui-ci l'autorisation d'utiliser le produit de sa récolte pour reproduction ou multiplication par lui-même sur sa propre exploitation, l'étendue et les modalités de cette dérogation correspondant à celles prévues à l'article 14 du règlement (CE) n° 2100/94.
2. Par dérogation aux articles 8 et 9, la vente ou une autre forme de commercialisation d'animaux d'élevage ou autre matériel de reproduction animal par le titulaire du brevet ou avec son consentement à un agriculteur implique pour celui-ci l'autorisation d'utiliser le bétail protégé à un usage agricole. Ceci inclut la mise à disposition de l'animal ou autre matériel de reproduction animal pour la poursuite de son activité agricole, mais non la vente dans le cadre ou le but d'une activité de reproduction commerciale.
3.L'étendue et les modalités de la dérogation prévue au paragraphe 2 sont régies par les lois, les dispositions réglementaires et les pratiques nationales.
CHAPITRE III - Licences obligatoires pour dépendance
Article 12
1. Lorsqu'un obtenteur ne peut obtenir ou exploiter un droit d'obtention végétale sans porter atteinte à un brevet antérieur, il peut demander une licence obligatoire pour l'exploitation non exclusive de l'invention protégée par ce brevet, dans la mesure où cette licence est nécessaire pour l'exploitation de la variété végétale à protéger, moyennant une redevance appropriée. Les États membres prévoient que, lorsqu'une telle licence est accordée, le titulaire du brevet a droit à une licence réciproque à des conditions raisonnables pour utiliser la variété protégée.
2. Lorsque le titulaire d'un brevet concernant une invention biotechnologique ne peut exploiter celle-ci sans porter atteinte à un droit d'obtention végétale antérieur sur une variété, il peut demander une licence obligatoire pour l'exploitation non exclusive de la variété protégée par ce droit d'obtention, moyennant une redevance appropriée. Les États membres prévoient que, lorsqu'une telle licence est accordée, le titulaire du droit d'obtention a droit à une licence réciproque à des conditions raisonnables pour utiliser l'invention protégée.
3. Les demandeurs des licences visées aux paragraphes 1 et 2 doivent établir:
a) qu'ils se sont vainement adressés au titulaire du brevet ou du droit d'obtention végétale pour obtenir une licence contractuelle ;
b) que la variété ou l'invention représente un progrès technique important d'un intérêt économique considérable par rapport à l'invention revendiquée dans le brevet ou à la variété végétale protégée.
4. Chaque État membre désigne la ou les autorités compétentes pour octroyer la licence. Lorsqu'une licence sur une variété végétale ne peut être octroyée que par l'Office communautaire des variétés végétales, l'article 29 du règlement (CE) n° 2100/94 s'applique.
CHAPITRE IV - Dépôt d'une matière biologique, accès à une telle matière et nouveau dépôt
Article 13
1. Lorsqu'une invention porte sur de la matière biologique non accessible au public et ne pouvant être décrite dans la demande de brevet pour permettre à une personne du métier de réaliser l'invention, ou implique l'utilisation d'une telle matière, la description n'est réputée suffisante pour l'application du droit des brevets que si :
a) la matière biologique a été déposée au plus tard le jour du dépôt de la demande de brevet auprès d'une institution de dépôt reconnue. Sont reconnues au moins les institutions de dépôt internationales ayant acquis ce statut conformément à l'article 7 du traité de Budapest du 28 avril 1977 sur la reconnaissance internationale du dépôt de micro-organismes aux fins de la procédure en matière de brevets, ci-après dénommé «traité de Budapest » ;
b) la demande déposée contient les informations pertinentes dont dispose le déposant sur les caractéristiques de la matière biologique déposée ;
c) la demande de brevet mentionne l'institution de dépôt et le numéro de dépôt.
2. L'accès à la matière biologique déposée est assuré par la remise d'un échantillon:
a) jusqu'à la première publication de la demande de brevet, uniquement aux personnes autorisées en vertu du droit national des brevets ;
b) entre la première publication de la demande de brevet et la délivrance du brevet, à toute personne qui en fait la requête ou, si le déposant le demande, uniquement à un expert indépendant ;
c) après la délivrance du brevet et nonobstant une révocation ou annulation du brevet, à toute personne qui en fait la requête.
3. La remise n'a lieu que si le requérant s'engage, pour la durée des effets du brevet:
a) à ne communiquer à des tiers aucun échantillon de la matière biologique déposée ou d'une matière qui en serait dérivée
et
b) à n'utiliser aucun échantillon de la matière biologique déposée ou d'une matière qui en serait dérivée, sauf à des fins expérimentales, à moins que le demandeur ou le titulaire du brevet ne renonce expressément à un tel engagement.
4. En cas de rejet ou de retrait de la demande, l'accès à la matière déposée est limité, à la demande du déposant, à un expert indépendant pendant vingt ans à compter de la date de dépôt de la demande de brevet. Dans ce cas, les dispositions du paragraphe 3 sont applicables.
5. Les demandes du déposant visées au paragraphe 2, point b), et au paragraphe 4 ne peuvent être introduites que jusqu'à la date où les préparatifs techniques de la publication de la demande de brevet sont réputés achevés.
Article 14
1. Lorsque la matière biologique déposée conformément à l'article 13 cesse d'être disponible auprès de l'institution de dépôt reconnue, un nouveau dépôt de la matière est autorisé dans les mêmes conditions que celles prévues par le traité de Budapest.
2. Tout nouveau dépôt doit être accompagné d'une déclaration signée par le déposant certifiant que la matière biologique qui fait l'objet du nouveau dépôt est la même que celle qui faisait l'objet du dépôt initial.
CHAPITRE V - Dispositions finales
Article 15
1. Les États membres mettent en vigueur les dispositions législatives, réglementaires et administratives nécessaires pour se conformer à la présente directive au plus tard le 30 juillet 2000. Ils en informent immédiatement la Commission.
Lorsque les États membres adoptent ces dispositions, celles-ci contiennent une référence à la présente directive ou sont accompagnées d'une telle référence lors de leur publication officielle. Les modalités de cette référence sont arrêtées par les États membres.
2. Les États membres communiquent à la Commission le texte des dispositions de droit interne qu'ils adoptent dans le domaine régi par la présente directive.
Article 16
La Commission transmet au Parlement européen et au Conseil :
a) tous les cinq ans à compter de la date prévue à l'article 15, paragraphe 1, un rapport sur la question de savoir si la présente directive a soulevé des problèmes au regard des accords internationaux sur la protection des droits de l'homme, auxquels les États membres ont adhéré ;
b) dans un délai de deux ans après l'entrée en vigueur de la présente directive, un rapport tendant à évaluer les implications dans le domaine de la recherche fondamentale en génie génétique de la non-publication ou publication tardive de documents dont l'objet pourrait être brevetable ;
c) tous les ans à compter de la date prévue à l'article 15, paragraphe 1, un rapport sur l'évolution et les implications du droit des brevets dans le domaine de la biotechnologie et du génie génétique.
Article 17
La présente directive entre en vigueur le jour de sa publication au Journal officiel des Communautés européennes.
Article 18
Les États membres sont destinataires de la présente directive.
Fait à Bruxelles, le 6 juillet 1998.
Par le Parlement européen
Le président
J. M. GIL-ROBLES
Par le Conseil
Le président
R. EDLINGER
(1) JO C 296 du 8.10.1996, p. 4.
JO C 311 du 11.10.1997, p. 12.
(2) JO C 295 du 7.10.1996, p. 11.
(3) Avis du Parlement européen du 16 juillet 1997 (JO C 286 du 22.9.1997, p. 87), position commune du Conseil du 26 février 1998 (JO C 110 du 8.4.1998, p. 17) et décision du Parlement européen du 12 mai 1998 (JO C 167 du 1.6.1998). Décision du Conseil du 16 juin 1998.
(4) JO C 68 du 20.3.1995, p. 26.
(5) JO L 336 du 23.12.1994, p. 213.
(6) JO L 227 du 1.9.1994, p. 1. Règlement modifié par le règlement (CE) n° 2506/95 (JO L 258 du 28.10.1995, p. 3).
(7) JO L 309 du 13.12.1993, p. 1.
ANNEXE
III -
LISTE DES PERSONNES AUDITIONNÉES
PAR LE RAPPORTEUR
- M. Henri BOSCH , senior european patent attorney pour Monsanto Company ;
- M. François BURGAUD , directeur des relations extérieures et de la communication du Groupement national interprofessionnel des semences et plans (GNIS) ;
- M. Philippe DELIVET , conseiller technique pour les affaires juridiques et la propriété industrielle au cabinet du ministre délégué à l'industrie ;
- M. François DESPREZ , vice-président du GNIS, président directeur général des établissements Floriment-Desprez, président de la SICASOV ;
- Maître Gérard DOSSMANN , avocat associé au cabinet Casalonga-Josse ;
- M. Jean-Christophe GALLOUX , professeur de droit à Paris II ;
- Mme Martine HIANCE , directeur général adjoint de l'Institut national de la propriété industrielle (INPI) ;
- M. Pierre-Benoît JOLY , directeur de recherche à l'Institut national de recherche agronomique ;
- M. Rolf JÖRDENS , secrétaire général adjoint de l'Union internationale pour la protection des obtentions végétales (UPOV) ;
- Mme Murielle ROBERT-LEMEUR , docteur en sciences, collaborateur au cabinet Casalonga-Josse ;
- M. Jean LUNEL , membre de la commission du génie biomoléculaire (CGB) ;
- M. Marc MAJEROWICZ , conseil en propriété industrielle pour le cabinet Breese Majerowicz ;
- M. Jean-Philippe MULLER , chef du service biotechnologie à l'Institut national de la propriété industrielle (INPI) ;
- M. Stéphane PASTEAU , directeur des relations institutionnelles et industrielles de Monsanto Agriculture France ;
- M. Pierre ROGER , directeur de la propriété industrielle de Limagrain ;
- Mme Anne ROUBAN , Direction générale de l'industrie, des technologies de l'information et des postes (DIGITIP) du ministère en charge de l'Economie, des finances et de l'industrie ;
- Docteur Philippe POULETTY , président de France Biotech ;
- M. Didier SICARD , président du comité consultatif national d'éthique pour les sciences de la vie et de la santé ;
- M. Michel VIVANT , professeur de droit à l'université de Montpellier ;
- M. Alain WEIL , délégué scientifique au centre de coopération internationale en recherche agronomique pour le développement (CIRAD).
TABLEAU COMPARATIF
* 1 Rapport 2002-2003 n°301 « Quelle politique des biotechnologies pour la France ? » de M. Jean Bizet, président, et M. Jean-Marc Pastor, rapporteur, au nom de la commission des Affaires économiques du Sénat et de la mission d'information sur les enjeux économiques et environnementaux des organismes génétiquement modifiés.
* 2 D'après le rapport Innovation and Competitiveness in European Biotechnololgy - Entreprise Papers n° 7, 2002 de la Commission européenne, ces 2000 milliards d'euros se répartissent en :
-1500 milliards d'applications industrielles (dont environ 100 Mds pour les technologies environnementales)
- 500 à 800 milliards d'applications médicales et pharmaceutiques
* 3 Selon le président de France Biotech, le coût moyen des recherches pour développer un nouveau médicament s'élève à 800 millions de dollars.
* 4 Le Forum consultatif sur les biotechnologies est une instance mise en place par le Président Clinton et le Président Prodi en mai 2000. Il s'agit d'un groupe d'experts indépendants européens et américains
* 5 Elle est même peut-être plus affectée que ses partenaires européens du fait d'un niveau bien moindre de soutiens publics au secteur : 60 millions d'euros en 2002 et 135 millions d'euros en 2003 contre environ 500 millions d'euros au Royaume-Uni et 400 millions d'euros en Allemagne (source : rapport de France Biotech, décembre 2003).
* 6 Ces 3 handicaps ont été identifiés par le rapport de 2004 du groupe consultatif pour la compétitivité européenne dans les biotechnologies, placé auprès de la Commission.
* 7 En octobre 2004, la mise en place du brevet communautaire bute toujours sur le problème du nombre de langues de traduction, malgré l'accord politique intervenu au Conseil le 3 mars 2003.
* 8 Danemark, Finlande, Irlande, Royaume-Uni, Grèce, Espagne, Suède, Italie et Portugal.
* 9 A la liste précédente, s'ajoutent la Hongrie, la Lettonie, Malte, la Pologne, la Slovaquie et la République tchèque.
* 10 Ce recours était soutenu par l'Italie et aussi par la Norvège, non membre de l'UE mais signataire de la convention de Munich instaurant l'Office européen des brevets (qui était directement concerné par la directive 98/44)
* 11 Résolution 1996-1997 n°587 de l'Assemblée nationale sur la proposition de directive du Parlement européen et du Conseil relative à la protection juridique des inventions biotechnologiques.
* 12 Rapport intitulé « la brevetabilité du vivant », enregistré le 20 décembre 2001.
* 13 Bien que certains opposants à celle-ci comme M. Alain Claeys continuent d'appeler à une renégociation de l'article 5 (rapport sur les conséquences des modes d'appropriation du vivant sur les plans économiques, juridiques et éthique, rédigé dans le cadre de l'Office parlementaire d'évaluation des choix scientifiques et technologiques, enregistré le 4 mars 2004).
* 14 En fait, seulement -et logiquement- son chapitre I relatif à la brevetabilité, le chapitre II relatif à l'étendue de la protection étant du ressort des tribunaux nationaux.
* 15 Seule habilitée à prononcer les astreintes
* 16 Décision du Conseil constitutionnel n°2004-498 DC du 29 juillet 2004
* 17 La seule interdiction formelle posée aux Etats-Unis date de 2000 et porte sur le génome humain, considéré comme patrimoine commun de l'humanité.
* 18 La matière biologique est définie à l'article 2 al. 1 de la directive comme «une matière contenant des informations génétiques et qui est autoreproductible ou reproductible dans un système biologique ».
* 19 Ce sont précisément les dispositions relatives au corps humain qui ont donné lieu au rejet de la première version du texte par le Parlement européen en 1994.
* 20 Rappel : la Charte des droits fondamentaux de l'Union européenne fait partie intégrante du traité constitutionnel européen.
* 21 Il est ainsi remédié à une source de malentendu interne à la directive, qui avait d'ailleurs été pointée par les rapports de M. Alain Claeys de 2001 et 2004.
* 22 Cette saisine par des députés et sénateurs de l'opposition se plaçait sur le terrain de la conformité des règles de la propriété intellectuelle au principe constitutionnel de libre communication des pensées (article 11 de la déclaration du 26 août 1789).
* 23 Cette idée de la dépossession soutenue par certains scientifique part en effet du constat que l'essentiel des espèces végétales et animales encore peu connues sont précisément concentrées dans les pays qui n'ont pas les moyens techniques d'en tirer profit. C'est la problématique de l'accès à la diversité biologique.
* 24 Bien que datant de quatre ans, le rapport de M. Alain Claeys de décembre 2001 a le mérite de soulever quelques unes de ces interrogations.
* 25 Aux articles 1 er , 2, 3, 5.
* 26 Ainsi qu'aux exclusions, par principe, de la brevetabilité.
* 27 Arrêt Diamond/ Chakrabarty, 447 US 303(1980) concernant l'invention d'une bactérie de création humaine, génétiquement manipulée, capable de décomposer le pétrole brut.
* 28 Rapport sénatorial 2002-2003 n° 301 « Quelle politique des biotechnologies pour la France ? », de M. Jean Bizet, président, et M. Jean-Marc Pastor, rapporteur, au nom de la Commission des Affaires économiques et de la mission d'information sur les enjeux économiques et environnementaux des organismes génétiquement modifiés, page 384.
* 29 Brevet sur une souris oncogène « Myc Mouse », sollicité par l'université de Harvard.
* 30 Convention sur le brevet européen du 5 octobre 1973.
* 31 Rapport 2002-2003 n°301 « Quelle politique des biotechnologies pour la France ? » de M. Jean Bizet, président, et M. Jean-Marc Pastor, rapporteur, au nom de la commission des Affaires économiques du Sénat et de la mission d'information sur les enjeux économiques et environnementaux des organismes génétiquement modifiés.
* 32 Cité par M. Michel Vivant dans un article de doctrine « Réinventer l'invention ? », paru en juillet 2003 dans la revue Propriétés intellectuelles n°8.
* 33 In Anthropologie du point de vue pragmatique .
* 34 Quoique moins large que l'acception initialement retenue par l'Office américain des brevets en matière biologique.
* 35 Entendue comme contrariété à « l'ordre public et aux bonnes moeurs ».
* 36 Et, s'agissant de l'article 6, seulement ses dispositions non relatives à l'être humain, soit les points 1 et 2 d) de cet article.
* 37 Généralement vingt ans à compter de la date de dépôt.
* 38 Les articles 16-1 du Code civil : « Le corps humain, ses éléments et ses produits ne peuvent faire l'objet d'un droit patrimonial » et 16-5 du même code : « Les conventions ayant pour effet de conférer une valeur patrimoniale au corps humain, à ses éléments ou à ses produits sont nulles » y ont été insérés par la loi bioéthique n° 94-653 du 29 juillet 1994.
* 39 Avis n°64 du 8 juin 2000 sur l'avant-projet de loi portant transposition, dans le code de la propriété intellectuelle, de la directive 98/44/CE du Parlement européen et du Conseil, en date du 6 juillet 1998, relative à la protection juridique des inventions biotechnologiques.
* 40 Pour plus de détails, cf. les travaux parlementaires sur la loi n°2004-800 du 6 août 2004 relative à la bioéthique : rapport Sénat 2002-2003 n°128 de M. Francis Giraud au nom de la Commission des Affaires sociales, commentant l'article 12 bis introduit en première lecture à l'Assemblée nationale ; Journal officiel des débats du Sénat du 29 janvier 2003 p. 429 à 438; rapports Assemblée nationale 2002-2003 n°761 de M. Pierre-Louis Fagniez au nom de la Commission des affaires culturelles, commentant les articles 12 bis et 12 ter , et n°709 de Mme Valérie Pécresse au nom de la Commission des lois saisie pour avis ; Journal officiel des débats de l'Assemblée nationale du 11 décembre 2003 p. 12119 à 12131.
* 41 Découlant elles-mêmes des exceptions prévues à l'article 53 b) de la Convention de Munich du 5 octobre 1973 sur le brevet européen, à leur tour fondées sur l'article 2 b) de la Convention de Strasbourg du 27 novembre 1963.
* 42 Le 14 juin 2001, dans l'affaire C-377/98 opposant le Royaume des Pays-Bas au Parlement européen et au Conseil de l'Union européenne.
* 43 Instituant un régime de protection communautaire des obtentions végétales.
* 44 Et à l'article 9 de la directive, que l'article 6 du présent texte transpose en créant un nouvel article L. 613-2-2 dans le code de la propriété intellectuelle.
* 45 Mais que ne transposait pas l'article L. 611-19 du code que créait l'article 17 de la loi bioéthique du 6 août 2004.
* 46 Qui se contentait de poser le principe de non brevetabilité de tels procédés à l'article L. 611-19 du code que créait son article 17.
* 47 L'alinéa de l'article en question transpose l'article 6 b) de la directive 98/44/CE.
* 48 En 1988 par l'Office des brevets américain et en 1992 par l'Office européen des brevets.
* 49 Exemple cité par M. le député Alain Claeys, dans son rapport 2001-2002 n°160 (Sénat) intitulé « La brevetabilité du vivant » fait au nom de l'Office parlementaire d'évaluation des choix scientifiques et technologiques.
* 50 Voir notamment l'article de MM. Claude Henry et Michel Trommetter et de Mme Laurence Tubiana : « Innovations et droits de propriété intellectuelle : quels enjeux pour les biotechnologies ? »
* 51 Lors de la première lecture au Sénat du projet de loi relatif à la bioéthique, le 29 janvier 2003.
* 52 Alors même que l'Institut Curie à Paris, l'Institut Paoli- Calmette, à Marseille, ou l'Institut Gustave- Roussy avaient mis au point des analyses considérées comme plus fiables et largement moins coûteuses.
* 53 La jurisprudence s'accorde à considérer que le brevet d'un produit intermédiaire s'étend au produit fini qui l'inclut.
* 54 Affaire qui opposa un agriculteur, M. Percy Schmeiser, contre la firme Monsanto. Cette dernière accusait l'agriculteur de ne pas s'être pas procuré la licence nécessaire qui lui aurait permis de cultiver du colza génétiquement modifié, ce dernier assurant que ses champs avaient été « contaminés » par des cultures transgéniques situées à proximité de son exploitation. Le 21 mai 2004, après six ans de batailles juridiques, la Cour suprême du Canada, par une décision prise par cinq voix contre quatre, a donné raison à Monsanto.
* 55 Auteur du rapport 2001-2002 « La brevetabilité du vivant » au nom de l'Office parlementaire d'évaluation des choix scientifiques et technologiques n°160 (Sénat).
* 56 Règlement (CE) n°2100/94 du Conseil du 27 juillet 1994 instituant un régime de protection communautaire des obtentions végétales.
* 57 Laquelle ne doit pas être supérieure à celle qui serait nécessaire pour produire 92 tonnes de céréales.
* 58 L'Union internationale pour la protection des obtentions végétales (UPOV) est une organisation intergouvernementale qui a été fondée en 1961 pour coordonner la mise en oeuvre au niveau international des droits des obtenteurs végétaux établis par la Convention sur la protection des obtentions végétales. La Convention de l'UPOV a vu le jour en 1961. Elle a fait l'objet de révisions en 1972, 1978 et 1991. L'Acte de 1961 de la Convention est entré en vigueur en 1968, l'Acte additionnel de 1972 en 1977, l'Acte de 1978 en 1981, et l'Acte de 1991 le 24 avril 1998.
* 59 La révision de 1991 de la convention UPOV introduisit aussi la notion de « variétés essentiellement dérivées », qui améliore encore la protection du titulaire d'un certificat d'obtention végétale en évitant que des modifications mineures d'une variété ne masquent une contrefaçon déguisée.
* 60 Ainsi, entre les deux droits applicables (droit national inspiré de l'UPOV 1978 ou droit communautaire inspiré de l'UPOV 1991), l'obtenteur choisit selon le marché qu'il vise, sachant que le certificat communautaire, octroyé par l'Office communautaire des variétés végétales, d'ailleurs situé à Angers, lui coûte plus cher puisqu'il couvre plusieurs Etats.
* 61 Même si les Etats-Unis ont également adhéré à la convention UPOV de 1991.
* 62 Délégué scientifique pour les biotechnologies au Centre de coopération internationale en recherche agronomique pour le développement (CIRAD).
* 63 « Les Membres pourront prévoir des exceptions limitées aux droits exclusifs conférés par un brevet, à condition que celles-ci ne portent pas atteinte de manière injustifiée à l'exploitation normale du brevet ni ne causent un préjudice injustifié aux intérêts légitimes du titulaire du brevet, compte tenu des intérêts légitimes des tiers. »
* 64 Sous réserve des dispositions de l'article L. 623-4, qui prévoit que : « Toute obtention végétale peut faire l'objet d'un titre appelé "certificat d'obtention végétale", qui confère à son titulaire un droit exclusif à produire, à introduire sur le territoire où le présent chapitre est applicable, à vendre ou à offrir en vente tout ou partie de la plante, ou tous éléments de reproduction ou de multiplication végétale de la variété considérée et des variétés qui en sont issues par hybridation lorsque leur reproduction exige l'emploi répété de la variété initiale ».
* 65 Une variété essentiellement dérivée est une variété qui est principalement dérivée d'une variété initiale et qui en conserve les caractères essentiels.
* 66 D'ailleurs, le gouvernement allemand a choisi d'introduire l'exception du sélectionneur dans le projet de loi national de transposition de la présente directive.
* 67 Article 31 l)i).
* 68 Ainsi, la licence d'office est capable d'empêcher la formation d'un monopole sur un dispositif médical à visée thérapeutique ou diagnostique, sur une méthode de diagnostic ex vivo, ainsi que sur un procédé ou un produit nécessaire à l'obtention de tels dispositifs.







