3. Les médicaments et l'environnement : un système lacunaire
Les résidus médicamenteux, qu'il s'agisse de molécules excrétées ou de médicaments non utilisés, sont parmi les principaux xénobiotiques présents dans l'environnement. Tous ne sont pas des perturbateurs endocriniens mais certains le sont. L'existence de ce phénomène fait l'objet d'une prise de conscience nouvelle et mérite une analyse particulière.
a) La présence généralisée des médicaments dans l'environnement
Dans le cadre du plan national santé environnement 2004-2008, l'Office national de l'eau et des milieux aquatiques (ONEMA) 15 ( * ) a mené des campagnes exploratoires de mesure de contamination des eaux de surface et souterraines pour 76 composés pharmaceutiques, dont 23 médicaments à usage vétérinaire, 42 à usage humain et 11 métabolites. Les prélèvements d'eau ont été réalisés dans 141 sites dans trois bassins : Seine-Normandie, Rhône-Alpes et Adour-Garonne.
Dans les eaux de surface, au moins un de ces composants est rencontré dans tous les sites et dans 60 % des eaux souterraines testées . Parmi les produits les plus rencontrés figurent la Carbamazépine, un anticonvulsivant, et les lopromides qui sont des produits de contraste pour la radiologie. Les concentrations des substances recherchées sont de l'ordre de 10 ng/l mais peuvent être beaucoup plus importantes à la sortie des stations d'épuration , de l'ordre de 1 ug/l, seuil au-delà duquel des effets peuvent souvent être observés.
Les sites les plus pollués sont les effluents hospitaliers avec un fort impact potentiel des produits présents. Ils peuvent être mutagènes en raison de la forte présence de produits anticancéreux.
Les hormones sont également systématiquement détectées et posent directement des problèmes de perturbation endocrinienne.
Enfin, les antibiotiques sont également un sujet de préoccupation car ils sont présents dans tous les compartiments aquatiques et s'accumulent dans les sédiments. L'exposition permanente de l'environnement à ces résidus est suspectée de favoriser le développement de souches bactériennes résistantes susceptibles ensuite d'infecter les animaux et les hommes. Compte tenu de ce danger, leur usage préventif en aquaculture a été interdit et on cherche à préserver les antibiotiques à usage spécifique humain.
|
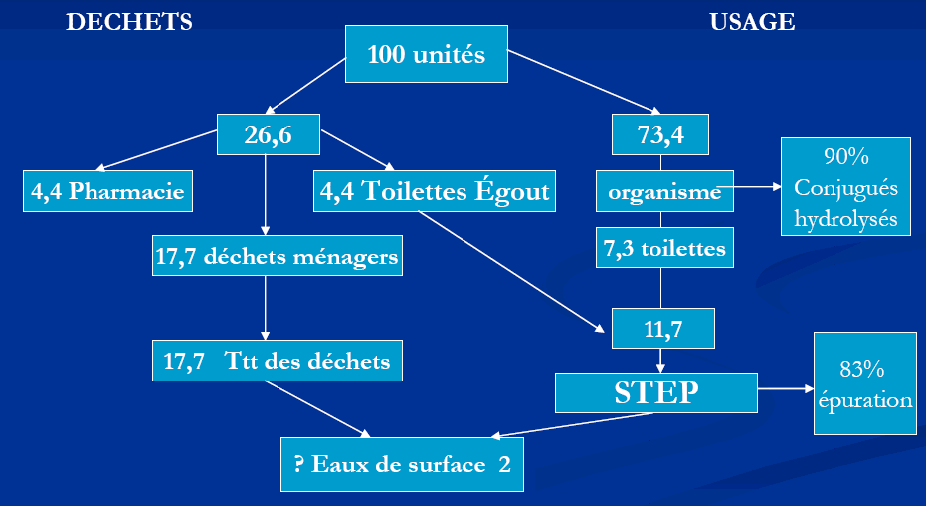
De la prescription au déchet dans l'eau, le mécanisme est schématiquement le suivant (exemple du métropol par unités utilisées, Bound et Vouvoulis, 2005 ) :
|
Si les risques pour l'environnement de ces rejets sont démontrés, il n'en est pas de même chez l'homme où le débat persiste.
b) Quelle dangerosité pour l'homme ?
Une fois décrite l'ampleur du phénomène, se pose la question de sa dangerosité pour l'homme. A ce sujet deux travaux sont le plus souvent cités.
Le premier est de Joyeux (2006) et visait à estimer quelle serait la dose de substance active absorbée au cours de 70 ans en buvant 2 litres d'eau du robinet par jour . Cette dose cumulée serait toujours inférieure à la dose thérapeutique journalière sauf pour quelques produits : clenbutérol (25,5), cyclophosphamide (2,5), salbutamol (2,5), le 17 á-éthinuylestradiol (2,5) et terbutaline (2,1).
Le second est de Christensen (1998). Il a estimé la dose journalière de 17 á-éthinylestradiol qui pouvait être absorbée par l'alimentation compte tenu des rejets dans l'environnement, des traitements et de sa concentration dans l'eau, les cultures de légumes et les poissons. Selon ces calculs, la dose journalière s'établissait à 0,0632 ug/kg dans le scénario le plus exposant. Or la production journalière d'E2 chez un garçon pré-pubère est d'environ 6ug/jour et chez l'adulte de 45 à 48 ug/j.
Ces résultats n'épuisent cependant pas la question et Jean-Marie Haguenoer regrettait auprès de votre rapporteur que les dossiers d'autorisation de mise sur le marché des médicaments ne tiennent pas compte des effets potentiels à long terme ou à faible dose tout au long de la vie et en cas de mélanges, ce qu'a mis en évidence un rapport récent.
c) Une régulation déficiente
Dans un rapport du Conseil général de l'environnement et du développement durable (CGEDD) de novembre 2010, intitulé Médicament et environnement, la régulation du médicament vis-à-vis du risque environnemental , les inspecteurs généraux de la santé publique vétérinaire Michel Bouvier et François Durand et l'ingénieur général des mines Rémi Guillet, dressent un état des lieux pointant les déficiences du système et son inadaptation à la fois aux nouvelles données de la science et aux préoccupations sociétales .
En matière de présence des médicaments dans l'environnement, les auteurs remarquaient qu'il s'agissait plus de l'émergence de la perception d'un risque que d'un risque émergent lui-même, puisque le risque existe depuis de longues années, mais ce n'est que récemment qu'on a disposé des capacités techniques de détection et des connaissances permettant d'envisager toutes les conséquences du phénomène. Cette prise de conscience a d'ailleurs conduit, après les plans santé environnement successifs, à lancer fin novembre 2009 la préparation d'un plan de réduction des résidus médicamenteux.
Ce plan paraît d'autant plus nécessaire que la France est le premier pays consommateur de médicaments dans l'Union européenne avec l'Allemagne qui compte pourtant 30 % de population supplémentaire. Les Français en consomment deux fois plus que les Britanniques pourtant aussi nombreux (source LEEM, 2009). La France est le 3 e marché au monde après les États-Unis et le Japon.
En matière vétérinaire, la France est également le premier marché de l'Union européenne, ce qui pourrait s'expliquer, mais le deuxième dans le monde, derrière les États-Unis, et devant le Brésil ou la Chine.
Tout porte donc à considérer cette question avec sérieux, les résidus médicamenteux prenant une place non négligeable dans l'ensemble des xénobiotiques présents dans l'environnement.
Malheureusement, le système de régulation des médicaments ne permet pas la connaissance de leur impact environnemental . Leur mise en circulation dépend d'une autorisation de mise sur le marché (AMM) au niveau de l'Union européenne. Le dossier d'autorisation est élaboré par le demandeur et vise à démontrer l'efficacité et la sûreté du produit, notamment son absence d'effets néfastes pour le patient. L'AMM, elle-même se fonde sur l'appréciation bénéfice-risque pour le patient et la santé publique. Il exclut aujourd'hui la prise en compte du risque pour l'environnement pour les médicaments humains alors qu'il le prend en compte pour le produit vétérinaire.
Toutefois, récemment, le droit communautaire a étendu la notion de sûreté du médicament à l'environnement récepteur des résidus.
C'est le cas pour les médicaments humains depuis décembre 2006 et la publication des lignes directrices de l'agence européenne du médicament sur la base de la directive 2004/27. Les produits vétérinaires sont régis, eux, par la directive 92/182 et font l'objet de ce nouveau critère depuis 1999.
L'obligation d'évaluation environnementale ne touche que les médicaments nouveaux , sauf modification majeure de l'AMM d'un ancien. Selon le rapport du CGEDD, « les lignes directrices de l'EMA dénaturent en fait le principe édicté par le droit communautaire d'obligation de connaissance de l'impact environnemental ». En effet, tout semble fait pour en restreindre le champ le plus possible . Pour l'homme, de nombreux produits en sont exclus : vitamines, vaccins, médicaments à base de plantes... Pour les animaux, seuls ceux qui sont destinés à être administrés collectivement à un cheptel de rente sont concernés, ce qui exclut tous les médicaments destinés aux animaux de compagnie et ceux donnés aux animaux d'élevage de manière non systématique à l'exception de l'aquaculture.
La démarche d'évaluation elle-même est organisée inversement à la démarche scientifique habituelle. La première étape n'est pas une évaluation de la dangerosité de la molécule mais consiste à calculer la concentration prévisionnelle dans l'environnement. Il s'agit d'un simple calcul théorique sans aucun essai. Si elle est inférieure à un certain seuil (10 ng/l dans les eaux de surface pour les médicaments à usage humain par exemple), l'évaluation conclut automatiquement à l'absence de risque et s'affranchit de toute autre étude. En revanche, si elle est positive, l'industriel doit procéder à l'évaluation de la concentration prévisionnelle sans effet pour l'environnement prenant en compte le devenir de la molécule et des essais d'écotoxicité. Ce mécanisme conduit à ce que cette deuxième étape, la seule où est évaluée l'écotoxicité, soit exceptionnelle . De plus, la molécule est toujours considérée isolément, indépendamment de tout mélange dans l'environnement.
Le CGEDD constate en outre que ce dispositif ne concerne pas les anciens médicaments. Or, il a relevé que l'on ne dispose pas de connaissances sur les effets environnementaux des dix médicaments les plus prescrits, des dix les plus vendus et des vingt médicaments cancérogènes avérés d'après le classement du CIRC .
Il note encore que les rares données environnementales des dossiers d'AMM ne sont pas accessibles , en contradiction avec le principe de transparence de la directive 2003/4 concernant l'accès du public à l'information en matière environnementale.
Ainsi, le médicament à usage humain est-il la seule substance chimique dans l'Union européenne à pouvoir se dispenser pour sa mise sur le marché d'un examen bénéfice-risque, eu égard à l'environnement . Sans porter préjudice à la santé, un tel dispositif permettrait d'encadrer l'usage ou de ne pas autoriser un produit nuisible à l'environnement et insuffisamment efficace.
* 15 L'Onema a été créé par la loi sur l'eau du 30 décembre 2006. Il emploie 960 personnes.