CHAPITRE
IV
HARMONISER LES RÈGLES RELATIVES
AUX CONTRIBUTIONS
PHARMACEUTIQUES
Article 16
Mise en
cohérence des contributions sur le champ des produits de
santé
Cet article vise :
- à fixer pour 2022 les montants M et Z au-delà desquels a vocation à s'appliquer la « clause de sauvegarde » ;
- à assurer différentes modifications dans le champ des assiettes des différentes contributions des entreprises exploitant des produits de santé, afin d'intégrer le nouveau dispositif d'accès direct et clarifier les dispositifs propres aux dispositifs médicaux.
La commission vous demander d'adopter cet article modifié par les amendements qu'elle a adoptés visant à poursuivre des harmonisations nécessaires dans la fiscalité des produits de santé.
I - Le dispositif proposé
A. La fixation des montants M et Z de déclenchement des clauses de sauvegarde pour 2022
1. Clause de sauvegarde du médicament
a) La fixation du montant M
Initialement introduite en 1999 afin de garantir un meilleur respect de l'objectif national de dépenses d'assurance maladie, la clause de sauvegarde applicable aux médicaments a été profondément remaniée en 2015, 2017, 2018 et 2020.
L'article L. 138-10 du code de la sécurité sociale prévoit une contribution des entreprises exploitant des médicaments lorsque leur chiffre d'affaires pour les spécialités inscrites à différentes listes ouvrant lieu à prise en charge par l'assurance maladie dépasse un montant M fixé par la loi. Cette contribution vise, aux termes de cet article, à assurer le respect de l'objectif national de dépenses d'assurance maladie.
Aux termes de l'article L. 138-10 du code de la sécurité sociale (CSS), lorsque le chiffre d'affaires réalisé au cours d'une année civile par l'ensemble des entreprises exploitant une ou plusieurs spécialités pharmaceutiques est supérieur à un montant déterminé par la loi (dit le « montant M »), l'ensemble de ces entreprises est assujetti à une contribution fiscale, dite « clause de sauvegarde des médicaments ».
Le chiffre d'affaires considéré est minoré du montant des remises conventionnelles consenties par les exploitants au moment de la négociation du prix de leurs spécialités, lorsque ces dernières sont admises au remboursement par les organismes d'assurance maladie. Autrement dit, l'assiette de la clause de sauvegarde des médicaments est constituée par la part des ventes du secteur pharmaceutique ayant donné lieu à un remboursement total ou partiel de l'assurance maladie .
La définition d'un montant M, seuil d'assujettissement de la clause, a donc pour vocation d'inciter les entreprises du secteur du médicament à maintenir le volume de cette part de leur chiffre d'affaires en-deçà de ce seuil .
Une fois déterminée l'assiette de la contribution (la part du chiffre d'affaires concernée supérieure au montant M), un barème progressif défini à l'article L. 138-12 lui est alors appliqué : la part inférieure à 1,005 fois le montant M est frappée d'un taux de prélèvement de 50 %, la part comprise entre 1,005 et 1,01 fois le montant M se voit appliquer un taux de 60 %, enfin la part supérieure à 1,01 fois le montant M est soumise à un taux de 70 %.
À titre d'exemple, pour un montant M défini par la loi à 1 milliard d'euros et pour une part du chiffre d'affaires du secteur ayant donné lieu à des dépenses d'assurance maladie de 2 milliards d'euros, la contribution due par le secteur au titre de la clause de sauvegarde serait égale à :
(5 000 000 x 50 %) + (5 000 000 x 60 %) + (990 000 000 x 70 %) = 698 500 000, soit 69,85 % de la part du chiffre d'affaires supérieure au montant M.
En raison de son caractère fortement prohibitif, l'efficacité de la clause de sauvegarde des médicaments se mesure davantage aux régulations ex ante que le secteur applique à la croissance de son activité qu'à son rendement, par conséquent peu élevé .
• Le IV fixe le montant M pour 2022 à 24,5 milliards d'euros.
Ce montant était fixé pour 2021 à 23,99 milliards d'euros.
b) La construction du montant M pour 2022
Interrogée sur la construction du montant M pour 2022, la direction de la sécurité sociale a indiqué à la rapporteure générale que celle-ci s'est éloignée de la trajectoire initiale fixée dans le cadre du CSIS de 2018 , en ce qu'il précisait que les clauses de sauvegarde devaient être construites sur la base du chiffre d'affaires autorisé et voté en LFSS.
Ainsi, au regard de la croissance exceptionnellement élevée en 2021, la base de construction de M 2022 correspond au chiffre d'affaires net estimé pour l'année 2021, et non pas au M 2021 .
La direction de la sécurité sociale estime en outre que l'Ondam 2022 « tient compte à la fois des efforts annoncés dans le cadre du CSIS 2021, des innovations thérapeutiques attendues pour 2022, ainsi que de la hausse tendancielle des dépenses relatives aux produits de santé, qui reste dynamique. Des économies relatives aux produits de santé sont indispensables pour assurer la pérennité de notre modèle de santé solidaire, et le respect de cet objectif ».
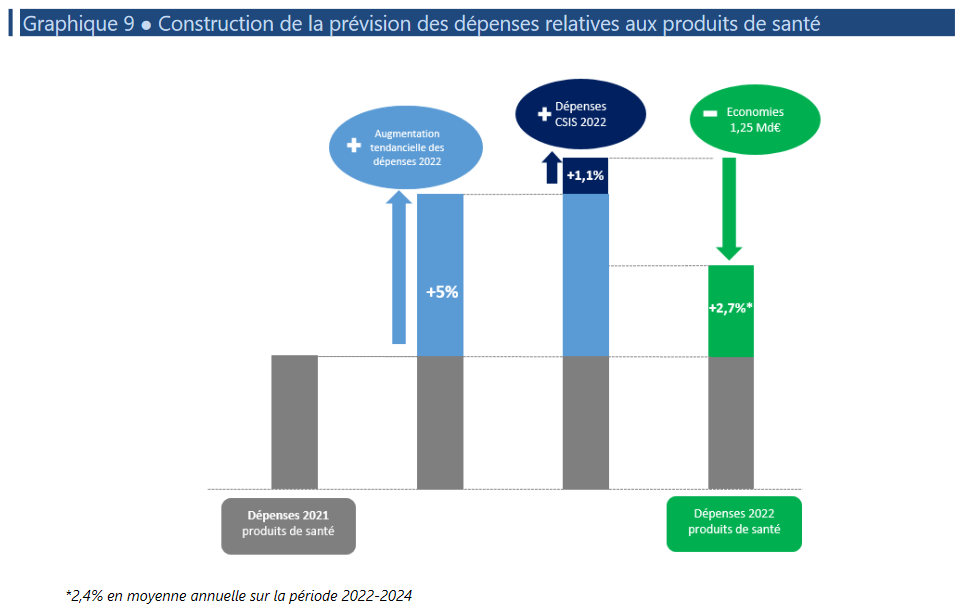
Le niveau d'économies ainsi sollicité pour les produits de santé s'élève pour 2022 à 1,25 milliard d'euros dont 1,03 milliard d'euros de baisses de prix. Ce niveau d'économies renoue avec les niveaux qui étaient ceux des années précédant la crise sanitaire.
• Particularité notable du PLFSS 2022, l'évaluation préalable et les hypothèses financières retenues anticipent un déclenchement de la clause de sauvegarde des médicaments qui, par nature, n'est pas censé intervenir. Son rendement est attendu à 125 millions d'euros .
Par ailleurs, concernant la prise en compte des déclinaisons des mesures du conseil stratégique des industries de santé (CSIS) 2021 qui a conduit au plan « Innovation santé 2030 » et à une série d'engagements du Président de la République et du Gouvernement en soutien à l'industrie du médicament, la DSS estime la clause de sauvegarde cohérente avec l'intégration au sein de l'Ondam 2022 de 410 millions d'euros de dépenses supplémentaires au titre du CSIS.
Construction de la prévision des dépenses relatives aux produits de santé
Source : Annexe 7 - Ondam du PLFSS 2022
• La progression des dépenses liées aux produits de santé serait ainsi, en prenant en compte leur dynamique tendancielle, les mesures CSIS et les économies attendues, en hausse de + 2,7 % sur l'année 2022 .
Pour rappel, l'engagement formulé à l'issue du CSIS 2021 est d'une moyenne de 2,4 % par an sur 2022-2024.
c) La trajectoire du montant Z
Concernant les anticipations pluriannuelles, l'évaluation préalable indique une perspective de montant M déclinant la trajectoire de l'Ondam et s'établissant a priori à 24,7 milliards d'euros pour 2023 et 24,9 milliards d'euros pour 2024.
2. Clause de sauvegarde du dispositif médical
a) La fixation du montant Z
Introduit en 2019 sur le modèle du montant M, l'article L. 138-19-8 du code de la sécurité sociale prévoit une contribution des entreprises exploitant des produits de santé autres que des médicaments, soit des dispositifs médicaux au-delà d'un certain montant Z.
À la différence du montant M pour les médicaments, le montant Z concerne non pas le chiffre d'affaires mais le montant remboursé par l'assurance maladie.
Pour rappel, la clause de sauvegarde des dispositifs médicaux prévoit une contribution à la charge des exploitants d'un ou plusieurs dispositifs médicaux inscrits sur la liste des produits et prestations remboursables (LPPR) et pris en charge par l'assurance maladie lorsqu'ils sont distribués en établissement de santé et financés au titre de la liste en sus .
Sont donc exclus de la contribution les dispositifs médicaux pris en charge par l'assurance maladie lorsqu'ils sont dispensés directement au patient par un distributeur détaillant (pharmacien d'officine ou prestataire de santé) ou lorsqu'ils sont pris en charge en établissement de santé au sein des groupements homogènes de séjour (GHS) .
L'exploitant d'un produit ou d'une prestation de santé devient redevable de la contribution lorsque le montant global remboursé par l'assurance maladie au cours d'une année civile au titre des dispositifs médicaux visés , minoré du montant de certaines remises, est supérieur à un montant Z , déterminé par la loi.
L'assiette de la contribution est égale au montant global de la dépense d'assurance maladie associée aux dispositifs médicaux concernés, minoré des remises conventionnelles. La contribution acquittable globale est égale à la différence entre l'assiette et le montant Z. Autrement dit, au-delà du montant Z, c'est de l'ensemble de la dépense d'assurance maladie dont deviennent redevables les entreprises du secteur .
• Le V fixe le montant Z pour 2022 à 2,15 milliards d'euros.
Ce montant était fixé pour 2021 à 2,09 milliards d'euros.
b) La trajectoire pluriannuelle avancée
L'évaluation préalable indique une perspective de baisse du montant Z à partir de 2023 , estimant un montant 2022 porté par l'effet des mesures du CSIS, qui prendront fin pour partie à l'issue de cette année.
B. Des mises en cohérence d'assiettes concernant les médicaments
1. Une mise en cohérence de l'assiette de la clause de sauvegarde
Le 1° du I étend l'assiette des médicaments pris en compte pour le calcul du chiffre d'affaires retenu pour le déclenchement de la clause de sauvegarde du médicament .
Sont ainsi ajoutées les prises en charge au titre de la reconnaissance des « AMM miroirs » intégrées à l'article 34 du présent PLFSS par la référence à l'article L. 162-18-1 du code de la sécurité sociale, ainsi que la prise en charge au titre du nouveau dispositif d'accès direct créé à l'article 36 de ce même texte.
Une mise en cohérence est également assurée au II de l'article L. 138-10 avec l'inscription dans les médicaments pris en compte des spécialités prises en charge et faisant l'objet d'une autorisation d'importation ( e) du 1° ). Le Gouvernement précise l'intention d'intégrer à la clause de sauvegarde l'ensemble des dépenses relatives aux médicaments.
Le 2° procède aux mêmes coordinations relatives aux dispositifs prévus aux articles 34 et 36 du PLFSS à l'article L. 138-11 du même code précisant l'assiette de la contribution comme entendue minorée des remises prévues à ces mêmes articles.
Le 3° intègre enfin les prises en charge au titre de l'accès direct au dispositif prévu à l'article L. 138-13 dudit code de remises conventionnelles pouvant être conclues avec les CEPS et permettre, au-delà d'un certain seuil, des exonérations en cas de déclenchement de la clause de sauvegarde.
2. Une mise en cohérence du champ des autres contributions
Sur le même mouvement d'intégration des dispositifs de prise en charge dérogatoire, les 8°, 9° et 10° procèdent à l'extension du champ de la contribution due au titre des dépenses promotionnelles les médicaments pour les médicaments pris en charge au titre de l'accès précoce ou au titre de l'accès direct . Les coordinations sont également réalisées concernant les règles d'abattement et d'exonérations.
Enfin, le 11° étend également la contribution sur le chiffre d'affaires aux mêmes médicaments pris en charge au titre des deux dispositifs dérogatoires précités.
C. Des ajustements concernant les dispositifs médicaux
1. Des modalités de calcul propres aux dispositifs médicaux
Si la clause de sauvegarde du médicament intègre aujourd'hui déjà les médicaments pris en charge au titre de l'accès précoce, la clause relative aux dispositifs médicaux n'intègre pas les dispositifs pris en charge à titre transitoire .
Le 4 ° modifie l'article L. 138-19-8 du code de la sécurité sociale et procède ainsi à l'intégration, dans l'assiette retenue, des produits et prestations pris en charge à titre transitoire en application de l'article L. 165-1-5 du même code et à l'intégration des majorations prévues à l'article L. 165-7 dudit code 300 ( * ) .
Le Gouvernement justifie cette extension par une mise en cohérence des assiettes du médicament et du dispositif médical, mais également par la nécessaire prise en compte de dispositifs présumés innovants, onéreux et donnant lieu à des versements par l'assurance maladie. Il s'agit en outre d'intégrer la réserve d'interprétation formulée en 2019 par le Conseil constitutionnel sur la clause de sauvegarde des dispositifs médicaux 301 ( * ) .
Le 5° et le a) du 6° procèdent aux mêmes mises en cohérence.
Le b) du 6° modifie lui le montant de la contribution due en cas de dépassement de la clause de sauvegarde en prévoyant que le plafond de contribution est établi au regard du montant remboursé et non du chiffre d'affaires réalisé. Cette modification est cohérente avec l'assiette de la contribution, prise sur ce montant remboursé. En conséquence, le 7° supprime le processus déclaratif du chiffre d'affaires par les entreprises.
D. Entrée en vigueur
Concernant les mises en cohérence d'assiettes sur les clauses de sauvegarde ou le champ de la contribution sur le chiffre d'affaires , le II prévoit une application dès 2021 .
Cependant, concernant la contribution des entreprises au titre de leurs activités promotionnelles , prévue à l'article 245-1 du code de la sécurité sociale, l'application se fera pour les exercices clos à compter du 31 décembre 2021 .
II - Les modifications adoptées par l'Assemblée nationale
L'Assemblée nationale a adopté cet article modifié par des précisions rédactionnelles.
III - La position de la commission
A. Une trajectoire financière discutable
1. Une progression très maîtrisée des montants M et Z dans un contexte de forte innovation
La rapporteure générale reconnaît la prise en compte, dans la construction des montants retenus pour la clause de sauvegarde, des engagements gouvernementaux pris à la suite du CSIS 2021 . Cet effort en direction des industries des produits de santé est bienvenu et nécessaire tant du point de vue de l'indispensable soutien à l'innovation que de la consolidation de la souveraineté sanitaire de notre pays .
Cependant, la rapporteure générale a été alertée par les industriels tant du médicament que des dispositifs médicaux sur les hypothèses retenues pour les années à venir.
Aussi, s'il constate l'effort consenti par le Gouvernement avec une croissance retenue pour 2022 à 2,7 %, le Leem a notamment souligné la divergence de plus en plus forte entre la croissance du marché du médicament et celle du budget régulé . Surtout, le Leem a interpellé la rapporteure générale sur la construction même de la clause de sauvegarde et les hypothèses retenues pour son calcul. Ainsi, selon ses représentants, la clause pourrait s'élever en 2022 à 450 millions d'euros, constituant un nouveau record.
De la même manière, le Snitem s'est inquiété d'un niveau du montant Z laissant craindre selon lui un déclenchement possible de la clause de sauvegarde . Cependant, interrogé sur ce point, le CEPS a indiqué à votre rapporteure estimer le risque de déclenchement comme faible , malgré une situation très incertaine du secteur du dispositif médical et la particularité du périmètre de cette clause de sauvegarde, susceptible de concerner de fortes innovations.
Concernant l'inscription dans l'étude d'impact d'un rendement attendu de la clause de sauvegarde du médicament, la rapporteure générale constate ici un changement de paradigme dans l'approche gouvernementale du partage entre économies attendues et déclenchement de la clause de sauvegarde .
• Aussi, le rendement prévisionnel apparaît désormais être une « garantie » du niveau de contribution, que les économies attendues aient été consenties ou non . Comme souligné par le CEPS, cette anticipation d'un rendement prévisionnel pourrait constituer une protection pour les industriels « contre l'aléa d'un calibrage qui se révélerait in fine excessif des économies par rapport à l'objectif M ».
Cependant, la rapporteure générale regrette les lacunes inhérentes au suivi de la maîtrise des dépenses de produits de santé, qui ne peuvent révisées opportunément en fonction de la réalisation constatée, du fait d'un calendrier décalé de déclaration.
2. Des économies attendues à des niveaux élevés
La commission a également été sensibilisée par les industriels sur les niveaux élevés d'économies attendues, qui retrouvent des montants pratiqués avant la crise sanitaire .
Interrogé sur la crédibilité de l'hypothèse d'économies retenue par le Gouvernement, le CEPS a indiqué à la rapporteure générale que « l'objectif de 0,83 milliard d'euros annoncé dans l'annexe est dans la partie haute de la fourchette des estimations du SG-CEPS. Il n'est donc pas exclu que l'atteinte de l'objectif contraigne à quelques décisions unilatérales ».
Surtout, le CEPS a souligné un exercice annuel de régulation par baisse de prix qui « s'inscrit dans un cadre contraint » aux multiples objectifs - notamment de financement de l'innovation et de préservation de la sécurité d'approvisionnement - qui restreint le périmètre des baisses de prix possibles .
Concernant le dispositif médical, le CEPS a considéré le montant d'économies demandé sur la liste des produits et prestations, à hauteur de 200 millions d'euros, comme « ambitieux, compte tenu notamment des difficultés rencontrées en 2021 pour réaliser le plan de baisse et des tensions fortes avec les prestataires de services et distributeurs de matériel ». Le CEPS a cependant souligné que les économies pour 2022 bénéficieront d'un effet report de grande ampleur - 110 millions d'euros estimés aujourd'hui -, permettant d'alléger la charge des nouvelles baisses de prix pesant sur les industriels et les prestataires en 2022.
Par ailleurs, la rapporteure générale constate que l'ensemble des « mises en cohérence » apportées par le présent article représentent en réalité des augmentations des contributions des industriels , que cela soit par l'impact attendu sur la clause de sauvegarde que sur les contributions sur le chiffre d'affaires ou les dépenses de promotion.
À ce titre, le Leem a fait état auprès de la rapporteure générale d'une éventuelle lacune relative à la prise en compte des dépenses de promotion pour ce qui est des médicaments en accès précoce, ces dépenses n'étant autorisées qu'après l'obtention de l'autorisation de mise sur le marché.
B. Des adaptations à prévoir
1. Une définition de l'assiette à préciser concernant la contribution sur le chiffre d'affaires
Dans le contexte de cet article de « mises en cohérence », la rapporteure générale estime pertinent de préciser le champ de l'assiette applicable à la contribution sur le chiffre d'affaires des entreprises du médicament.
Ainsi, il conviendrait de retrancher du chiffre d'affaire apprécié les remises consenties. La commission a ainsi adopté l'amendement n° 141 visant à préciser l'assiette de cette taxe et à en déduire les remises .
2. Une préoccupation relative aux génériques
En outre, alertée par le Gemme sur certaines fragilités du secteur des génériques, la rapporteure générale s'interroge sur les possibilités de mises en cohérence du traitement des spécialités, que celles-ci soient vendues en ville ou à l'hôpital . Il s'agit là également d'une définition plus fine du chiffre d'affaires appréciable, en l'espèce de l'intégration ou non des remises commerciales dans le périmètre de la clause de sauvegarde.
3. Des ajustements nécessaires concernant les dispositifs médicaux
Concernant la clause de sauvegarde des dispositifs médicaux, la rapporteure générale constate à nouveau les lacunes de construction initiale du mécanisme propre aux dispositifs médicaux. Il est nécessaire de mieux prendre en compte les particularités d'un secteur composé pour l'extrême majorité de TPE/PME et ses contraintes propres, du fait de dispositifs faisant l'objet d'un grand nombre de référencements pour de petites séries.
Elle estime ainsi nécessaires des évolutions concernant les conditions éventuelles de son déclenchement , sur le modèle de la clause de sauvegarde des médicaments et prenant en compte :
- un barème de taux progressifs ;
- une contribution ajustée au regard des efforts éventuellement déjà consentis par les industriels en amont .
La commission a à ce titre adopté l'amendement n° 140 visant à prévoir des taux progressifs de la contribution due en cas de dépassement de la clause de sauvegarde du dispositif médical .
La commission a enfin adopté un amendement n° 142 d'ordre rédactionnel.
La commission vous demande d'adopter cet article modifié par les amendements qu'elle a adoptés.
Article 16 bis
(nouveau)
Renforcer les sanctions contre les grossistes-répartiteurs
« short liners » qui ne respectent pas leurs obligations de
service public
Cet article, inséré par l'Assemblée nationale, prévoit une majoration de l'amende applicable en cas de sanction pour les « short liners » grossistes-répartiteurs manquant à leurs obligations de service public.
La commission vous demande d'adopter cet article modifié par l'amendement qu'elle a adopté.
I - Le dispositif proposé
A. Des sanctions prévues pour les grossistes-répartiteurs en cas de manquement à leurs obligations de service public
Aux termes de l'article L. 5124-17-2 du code de la santé publique, les grossistes-répartiteurs sont tenus de respecter, sur leur territoire, une série d'obligations de service public .
Celles-ci, déterminées par décret en Conseil d'État 302 ( * ) , comprennent par exemple notamment une obligation de satisfaire du lundi au samedi, à tout moment, la consommation habituelle de la clientèle durant deux semaines.
L'article L. 5423-5 du code de la santé publique prévoit des sanctions en cas de manquement par les grossistes-répartiteurs à leurs obligations légales de service public . La peine est fixée à deux ans d'emprisonnement et 150 000 euros d'amende.
B. Un renforcement des sanctions pour les « short liners »
Comme le rappelle la députée Audrey Dufeu, à l'initiative de cet article additionnel, les « shorts liners » concentrent leur activité sur la vente directe d'une série de références peu nombreuses et aux marges élevées avec, souvent, dans le même temps une activité parallèle d'export sur des produits contingentés par les laboratoires.
Sur ce sujet, l'Agence nationale de sécurité du médicament (ANSM) 303 ( * ) souligne que le respect de leurs obligations de service public conduit les grossistes-répartiteurs à disposer d'une collection suffisante de médicaments et de capacités de stockage adéquates en vue d'assurer les livraisons dans les délais. Or, si ces contraintes ont un coût pour les grossistes-répartiteurs, elles « sont indispensables à l'approvisionnement approprié et continu des patients en France » .
Surtout, l'Agence considère qu'au-delà de la question d'équité entre les acteurs de ce marché, la pratique des « shorts liners » « peut favoriser l'introduction des médicaments falsifiés dans la chaîne légale de distribution, compliquer la traçabilité et entraîner un asséchement du marché car certains "short-liners" achètent des médicaments à moindre coût en France pour les revendre dans d'autres pays européens ».
Aussi, le présent article 16 bis entend renforcer les sanctions à l'encontre des grossistes-répartiteurs dits « short liners » afin d'en décourager les pratiques et de les faire disparaître.
Il prévoit ainsi de compléter l'article L. 5423-5 du code de la santé publique afin de préciser qu' en cas de récidive, l'amende est portée à un maximum de 10 % du chiffre d'affaires annuel le plus élevé des trois derniers exercices connus à la date des faits.
Par ailleurs, la seconde phrase affecte le produit de l'amende pour manquement aux obligations de service public des grossistes répartiteurs à l'ANSM .
II - La position de la commission :
La rapporteure partage la préoccupation de l'Assemblée nationale de mieux lutter contre les pratiques préjudiciables de certains grossistes-répartiteurs.
Elle constate cependant que la majoration substantielle des sanctions pour récidive ne distingue pas précisément ces comportements et pourrait emporter des conséquences plus larges pour les grossistes répartiteurs.
Aussi, la commission a adopté un amendement n° 143 de la rapporteure visant à préciser que cette majoration s'applique « en cas de manquement grave et répété constituant un risque pour l'approvisionnement en médicaments ».
La commission vous demande d'adopter cet article modifié par l'amendement qu'elle a adopté.
Article 16 ter
(nouveau)
Moyens et missions des comités de protection des
personnes
Cet article, inséré par l'Assemblée nationale, élève le taux de la contribution sur le chiffre d'affaires des industries pharmaceutiques. En outre, il modifie les conditions de l'évaluation éthique des recherches impliquant la personne humaine et institue un cadre juridique spécifique pour les comités d'éthique locaux de la recherche afin de leur confier l'examen des recherches non interventionnelles.
Favorable à l'augmentation des moyens de fonctionnement des comités de protection des personnes, la commission vous demande d'adopter cet article modifié, néanmoins, par un amendement de suppression de son II dont les dispositions s'écartent du champ des LFSS et présentent, à ce titre, un risque d'inconstitutionnalité.
I - Le dispositif proposé
Résultant d'un amendement de M. Cyrille Isaac-Sibille ayant reçu, en première lecture à l'Assemblée nationale, des avis favorables de la commission et du Gouvernement, l'article 16 ter comporte deux types de mesures bien distinctes.
A. L'augmentation d'une taxe sur l'industrie pharmaceutique destinée à dégager des financements supplémentaires pour les comités de protection des personnes
Le I de l'article 16 ter relève de 0,18 % à 0,20 % le taux de la contribution sur le chiffre d'affaires à laquelle sont assujetties, en application de l'article L. 245-6 du code de la sécurité sociale, les entreprises pharmaceutiques.
Ce taux porte sur la contribution dite « de base » 304 ( * ) , assise sur le chiffre d'affaires hors taxes (CAHT) réalisé par la vente de l'ensemble des médicaments, remboursables ou non par l'assurance maladie, pour lesquels l'entreprise dispose d'une autorisation de mise sur le marché (AMM) ou d'une autorisation d'importation parallèle. N'est pas incluse dans cette assiette la vente des médicaments génériques ne faisant pas l'objet d'un remboursement sur la base d'un tarif forfaitaire de responsabilité ou dont le prix de vente est identique à celui de leur princeps , des médicaments orphelins et des médicaments dérivés du sang. N'est donc pas concernée par l'article 16 ter du PLFSS pour 2022 la contribution additionnelle prévue au VI de l'article L. 245-6 du code de la sécurité sociale.
En application du X de l'article L. 245-6 du code de la sécurité sociale, le produit de la contribution de base sur la vente des spécialités pharmaceutiques est affecté à la caisse nationale de l'assurance maladie (CNAM).
Le taux de la contribution de base de l'industrie pharmaceutique avait déjà fait l'objet d'une hausse de 0,01 % en loi de financement de la sécurité sociale pour 2021 305 ( * ) . Initialement estimé par le Leem à 3,2 millions d'euros (en base 2019), le rendement de cette hausse s'est établi à 2,5 millions d'euros selon des informations transmises par la direction générale de la santé.
Ces 2,5 millions d'euros ont été reversés par la CNAM à l'agence nationale de sécurité du médicament et des produits de santé (ANSM), qui autorise les recherches impliquant la personne humaine (RIPH) interventionnelles. 1,64 millions d'euros ont été conservés par l'agence pour financer 20,5 équivalents temps plein (ETP) et 860 000 euros 306 ( * ) ont été attribués par l'ANSM à 34 comités de protection des personnes (CPP), dans le cadre d'une opération pour compte de tiers, afin de financer 17 recrutements de personnel administratif pour permettre à chaque CPP de disposer d'1,5 ETP administratif.
L'attribution de ce financement aux CPP par l'ANSM est intervenue sur le fondement du dernier alinéa de l'article L. 5321-2 du code de la santé publique, qui autorise l'agence à « attribuer des subventions dans des conditions prévues par le conseil d'administration. ». Les montants que l'agence a dû reverser aux CPP ainsi que la liste des CPP bénéficiaires ont été déterminés par le directeur général de la santé dans une lettre adressée à la directrice générale de l'ANSM en date du 23 février 2021.
Comme en loi de financement de la sécurité sociale pour 2021 307 ( * ) , l'exposé des motifs de l'amendement souhaite une mobilisation du rendement supplémentaire tiré de la hausse de la contribution sur le CAHT des entreprises pharmaceutiques pour l'augmentation du financement des CPP. L'auteur de l'amendement précise que ce surplus de financement a vocation à permettre la revalorisation de l'indemnisation des membres des CPP assurant les fonctions de rapporteurs dans l'examen des projets de recherche, ainsi que le développement des moyens d'expertise des comités et l'harmonisation de leurs pratiques. Les CPP sont chargés de se prononcer sur l'évaluation éthique des RIPH dans le cadre de leur procédure d'autorisation.
Recouvré par l'assurance maladie, le rendement supplémentaire tiré de l'augmentation de la contribution de base sera, comme en 2021, reversé par la CNAM à l'ANSM par rectification de sa dotation annuelle. Pour 2022, l'augmentation de 0,02 % devrait permettre un rendement estimé par la direction de la sécurité sociale à cinq millions d'euros.
B. Une réforme d'ampleur de l'évaluation éthique des RIPH non interventionnelles
Le II de l'article 16 ter procède à une réforme des conditions de l'évaluation éthique des projets de recherche biomédicale à caractère non interventionnel.
Il est ainsi prévu de subordonner la mise en oeuvre d'une recherche non interventionnelle 308 ( * ) à l'avis favorable non plus d'un CPP mais d'un comité d'éthique local de la recherche agréé par le ministre de la santé. Cette mesure vise à décharger les CPP de l'examen de projets de recherche qui pèsent de façon disproportionnée dans leur activité et les empêchent de consacrer une part suffisante de leurs moyens, déjà limités, à l'étude des demandes d'essais cliniques.
L'article 16 ter du PLFSS pour 2022 précise ainsi, pour les comités d'éthique locaux de la recherche, leurs modalités d'agrément - ils doivent être agréés pour une durée déterminée par le ministre de la santé -, ainsi que leurs règles de fonctionnement et de composition - leurs membres seront nommés par le directeur général de l'agence régionale de santé territorialement compétente -, ces règles ayant vocation à être précisées par arrêté. Il institue, par ailleurs, une commission nationale de coordination et de recours des comités d'éthique locaux de la recherche, chargée de coordonner, d'harmoniser et d'évaluer les pratiques de ces comités, sur le modèle de la commission nationale des RIPH (CNRIPH) pour les CPP.
Toutefois, cette commission se voit reconnaître, à la différence de la CNRIPH, une compétence pour statuer « en appel » sur le recours formé, le cas échéant, par un promoteur contre un avis défavorable rendu par un comité d'éthique local de la recherche. À titre de comparaison, s'agissant des recherches interventionnelles, le droit en vigueur prévoit qu'en cas d'avis défavorable d'un CPP, le promoteur peut demander au ministre de la santé de soumettre le projet, pour un second examen, à un autre CPP.
L'article 16 ter du PLFSS pour 2022 institue, en outre, un dispositif permettant au ministre de la santé, par dérogation au principe de tirage au sort du CPP, de désigner le comité chargé d'examiner un projet de recherche « en cas de situation d'urgence ou de menace sanitaire grave nécessitant la mise en oeuvre sans délai d'une recherche ». Ce dispositif correspond à la pérennisation de la procédure accélérée (dite de « fast track »), prévue par l'article 17 de l'ordonnance n° 2020-460 du 22 avril 2020 309 ( * ) , qui permet au ministre de la santé, pendant la crise sanitaire et au plus tard jusqu'au 31 décembre 2021, de désigner le CPP se prononçant sur une RIPH en lien avec l'épidémie de covid-19.
L'article 16 ter du PLFSS pour 2022 confie également aux établissements de santé une mission de réflexion, en leur sein sur l'éthique liée à la recherche en santé et leur permet, à cette fin, de créer un comité d'éthique local de la recherche.
Enfin, dans l'objectif de faciliter de déploiement d'essais cliniques en ambulatoire, il est prévu d'autoriser leur réalisation « dans les domiciles des participants [aux] recherches », en modifiant à cet effet l'article L. 1121-13 du code de la santé publique relatif à l'autorisation des lieux de réalisation des recherches. Par coordination, est ouverte, à l'article L. 1121-1 du même code, la possibilité pour le promoteur de désigner des investigateurs chargés de coordonner la recherche « par site ou territoire », plutôt que par lieux, afin, par exemple, de permettre la coordination, au niveau d'un secteur géographique, d'un essai clinique mené en ambulatoire.
Le III de l'article 16 ter du PLFSS pour 2022 prévoit une entrée en vigueur du II - à l'exception de ses dispositions relatives à la réalisation d'essais cliniques en ambulatoire - à une date fixée par arrêté du ministre de la santé et, au plus tard, le 1 er juin 2022.
II - La position de la commission : supprimer des dispositions qui s'écartent du champ des lois de financement de la sécurité sociale
La commission milite de longue date pour un renforcement des moyens des CPP qui n'ont bénéficié, en 2021, que de 4,1 millions d'euros au titre du programme 204 « Prévention, sécurité sanitaire et offre de soins » de la mission « Santé » en loi de finances pour 2021 310 ( * ) , un montant inchangé par rapport à 2020. Dans son rapport sur les crédits de la mission « Santé » pour 2021, elle avait ainsi alerté sur le fait qu'« en dépit des promesses de la ministre des solidarités et de la santé fin 2018, 34 CPP sur 39 continuent de fonctionner avec seulement un équivalent temps plein », en rappelant qu'« avec un seul ETP, les CPP ne sont pas en capacité d'assurer la permanence administrative que requiert la gestion d'un flux croissant de dossiers, alimentée par le tirage au sort pour l'attribution de l'examen des projets de recherche. »
En conséquence, la commission est favorable à l'augmentation du taux de la contribution de base de l'industrie pharmaceutique. Cette mesure ne suscite, du reste, pas d'opposition des industriels qui aspirent également à ce que les CPP puissent se consacrer, dans des conditions optimales, à l'examen des demandes d'essais cliniques.
Pour autant, la commission s'interroge sur le circuit par lequel le rendement tiré de l'augmentation de la contribution de base sur la vente des spécialités pharmaceutiques vient alimenter le budget des CPP. Il a en effet vocation à être reversé, dans un premier temps, par la CNAM à l'ANSM par une majoration, en budget rectificatif pour 2022, de la dotation de l'assurance maladie à l'agence. Comme en 2021, l'ANSM devrait ensuite, en application du dernier alinéa de l'article L. 5321-2 du code de la santé publique, attribuer des subventions aux CPP, selon des modalités et une répartition définie par une instruction du directeur général de la santé. Ce circuit de financement apparaît néanmoins problématique dès lors que la commission entend fixer, à l'article 54 du PLFSS pour 2022, le montant de la dotation annuelle que la CNAM est censée verser à l'ANSM.
En outre, la commission rappelle qu'il a été mis fin, à compter du 1 er janvier 2012, à la perception par l'ANSM de taxes et redevances de l'industrie pharmaceutique, dans le souci de renforcer l'indépendance de l'agence. Il serait surprenant de reverser une part du produit d'une contribution des laboratoires pharmaceutiques dans le budget de l'agence, quand bien même il s'agirait de faire « transiter » cette ressource vers les CPP. En conséquence, la commission préconise le reversement du rendement tiré de l'augmentation de la contribution de base de l'industrie pharmaceutique sur la dotation nationale de financement des missions d'intérêt général et d'aide à la contractualisation (Migac) 311 ( * ) , afin qu'il vienne alimenter le budget des hôpitaux auxquels sont rattachés les CPP.
Par ailleurs, l'insertion dans un PLFSS de dispositions relatives aux conditions d'examen des projets de RIPH et à la création de comités d'éthique locaux de la recherche pose de sérieuses questions sur le plan constitutionnel. En effet, ces dispositions, qui concernent la sécurité du médicament et des produits de santé, sont manifestement étrangères au domaine des lois de financement de la sécurité sociale défini par l'article L.O. 111-3 du code de la sécurité sociale. Du reste, elles n'ont pas d'effet ou n'ont qu'un effet trop indirect sur les comptes sociaux.
En conséquence, le II de l'article 16 ter présente, au regard de la jurisprudence du Conseil constitutionnel sur les cavaliers sociaux, un risque d'inconstitutionnalité. Si la commission ne nie pas l'intérêt d'une réforme d'ampleur de l'évaluation éthique des recherches biomédicales, elle estime que des dispositions de cette nature n'ont pas leur place dans une LFSS mais plutôt dans une loi relative à la bioéthique ou à la sécurité du médicament. À cet égard, elle rappelle qu'une proposition de loi relative à l'évaluation éthique de la recherche impliquant la personne humaine a précisément été déposée par sa présidente, Mme Catherine Deroche, le 7 novembre 2019. Ce texte prévoit justement le retrait de l'examen des recherches non interventionnelles du champ d'activité des CPP pour le transférer à un « comité d'éthique des recherches non interventionnelles, de protection des personnes et de leurs données de santé ».
Dans ces conditions, la commission a adopté un amendement n° 144 de suppression du II de l'article 16 ter .
La commission vous demande d'adopter cet article modifié par l'amendement qu'elle a adopté.
* 300 Ces majorations sont intégrées au remboursement dans le cas où le montant facturé à l'établissement de santé est inférieur au tarif de responsabilité.
* 301 Considérant 42 de la décision n° 2019-795 DC du 20 décembre 2019 « (...)Dès lors, le montant remboursé mentionné aux articles L. 138-19-8, L. 138-19-9 et L. 138-19-10 du code de la sécurité sociale et au paragraphe II de l'article 23 de la loi déférée ne saurait, sans méconnaître l'exigence de prise en compte des facultés contributives résultant de l'article 13 de la Déclaration de 1789, être interprété comme incluant la majoration prévue à la seconde phrase du premier alinéa de l'article L. 165-7 du code de la sécurité sociale ».
* 302 Dispositions codifiées à l'article R. 5124-59 du code de la santé publique.
* 303 https://ansm.sante.fr/actualites/grossistes-repartiteurs-lansm-prend-des-mesures-a-lencontre-des-short-liners.
* 304 Mentionnée par le I de l'article L. 245-6 du code de la sécurité sociale.
* 305 Article 37 de la loi n° 2020-1576 du 14 décembre 2020 de financement de la sécurité sociale pour 2021.
* 306 Et non 850 000 euros comme initialement prévu par l'arrêté du 19 mai 2021 fixant le montant pour l'exercice 2021 du financement de l'agence nationale de sécurité du médicament et des produits de santé.
* 307 Loi n° 2020-1576 du 14 décembre 2020 de financement de la sécurité sociale pour 2021.
* 308 C'est-à-dire, aux termes du 3° de l'article L. 1121-1 du code de la santé publique, une recherche ne comportant aucun risque ni contrainte et dans laquelle tous les actes sont pratiqués et les produits utilisés de manière habituelle.
* 309 Ordonnance n° 2020-460 du 22 avril 2020 portant diverses mesures prises pour faire face à l'épidémie de covid-19.
* 310 Loi n° 2020-1721 du 29 décembre 2020 de finances pour 2021.
* 311 Mentionnée à l'article L. 162-22-13 du code de la sécurité sociale.