Article 26 (art. L. 165-11, L. 165-12 et L. 165-13 (nouveaux) du code de la sécurité sociale) Evaluation de certains dispositifs médicaux
Objet : Cet article instaure un dispositif d'évaluation des dispositifs médicaux intégrés dans les forfaits des groupes homogènes de séjour.
I - Le dispositif proposé
Depuis la mise en place de la tarification à l'activité (T2A), la procédure de droit commun pour le remboursement des dispositifs médicaux en secteur hospitalier consiste en leur intégration dans les forfaits de groupes homogènes de séjour (GHS). Certains dispositifs médicaux demeurent cependant financés en sus de la tarification à l'activité et sont pour cela inscrits sur la liste des produits et prestations remboursables. Il s'agit d'une dérogation prévue par la loi n° 2003-1199 du 18 décembre 2003 qui permet le financement en sus des médicaments et dispositifs médicaux coûteux et innovants. Les dispositifs médicaux inscrits sur une liste en sus fixée par arrêté du ministre après avis du conseil de l'hospitalisation peuvent ainsi bénéficier d'un remboursement intégral de la part prise en charge par les régimes d'assurance maladie obligatoire. Ils sont inscrits à la liste des produits et prestations remboursables sur la base de tarifs fixés par le Ceps. Subsistent donc, dans les établissements de santé, deux modalités de remboursement et de fixation des prix pour les dispositifs médicaux.
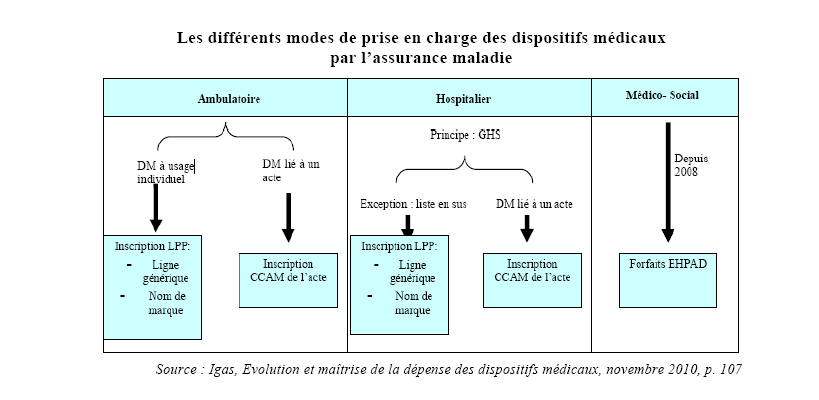
Cette dualité a des conséquences sur la connaissance des caractéristiques techniques et de sécurité des dispositifs médicaux : les produits inclus dans les forfaits de GHS ne sont soumis à aucune étude particulière tandis que l'intégration de dispositifs médicaux sur la liste en sus doit faire l'objet d'un avis de la commission nationale des dispositifs médicaux et des technologies de santé de la HAS.
L'étude d'impact du présent projet de loi met en lumière plusieurs des effets pervers qui peuvent résulter, pour les établissements de santé, de cette situation :
- le manque d'information sur les dispositifs médicaux inclus dans les GHS ne permet pas aux acheteurs de faire clairement la différence entre deux produits ; les décisions d'achat se fondent alors essentiellement sur les prix plutôt que sur une comparaison des bénéfices et risques de chacun ;
- le maintien sur la liste en sus peut être justifié non par le seul caractère innovant ou coûteux du dispositif médical, mais par la nécessité de disposer d'informations exhaustives sur celui-ci.
L'objectif du présent article est de rendre obligatoire l'évaluation par la HAS des dispositifs médicaux relevant d'un financement dans les GHS. Cette évaluation aurait pour but de valider leur intérêt thérapeutique et leur efficience par rapport aux alternatives mais également d'identifier un besoin éventuel d'études complémentaires.
A cet effet, il insère, à la suite de l'article L. 165-10 du code de la sécurité sociale, trois articles nouveaux.
L'article L. 165 - 11 dispose que l'achat, la fourniture, la prise en charge et l'utilisation par les établissements de santé de dispositifs médicaux inclus dans les groupes homogènes de séjour est limité aux produits inscrits sur une liste établie par arrêté des ministres chargés de la santé et de la sécurité sociale après avis de la commission nationale d'évaluation des dispositifs médicaux et technologies de santé de la HAS.
Les fabricants de dispositifs médicaux, leurs mandataires ou leurs distributeurs devront donc déposer auprès de la commission nationale des dispositifs médicaux et des technologies de santé une demande d'inscription sur la liste précitée, l'inscription déterminant l'intégration ou non dans les GHS.
La commission nationale des dispositifs médicaux et des technologies de santé rendra ses avis en fonction de trois critères :
- la validation de leur efficacité clinique ;
- la définition de spécifications techniques particulières ;
- l'appréciation de leur efficience au regard des alternatives thérapeutiques disponibles.
L'inscription sur la liste sera limitée dans le temps et renouvelable. L'inscription ou le renouvellement pourront conduire à ce que soient émises des conditions de prescription et d'utilisation et seront subordonnées à la réalisation, par les fabricants, leurs mandataires ou leurs distributeurs, d'études complémentaires demandées sur les produits.
L'article L. 165 - 12 prévoit des sanctions financières pour les établissements de santé qui achèteraient des dispositifs médicaux appartenant aux GHS sans être inscrits sur la liste qui doit être fixée par arrêté.
La sanction sera prononcée par le directeur général de l'ARS à l'issue d'une procédure contradictoire et de contrôles effectués sur pièces et sur place par les inspecteurs de santé publique ou les praticiens-conseils des organismes d'assurance maladie. Le montant de la sanction ne pourra excéder le coût total d'achat par l'établissement des produits considérés durant l'année précédant la constatation du manquement.
L'article L. 165-13 prévoit quant à lui des sanctions financières à l'encontre des fabricants, mandataires ou distributeurs qui ne feraient pas procéder aux études prévues par l'article L. 165-11 nouveau ou ne le feraient pas dans les délais.
La sanction financière sera prononcée par les ministres chargés de la santé et de la sécurité sociale à l'issue d'une procédure contradictoire. Le montant de la pénalité ne pourra excéder 10 % du chiffre d'affaires hors taxes réalisé en France sur le ou les produits considérés durant les douze mois précédant la constatation du manquement.
Le présent article prévoit deux décrets en Conseil d'Etat, pour préciser respectivement les articles L. 165-11 et L. 165-13. Il renvoie également, comme cela a été écrit précédemment, à un arrêté pris par les ministres chargés de la santé et de la sécurité sociale.
L'étude d'impact table sur une période transitoire estimée entre dix-huit et vingt-quatre mois qui doit permettre d'inclure progressivement les dispositifs médicaux dans le champ de la mesure en tenant compte de leur degré de risque tel qu'il est établi par la classification communautaire.
II - Les dispositions adoptées par l'Assemblée nationale
L'Assemblée nationale a adopté des amendements rédactionnels.
III - Le texte adopté par la commission
Sur proposition d'Isabelle Pasquet, Laurence Cohen, Annie David, Dominique Watrin et Guy Fischer, la commission a adopté un amendement relatif au pouvoir de sanction des ministres chargés de la santé et de la sécurité sociale, par coordination avec sa position à l'article 19 puis cet article ainsi modifié.







